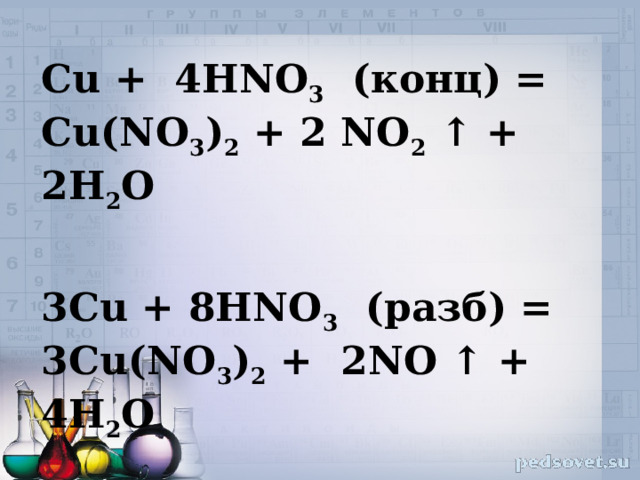«Знание только тогда знание, когда оно приобретено усилиями своей мысли, а не памятью»
Л. Н. Толстой


Её величество
Азотная кислота

Строение
HNO 3
Степень окисления азота в азотной кислоте равна +5. Связь – ковалентная полярная.
Кристаллическая решетка – молекулярная.
Физические свойства
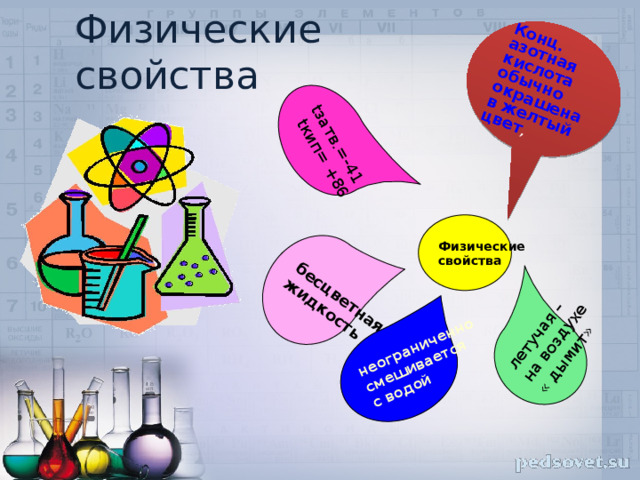
tзатв.=-41
tкип= +86
бесцветная
жидкость
неограниченно
смешивается
летучая –
с водой
на воздухе
Конц. азотная кислота обычно окрашена в желтый цвет ,
« дымит»
Физические
свойства
Действие на организм
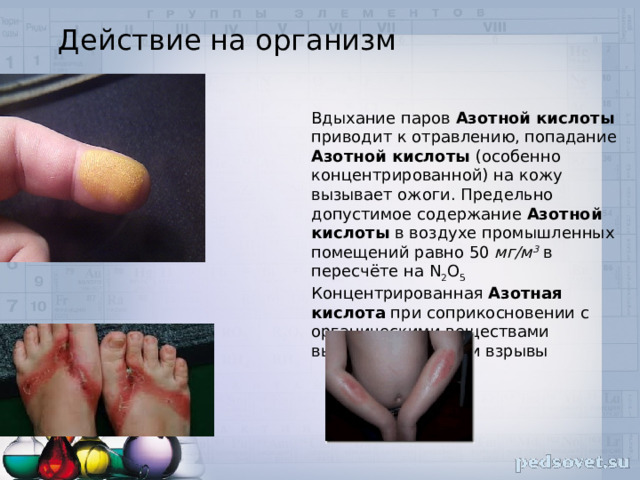
Вдыхание паров Азотной кислоты приводит к отравлению, попадание Азотной кислоты (особенно концентрированной) на кожу вызывает ожоги. Предельно допустимое содержание Азотной кислоты в воздухе промышленных помещений равно 50 мг/м 3 в пересчёте на N 2 O 5 Концентрированная Азотная кислота при соприкосновении с органическими веществами вызывает пожары и взрывы

Исследования (задания по группам).
1 группа : провести реакцию раствора азотной кислоты и
оксида меди (II), записать уравнение реакции, определить ее тип, признак реакции.
2 группа: провести реакцию растворов азотной кислоты и
гидроксида калия в присутствии фенолфталеина,
записать уравнение реакции, определить ее тип, признак реакции.
3 группа: провести реакцию растворов азотной кислоты и
карбоната натрия, записать уравнение реакции, определить её тип, признак реакции.
 H + +NO 3 - Изменяет окраску индикатора. 2. Реагирует с основными оксидами СuO+2 HNO 3 - Cu(NO 3 ) 2 +H 2 O 3. Реагирует с основаниями HNO 3 + KOH - KNO 3 + H 2 O 4. Реагирует с солями более летучих кислот Na 2 CO 3 + 2HNO 3 - 2NaNO 3 +H 2 CO 3 cухая / \ H 2 O CO 2 " width="640"
H + +NO 3 - Изменяет окраску индикатора. 2. Реагирует с основными оксидами СuO+2 HNO 3 - Cu(NO 3 ) 2 +H 2 O 3. Реагирует с основаниями HNO 3 + KOH - KNO 3 + H 2 O 4. Реагирует с солями более летучих кислот Na 2 CO 3 + 2HNO 3 - 2NaNO 3 +H 2 CO 3 cухая / \ H 2 O CO 2 " width="640"
Общие с другими кислотами:
1. Сильный электролит, хорошо диссоциируют на ионы
HNO 3 - H + +NO 3 -
Изменяет окраску индикатора.
2. Реагирует с основными оксидами
СuO+2 HNO 3 - Cu(NO 3 ) 2 +H 2 O
3. Реагирует с основаниями
HNO 3 + KOH - KNO 3 + H 2 O
4. Реагирует с солями более летучих кислот
Na 2 CO 3 + 2HNO 3 - 2NaNO 3 +H 2 CO 3
cухая / \
H 2 O CO 2

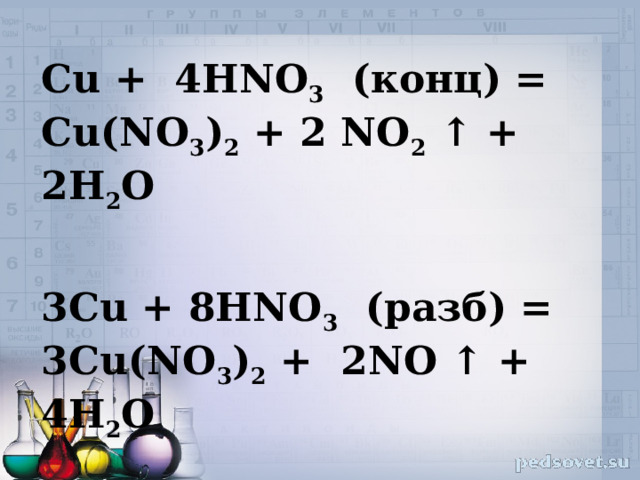
Cu + 4HNO 3 (конц) = Cu(NO 3 ) 2 + 2 NO 2 ↑ + 2H 2 O
3Cu + 8HNO 3 (разб) = 3Cu(NO 3 ) 2 + 2NO ↑ + 4H 2 O

Взаимодействие с металлами:
При взаимодействии с металлами образуются нитрат, вода и третий продукт по схеме:
HNO 3 (р.)+Me(до H 2 )→нитрат+H 2 O+NH 3 (NH 4 NO 3 )
HNO 3 (р.)+Me(после H 2 )→нитрат+H 2 O+NO
HNO 3 (к.)+Me(до H 2 )→нитрат+H 2 O+N 2 O(N 2 )
HNO 3 (к.)+Me(после H 2 )→нитрат+H 2 O+NO 2
Концентрированная HNO 3 на Al, Cr, Fe,Au, Pt не действует.



Уравнение реакции взаимодействия концентрированной азотной кислоты с ртутью.
4HN +5 O 3 + Hg 0 = Hg +2 (NO 3 ) 2 + 2N +4 O 2 + 2H 2 O
N +5 + 1e → N +4 1 2
Hg 0 – 2e → Hg +2 2 1
HNO 3 (за счет N +5 ) – окислитель, процесс восстановления;
Hg 0 – восстановитель, процесс окисления .

ГЛАУБЕР Иоганн Рудольф (1604-1670),
немецкий химик и врач. Получил
чистую азотную кислоту в 1650 году .
Получение
Действием конц. серной
кислоты на нитрат натрия
?
( Лаборатория)
(Промышленность )
?
NaNO3 + H2SO4 (конц) = NaHSO4 + HNO3

При каталитическом окислении бесцветного,
ядовитого газа А с характерным резким запахом
образуется вещество Б.
Вещество Б легко окисляется кислородом воздуха при обычных условиях и превращается в вещество В бурого цвета.
При растворении в воде и избытке кислорода вещество В образует только вещество Г.
Определите вещества А, Б, В, Г.
Составьте цепочку превращений с
участием этих веществ и осуществите ее.
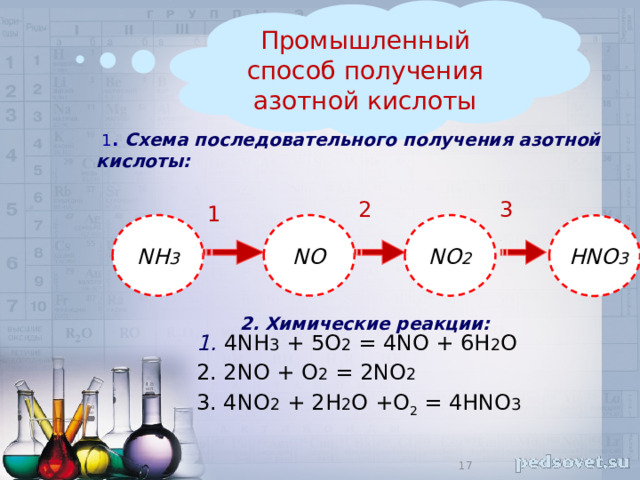
Промышленный способ получения азотной кислоты
1 . Схема последовательного получения азотной кислоты:
3
2
1
NО 2
NО
NH 3
НNО 3
1. 4NH 3 + 5О 2 = 4NO + 6Н 2 О
2. 2NO + O 2 = 2NO 2
3. 4NO 2 + 2H 2 O +O 2 = 4HNO 3
2. Химические реакции:
15


Проверь себя:
- Степень окисления азота в HNO 3 а)-3 б)0 в)+5 г)+4
- При хранении на свету HNO 3 а) краснеет; б) желтеет; в) остается бесцветной; г) чернеет .
- При взаимодействии с металлами азотная кислота является: а)окислителем; б)восстановителем; в)и тем, и другим ; г) ни тем, ни другим
- Азотная кислота в растворе не реагирует с веществом, формула которого: а) CO2 ; б) NaOH; в) Al(OH)3 ; г) NH3 .
- Царская водка- это а)концентрированный спирт; б)3 объема HCl и 1 объем HNO 3 ;
в) концентрированная азотная кислота; г)1 объем HCl и 3 объема HNO 3 .

Ключ:
1 - в
2 - б
3 - а
4 - а
5 - б

Вывод :
1. Азотной кислоте характерны общие свойства кислот:
реакция на индикатор, взаимодействие с оксидами металлов,
гидроксидами, солями более слабых кислот
обусловленные наличием в молекулах иона Н+ ;
2. Сильные окислительные свойства азотной кислоты
обусловлены строением ее молекулы;
При ее взаимодействии с металлами
никогда не образуется водород,
а образуются нитраты, оксиды азота
или другие его соединения (азот, нитрат аммония)
и вода в зависимости от концентрации кислоты и активности металла;
3. Сильные окислительные способности HNO3
широко применяются для получения различных важных
продуктов народного хозяйства (удобрения, лекарства, пластики и т.д.)

Домашнее задание:
§27 упр. 2,7 Творческие задания: способы получения азотной кислоты. Почему « царская водка» растворяет даже благородные металлы?













 H + +NO 3 - Изменяет окраску индикатора. 2. Реагирует с основными оксидами СuO+2 HNO 3 - Cu(NO 3 ) 2 +H 2 O 3. Реагирует с основаниями HNO 3 + KOH - KNO 3 + H 2 O 4. Реагирует с солями более летучих кислот Na 2 CO 3 + 2HNO 3 - 2NaNO 3 +H 2 CO 3 cухая / \ H 2 O CO 2 " width="640"
H + +NO 3 - Изменяет окраску индикатора. 2. Реагирует с основными оксидами СuO+2 HNO 3 - Cu(NO 3 ) 2 +H 2 O 3. Реагирует с основаниями HNO 3 + KOH - KNO 3 + H 2 O 4. Реагирует с солями более летучих кислот Na 2 CO 3 + 2HNO 3 - 2NaNO 3 +H 2 CO 3 cухая / \ H 2 O CO 2 " width="640"