
Министерство образования и науки Республики Бурятия
Государственное бюджетное образовательное учреждение
среднего профессионального образования
«Байкальский колледж туризма и сервиса»
Разработала: Рубцова Е.И.,
преподаватель химии
Улан-Удэ 2014

Цели :
Изучив тему «Алк ин ы» Выбудете:
1 .Объяснять строение, применяя основные положения теории химического строения.
2 .Раскрывать характер тройной связи.
3 .Составлять структурные формулы алк ин ов.
4 .Переходить от молекулярной формулы к структурным формулам возможных изомеров.
5 .Указывать типы реакций и составлять уравнения химических реакций, характерных для алк ин ов.

Главная

1. По И.Ю.П.А.К . (международная номенклатура названий органических веществ)
АЛКИНЫ
2.Общая формула гомологического ряда Алкины:
С n Н 2 n-2 где n – число атомов С,Н
3. SP – гибридизация
4.Валентный угол: ∟180 0
5. Длина связи: 0, 120 н.м.
– С – С –
6.Вид связи: σ (сигма) + 2 π (пи) ковалентные полярные связи
Сочетание σ и 2 π связей между двумя атомами углерода в углеродной цепи в молекуле Алкинов называют тройной связью.
– С ≡ С –
Главная
4
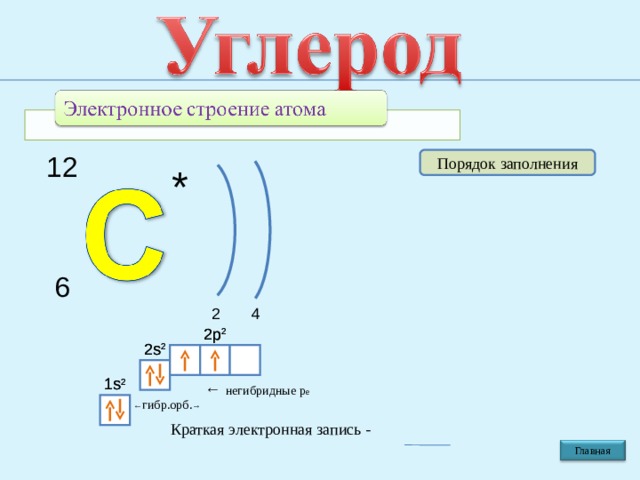
*
12
Порядок заполнения
6
2
4
2 p 2
2 p 2
2 s 2
2 s 2
1 s 2
1s 2
← негибридные p e
← гибр.орб. →
Краткая электронная запись -
Главная
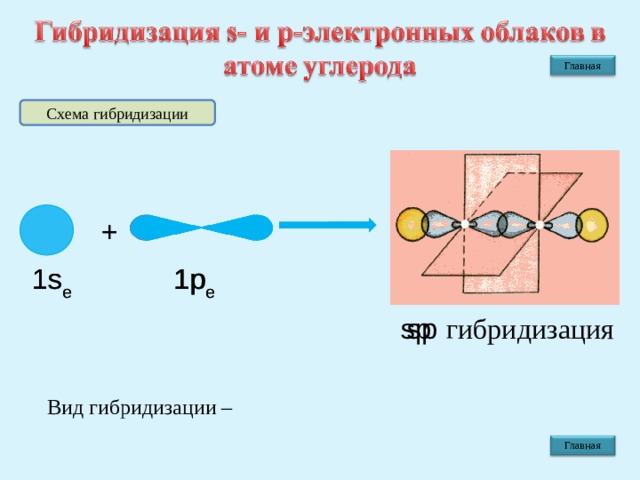
Главная
Схема гибридизации
+
+
1 p e
1s e
1 p e
1s e
sp
sp гибридизация
Вид гибридизации –
Главная
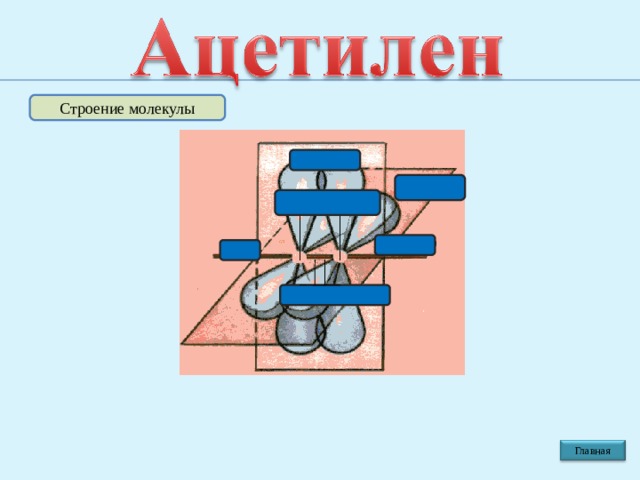
Строение молекулы
π связь
π связь
0,120 н.м .
sp
∟ 180 0
σ связь
Главная
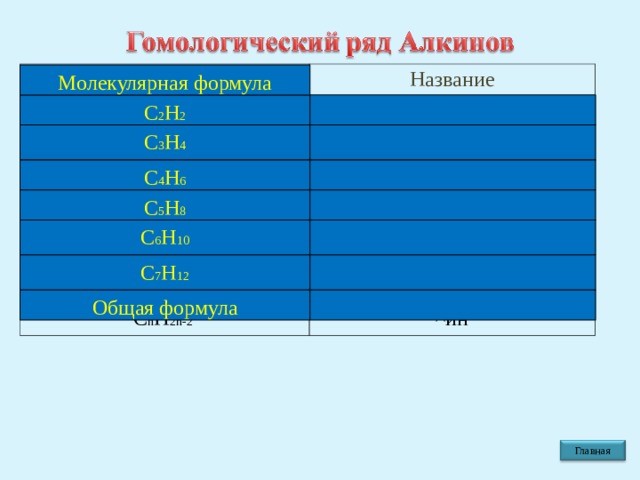
Структурная формула
Название
СН ≡ СН
Этин (ацетилен)
СН ≡ С – СН 3
Пропин
СН ≡ С – СН 2 – СН 3
СН ≡ С – СН 2 –СН 2 – СН 3
Бутин – 1
Пентин – 1
СН ≡ С – (СН 2 ) 3 – СН 3
Гексин – 1
СН ≡ С – (СН 2 ) 4 – СН 3
Гептин – 1
С n Н 2 n -2
^ин
Молекулярная формула
С 2 Н 2
С 3 Н 4
С 4 Н 6
С 5 Н 8
С 6 Н 10
С 7 Н 12
Общая формула
Главная
8

У алкинов выделяют два основных вида структурной изомерии:
1.Положение тройной связи в углеродной цепи;
2.Изомерия углеродного скелета.
1 2 3 4 1 2 3 4 5
1) а. CH ≡ C – CH 2 – CH 3 б. CH 3 – C ≡ C – CH 2 – CH 3
Бутин-1 Пентин-2
CH 3 CH 3 CH 3
1 2 3 | 4 5 1 2 3 4 | 5 | 6
2) а. CH ≡ C – C – CH 2 – CH 3 б. CH 3 – C ≡ C – C – CH – СН 3
| |
C 2 H 5 C 2 H 5
3-метил-3-этилпентин-1 4,5-диметил-4-этилгексин-2
Главная

Общая формула гомологического ряда алкинов
Какой валентный угол в молекулах алкинов
Какая длинна связи С – С в молекулах алкинов
Какой вид гибридизации электронных облаков атомов углерода характерен для алкинов
Какой вид связи С – С в молекулах алкинов
120 0
0,120 н.м.
С n Н 2 n
SP
Вопрос 1
π связь
С n Н 2 n - 2
0,140 н.м .
109 0 28′
SP 2
σ и 2 π связи
B
B
B
B
B
B
А
А
А
А
А
А
Вопрос 2
Вопрос 3
180 0
С n Н 2 n + 2
С n Н 2 n - 6
S – S и
P – P связей
0,154 н.м.
0,134 н.м.
SP 3
130 0
σ связь
σ и π связи
D
C
C
D
D
C
C
D
D
C
C
D
Вопрос 4
Вопрос 5
Главная

I Реакции присоединения
1)Вступают в реакцию гидрирования (присоединение Н 2 )
t 0 C , P ,
СН ≡ СН + Н 2 → СН 2 = СН 2
этин Ni этен
(ацетилен)
t 0 C , P ,
СН 2 = CH 2 + Н 2 → СН 3 – СН 3
этен Ni этан
2)Реагируют с галогенами ( Br 2 , Cl 2 )
СН ≡ СН + Br 2 → СН Br = СН Br
этин 1,2-дибромэтен
СН Br = СН Br + Br 2 → СН Br 2 – СН Br 2
1,2-дибромэтен 1,1,2,2-тетрабромэтан

3)Реагируют с галогенводородами ( HCl, HBr) (реакция идет в две стадии, также по правилу Марковникова)
1 2 3 1 2 3
СН ≡ С – CH 3 + Н Br → СН 2 = C – СН 3
│
пропин Br
2-бромпропен
CH 2 = С Br – СН 3 + Н Br → СН 3 – CBr 2 – СН 3
2-бромпропен 2,2-дибромпропан
4)Вступают в реакцию гидратации (присоединение Н 2 O ) –
реакция Кучерова
HgSO 4
С 2 Н 2 + Н 2 O → СН 3 СОН
этин этаналь
![II Реакции окисления 1)Горят (ацетилен горит в кислороде с выделением очень большого количества тепла) 2С 2 Н 2 + 5О 2 → 4СО 2 + 2Н 2 O + Q этин С 3 Н 4 + 4О 2 → 3СО 2 + 2Н 2 O пропин 2)Обесцвечивание раствора марганцовки 5С 2 Н 2 + 8 KMn О 4 + 12Н 2 SO 4 → 5 НООС – СООН + 8 MnS О 4 + этин раствор марганцовки щавелевая кислота + 4К 2 SO 4 + 12Н 2 O III Реакции замещения (кислотные свойства алкинов) С 2 Н 2 + 2 [Ag(NH 3 ) 2 ]OH → С 2 Ag 2 ↓+ 4NH 3 + 2Н 2 O этин аммиачный раствор ацетеленид (ацетилен) оксида серебра серебра](https://fsd.multiurok.ru/html/2020/11/02/s_5f9ffbb322162/img12.jpg)
II Реакции окисления
1)Горят (ацетилен горит в кислороде с выделением очень большого количества тепла)
2С 2 Н 2 + 5О 2 → 4СО 2 + 2Н 2 O + Q
этин
С 3 Н 4 + 4О 2 → 3СО 2 + 2Н 2 O
пропин
2)Обесцвечивание раствора марганцовки
5С 2 Н 2 + 8 KMn О 4 + 12Н 2 SO 4 → 5 НООС – СООН + 8 MnS О 4 +
этин раствор марганцовки щавелевая кислота
+ 4К 2 SO 4 + 12Н 2 O
III Реакции замещения (кислотные свойства алкинов)
С 2 Н 2 + 2 [Ag(NH 3 ) 2 ]OH → С 2 Ag 2 ↓+ 4NH 3 + 2Н 2 O
этин аммиачный раствор ацетеленид
(ацетилен) оксида серебра серебра

IV Реакции полимеризации (тримеризация ацетилена)
600 0 C
3СН ≡ СН → ( С 6 Н 6 )
этин С акт. бензол

Лабораторные способы:
1)Взаимодействие карбида кальция с водой
СаС 2 + 2 Н 2 О → C 2 H 2 ↑ + Са(ОН) 2
карбид этин
кальция (ацетилен)
Промышленные способы:
1) Крекинг (разложение) метана природного газа
t = 1500 0 C
а) 2СН 4 → C 2 Н 2 + 3 H 2 ↑
метан этин
2) Взаимодействие дигалогенпроизводных Алканов со спиртовыми растворами щелочей
t 0 C
а)С 3 H 6 Br 2 + К OH → СН ≡ С – CH 3 + 2К Br + 2Н 2 O
дибромпропан спирт. р-р пропин
Главная

Домашнее задание
ОИ1. Глава 9. §§9.4.Упр.2-4. Стр. 171.


1. http://www.it-n.ru/communities.aspx?cat_no=4605&tmpl=com Коптевская И.Б. Методическая разработка по теме предельные, этиленовые, ацетиленовые углеводороды.


















![II Реакции окисления 1)Горят (ацетилен горит в кислороде с выделением очень большого количества тепла) 2С 2 Н 2 + 5О 2 → 4СО 2 + 2Н 2 O + Q этин С 3 Н 4 + 4О 2 → 3СО 2 + 2Н 2 O пропин 2)Обесцвечивание раствора марганцовки 5С 2 Н 2 + 8 KMn О 4 + 12Н 2 SO 4 → 5 НООС – СООН + 8 MnS О 4 + этин раствор марганцовки щавелевая кислота + 4К 2 SO 4 + 12Н 2 O III Реакции замещения (кислотные свойства алкинов) С 2 Н 2 + 2 [Ag(NH 3 ) 2 ]OH → С 2 Ag 2 ↓+ 4NH 3 + 2Н 2 O этин аммиачный раствор ацетеленид (ацетилен) оксида серебра серебра](https://fsd.multiurok.ru/html/2020/11/02/s_5f9ffbb322162/img12.jpg)























