Тема 1 «Основные понятия органической химии.
Теория химического строения А.М. Бутлерова»
Практическое занятие № 5.
Построение изомеров органических соединений
Учебная цель: сформировать представление об изомерии, строить молекулы изомеров предельных углеводородов.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Обучающийся должен знать:
- классификацию органических соединений; основные положения теории химического строения органических соединений А.М. Бутлерова.
Обучающийся должен уметь:
- составлять полные и краткие структурные формулы углеводородов; составлять формулы изомеров и гомологов для предложенного вещества.
Задачи практического занятия:
1. Закрепить теоретические знания об изомерии органических соединений.
2. Ответить на вопросы для закрепления теоретического материала.
3. Выполнить практические задачи.
4. Ответить на вопросы для контроля.
Обеспеченность занятия:
Учебно-методическая литература:
Справочная литература:
Таблица «Гомологический ряд предельных углеводородов (алканов) нормального (неразветвленного) строения и их одновалентные радикалы» приложение 1.
Периодическая система химических элементов им. Д.И. Менделеева (приложение 2).
Тетрадь для практических и контрольных работ.
Калькулятор.
Ручка.
Краткие теоретические и учебно-методические материалы по теме практического занятия
Изомеры, химические соединения, одинаковые по составу и молекулярной массе, но различающиеся по строению и свойствам (химическим и физическим). Изомерия открыта в 1823 г. Ю. Либихом.
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию). Структурные изомеры отличаются друг от друга порядком связей между атомами в молекуле; стереоизомеры расположением атомов в пространстве при одинаковом порядке связей между ними.
Структурная изомерия подразделяется на несколько разновидностей. Изомерия скелета обусловлена различным порядком связи между атомами углерода, образующими скелет молекулы. Так, может существовать только один нециклический насыщенный углеводород с тремя атомами С пропан (I). Углеводородов такого же типа с четырьмя атомами С может быть уже два: н-бутан (II) и изобутан (III), а с пятью атомами С три: н-пентан (IV), изопентан (V) и неопентан (VI):
Для углеводорода C20H42 возможно уже 366 319 изомеров.
Изомерия положения обусловлена различным положением какой-либо реакционноспособной группы (функциональной группы, заместителя) при одинаковом углеродном скелете молекул. Так, пропану соответствуют два изомерных спирта: н-пропиловый (VII) и изопропиловый (VIII):

В ряду алифатических простых эфиров, сульфидов и аминов существует специальный вид изомерии — метамерия, обусловленная различным положением гетероатома в углеродной цепи. Метамерами являются, например, метилпропиловый (XII) и диэтиловый (XIII) эфиры:

Изомерия непредельных соединений может быть вызвана различным положением кратной связи, как, например, в бутене-1 (XIV) и бутене-2 (XV), в винилуксусной (XVI) и кротоновой (XVII) кислотах:


В большинстве случаев структурные изомеры сочетают признаки изомерии скелета и положения, содержат различные функциональные группы и принадлежат к разным классам веществ, вследствие чего они отличаются друг от друга значительно больше, чем рассмотренные выше изомеры веществ одного и того же типа. Например, изомерами являются пропилен (XVIII) и циклопропан (XIX), окись этилена (XX) и ацетальдегид (XXI), ацетон (XXII) и пропионовый альдегид (XXIII), диметиловый эфир (XXIV) и этиловый спирт (XXV), аллен (XXVI) и метилацетилен (XXVII):



Пространственная изомерия подразделяется на два вида: геометрическую (цис-транс-изомерию) и оптическую. Геометрическая изомерия свойственна соединениям, содержащим двойные связи (С = С, C = N и др.), и неароматическим циклическим соединениям; она обусловлена невозможностью свободного вращения атомов вокруг двойной связи или в цикле. В этих случаях заместители могут быть расположены либо по одну сторону плоскости двойной связи или цикла (цис-положение), либо по разные стороны (транс-положение).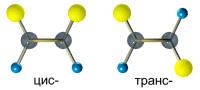
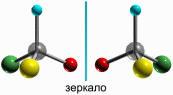
Оптическая изомерия свойственна молекулам органических веществ, не имеющим плоскости симметрии (плоскости, разделяющей молекулу на две зеркально тождественные половины) и не совмещающимся со своим зеркальным отображением.
Вопросы для закрепления теоретического материала к практическому занятию
Что изучает органическая химия?
Основные положения теории A.M. Бутлерова.
Какие углеводороды называются предельными?
Задания для практического занятия:
Решить предложенные задачи.
Правильно оформить их в тетрадь для практических и контрольных работ.
Ответить на все вопросы для контроля.
Отчитаться о выполненной работе преподавателю.
Задание
Построить всевозможные изомеры для данных формул, рассчитать процентный состав углерода и водорода.
| Вариант 1 | Вариант 2 |
| С6Н14 C8Hl8 | С5Н12 С7Н16 |
Образец решения задания
Построить всевозможные изомеры для С5Н11Сl, рассчитать процентный состав углерода, водорода и хлора.
Алгоритм решения
Дано: С5Н11Сl
Найти: построить изомеры, рассчитать (С), (Н) и (Сl).
Решение
1. Записывают линейную углеродную цепь С5: С–С–С–С–С.
2. Определяют, к какому классу углеводородов принадлежит данное соединение. Определение производят с помощью общих формул для углеводородов разных классов (CnH2n+2, CnH2n и т.п.). Вещество С5Н11Сl – хлоралкан, т.е. является производным алкана вида CnH2n+2 (n = 5), в котором один атом Н замещен на Cl. Значит, все связи в молекуле одинарные и нет циклов.
3. Нумеруют атомы С углеродной цепи (углеродного скелета) и при С-1 помещают гетероатом Cl:

4. Записывают необходимое число атомов водорода при каждом углероде цепи, учитывая, что валентность углерода равна четырем. В результате получают изомер а):

5. Перемещают атом хлора по главной цепи С5, последовательно соединяя его с атомами С-2 и С-3. Так получают изомеры б) и в):

Дальнейшее смещение хлора вправо по цепи новых изомеров не дает. Так, изомер а*) тождественен изомеру а), изомер б*) идентичен изомеру б). Просто в изомерах а*) и б*) меняется направление нумерации атомов С, счет ведется справа налево (без звездочек было слева направо):

6. Исходя из углеродного скелета (см. пункт 3), крайний (пятый) атом С отрывают и помещают заместителем к внутреннему углероду цепи (сначала к С-2, потом к С-3). Получают главные цепи С4 с углеродным заместителем при С-2 и С-3:

Записывают структурные формулы новых изомеров:

7. Помещая хлор при внутренних атомах С главной углеродной цепи С4, получают два дополнительных изомера:

8. Вещество формулы С5Н11Сl может иметь трехуглеродную главную цепь С3:

Таким образом, для вещества с молекулярной формулой С5Н11Сl можно составить восемь структурных формул изомеров а)–з), различающихся строением.
9. Далее рассчитаем процентный состав углерода, водорода и хлора.
9.1. Из Периодической таблицы Д.И. Менделеева (приложение 2) выписываем значения относительных масс атомов элементов, входящих в состав С5Н11Сl:
Ar(H) = 1, Ar(С) = 12, Ar(Сl) = 35,5
9.2. Записываем формулу расчета в общем виде Mr(С5Н11Сl):
Mr(С5Н11Сl) = n1 Ar(С) + n2 Ar(H) + n3 Ar(Cl)
9.3. Подставляем значения относительных атомных масс элементов с учетом моль-атомов в формулу расчета и вычисляем:
Mr(С5Н11Сl) = 5·Ar(C) + 11 Ar(H) + Ar(Cl) = 5·12 + 11 1 + 35,5 = 106,5
9.4. Вычисляем массовую долю элементов по формуле:
 (1)
(1)
где – массовая доля элемента в веществе;
Ar– относительная атомная масса;
n – индекс в химической формуле;
Mr – относительная молекулярная масса вещества.
Массовые доли выражают в процентах или в долях:
(C) = n(C)·Ar(C)·100% / Mr(С5Н11Сl) = 5·12·100% / 106,5 = 56,34%.
(Н) = n(Н)·Ar(Н)·100% / Mr(С5Н11Сl) = 11·1·100% / 106,5 = 10,33%.
(Сl) = n(Cl)·Ar(Cl)·100% / Mr(С5Н11Сl) = 35,5·100% / 106,5 = 33,33%.
9.5. Проверим расчет, сложив массовые доли элементов:
(C) + (Н) + (Сl) = 56,34 + 10,33 + 33,33 = 100 %
Следовательно, расчет выполнен верно.
Ответ: (С) = 56,34%; (Н) = 10,33%; (Сl) = 33,33%.
Вопросы для контроля
Запишите общую формулу любого представителя гомологического ряда предельных углеводородов.
Какие виды изомерии вы знаете?
Форма контроля выполнения практического задания:
Выполненная работа представляется преподавателю в тетради для выполнения практических и контрольных работ по дисциплине «Химия».
5





































