СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Практические работы по физколлоидной химии
Просмотр содержимого документа
«Практические работы по физколлоидной химии»
Министерство образования Республики Башкортостан
Государственное автономное профессиональное образовательное учреждение
Уфимский топливно-энергетический колледж
| Согласовано | Утверждено |
| на заседании МЦК 18.02.12 | Зам.директора по УР УТЭК |
| «____»_____________2021 г. | ____________Г.Р. Дымова |
| Председатель МЦК 18.02.12 | «_____»___________2021 г. |
| ____________Р.В. Яхина |
|
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ПРАКТИЧЕСКИМ
ЗАНЯТИЯМ ДЛЯ ОБУЧАЮЩИХСЯ II КУРСА
по дисциплине: физическая и коллоидная химия
Специальность 18.02.12 Технология аналитического контроля
Уфа 2021
Содержание
| Введение | 3 |
| Рекомендации по составлению письменного отчета о выполненной работе | 4 |
| Критерии оценивания практических занятий | 5 |
| Практическое занятие №1. Термохимические расчеты. Термохимия. Теплоемкость | 6 |
| Практическое занятие №2. Термохимические расчеты. Энтальпия | 8 |
| Практическое занятие №3. Термохимические расчеты. Энтропия | 10 |
| Практическое занятие №4. Расчет констант скорости реакции. Кинетика химических реакций. | 13 |
| Практическое занятие №5. Расчет констант скорости реакции. Принцип Ле-Шателье | 15 |
| Практическое занятие №6. Расчет констант скорости реакции. Химическое равновесие. | 16 |
| Практическое занятие №7. Расчет задач на основные законы. Криоскопия | 19 |
| Практическое занятие №8. Расчет задач на основные законы. Эбулиоскопия | 21 |
| Практическое занятие №9. Расчет задач на основные законы. Правило фаз | 23 |
| Практическое занятие №10. Расчет задач на основные законы. Равновесие в системах | 24 |
| Практическое занятие №11. Равновесие в растворах электролитов | 26 |
| Практическое занятие №12. Ионное произведение воды. | 29 |
| Практическое занятие №13. Удельная и эквивалентная электропроводность. | 31 |
| Перечень рекомендуемых учебных изданий, Интернет - ресурсов, дополнительной литературы | 33 |
Введение
В настоящих методических указаниях по дисциплине «Физическая и коллоидная химия» описаны методики выполнения практических заданий, которое при самостоятельной подготовке поможет обучающимся выполнить эти работы. Методические указания выполнены в соответствии с рабочей программой, составленной на основе ФГОС СПО.Пособие поможет обучающимся совершенствовать практические умения и закрепить теоретические знания по дисциплине «Физическая и коллоидная химия».Описаны методики выполнения практическихзанятий, приведены контрольные вопросы, фиксирующие внимание обучающихся на наиболее важные этапы изучаемого материала. Контрольные вопросы составлены для закрепления изученного материала.
Целями освоения дисциплины «Физическая и коллоидная химия» являются формирование у обучающихся знаний об основах физической химии, химической кинетики, химической термодинамики и термохимии; о закономерностях протекания химических и физико-химических процессов; о механизмахдействия катализаторов, сущности и механизма катализа; о механизмах гомогенных и гетерогенных реакций; об основных методах интенсификации физико-химических процессов; об условиях химического равновесия; об основах коллоидной химии; о сущности процессов адсорбции, особенностях физической и химической адсорбции; о типах коагулянтов и их коагулирующей способности.
Задачами изучения дисциплины «Физическая химия» являются освоение обучающимися теоретических знаний и практических способов действий, необходимых и достаточных для:
ознакомления обучающихся с основными понятиями курса;
расчета тепловых эффектов и скорости химических реакций;
нахождения в справочной литературе показателей физико-химических свойств веществ и их соединений;
определения концентрацию реагирующих веществ и скорость реакции;
выполнения основных расчеты электродных потенциалов, электродвижущей силы гальванических элементов;
В практикуме рассматриваются основные понятия физической и коллоидной химии.
В результате освоения дисциплины обучающийся должен уметь:
выполнять расчеты электродных потенциалов, электродвижущей силы гальванических элементов;
находить в справочной литературе показатели физико-химических свойств веществ и их соединений;
определять концентрацию реагирующих веществ и скорость реакции;
строить фазовые диаграммы;
производить расчеты параметров газовых смесей, кинетических параметров химических реакций, химического равновесия;
рассчитывать тепловые эффекты и скорость химических реакций;
определять параметры каталитических реакций.
В результате освоения дисциплины обучающийся должен знать:
закономерности протекания химических и физико-химических процессов;
законы идеальных газов;
механизм действия катализаторов;
механизмы гомогенных и гетерогенных реакций;
основы физической и коллоидной химии, химической кинетики, химической термодинамики и термохимии;
основные методы интенсификации физико-химических процессов;
свойства агрегатных состояний веществ;
сущность и механизм катализа;
схемы реакций замещения и присоединения;
условия химического равновесия;
физико-химические методы анализа веществ, применяемые приборы;
физико-химические свойства сырьевых материалов и продуктов.
Вариативная часть:
В результате освоения дисциплины обучающийся должен уметь:
определять термодинамическую возможность протекания химических превращений в различных условиях и давать оценку их последствий;
определять направление смещения равновесия под влиянием различных факторов;
составлять схемы гальванических элементов;
решать примеры и задачи на определение параметров процесса;
производить расчеты протекания реакций по термодинамическим потенциалам;
строить изотерму адсорбции по экспериментальным данным;
определять молярной массы растворенного вещества криоскопическим методом;
определять коэффициент распределения вещества между двумя несмешивающимися жидкостями;
производить расчеты состава смесей при перегонке бинарных смесей, процессов экстрагирования, растворимости газов в жидкостях;
получать ультрамикрогетерогенные системы.
В результате освоения дисциплины обучающийся должен знать:
роль и взаимосвязь физической химии и химической термодинамики;
зависимость скорости химической реакции от различных факторов;
поверхностные явления, понимать механизм адсорбции;
общую характеристику растворов, термодинамику растворения и коллигативные свойства реальных и идеальных растворов;
свойства дисперсных систем, понятие коагуляции и пептизации;
общуюхарактеристикурастворов ВМС.
В процессе выполнения практических заданийобучающиеся должны самостоятельно изучить дополнительную литературу, заполнить таблицы, составить схемы. Результаты записывают в отчете для практических занятий, поддерживаясь определенной последовательности:
- дата выполнения, название практического занятия;
- цель работы;
- краткие теоретические сведения, касающиеся данной работы;
- зарисовка схем, рисунков (выполняется карандашом);
- выводы.
Рекомендации по составлению письменного отчета о выполненном задании Отчет по практическимзанятиям выполняется на листах формата А4 (1х1) с размерами сторон (297х210) мм. На всех листах отчетов выполняется внутренняя рамка, отступив слева 20 мм, с остальных трех сторон по 5 мм.
На первом листе текста выполняется внутренняя рамка с основной надписью по форме 2ГОСТ 2.104-68 (т.е. 185х40). На втором и последующем текстовых листах выполняется внутренняя рамка с основной надписью по форме 2а ГОСТ 2.104-68 (т.е. 185х15).
На всех текстовых листах в основных надписях пишется шестнадцатизначный номер
УТЭК 13.02.06.ХХ.01.00, где
УТЭК – наименование (организации) колледжа;
13.02.05. – номер своей специальности;
ХХ – тема практического занятия;
01 – порядковый номер практического занятия;
00 – шифр работы: ПЗ – практическое занятие.
Титульный лист является первым листом отчета и выполняется на листах формата А4(1х1) по ГОСТ 2.105-95. Дата исполнения отчета записывается персонально преподавателем и студентом, выполнившим работу.
Текстовые документы выполняют одним из следующих способов:
- рукописным – на одной стороне листа. Цифры и буквы необходимо писать четко, черной тушью.
Структура отчета по практическим занятиям.
Отчет по практическим занятиям состоит из следующих разделов: название работы, цель и задачи работы, теоретические положения, ход работы, выводы.
Название работы
Отчет по практическим занятиям должен начинаться с новой страницы. В начале отчета пишется порядковый номер практического занятия, название выполняемой работы.
Цели и задачи работы
Формулирование общей цели работы, в рамках которой решаются конкретные практические задачи.
Материалы и оборудование
Здесь указываются приборы, оборудования, реактивы необходимые для выполнения заданий.
Теоретические положения
Краткая информация по теме практического занятия с основными положениями, определениями.
Практическая часть
В разделе приводится краткое описание выполняемых действий от третьего лица. Даются указания по выполнению практических заданий, рекомендации.
Выводы
Основной частью отчета по практическим занятиям является раздел «Выводы». Здесь обучающиеся отражают основные наблюдения и заключения, сделанные при выполнении работы, полученные результаты.
Критерии оценивания практических занятий
Критерии оценок едины для выполнения всех практических занятий по дисциплине «Физическая и коллоидная химия».
Отметка "5"
Практические задания выполнены в полном объеме с соблюдением необходимой последовательности. Обучающиеся работали полностью самостоятельно: подобрали необходимые для выполнения предлагаемых заданий источники знаний, показали необходимые для проведения практических и самостоятельных работ теоретические знания, практические умения и навыки.
Работа оформлена аккуратно, в оптимальной для фиксации результатов форме.
Отметка "4"
Практические задания выполненыобучающимся в полном объеме и самостоятельно. Допускается отклонение от необходимой последовательности выполнения, не влияющее на правильность конечного результата (перестановка пунктов типового плана, последовательность выполняемых заданий, ответы на вопросы). Использованы указанные источники знаний. Работа показала знание основного теоретического материала и овладение умениями, необходимыми для самостоятельного выполнения работы.
Допускаются неточности и небрежность в оформлении результатов работы.
Отметка "3"
Практические задания выполнены и оформлены с помощью преподавателя. На выполнение заданий затрачено много времени (дана возможность доделать работу дома). Обучающийся показал знания теоретического материала, но испытывали затруднения при самостоятельной работе со статистическими материалами.
Отметка "2"
Выставляется в том случае, когда обучающийся оказался неподготовленным к выполнению этих заданий. Полученные результаты не позволяют сделать правильных выводов и полностью расходятся с поставленной целью. Обнаружено плохое знание теоретического материала и отсутствие необходимых умений.
Практическое занятие №1.
Термохимические расчеты. Термохимия. Теплоемкость
Цель работы:научиться решать практические задачи по теплоемкости и производить термохимические расчеты
Теоретические положения
Раздел химии, изучающий тепловые эффекты химических реакций называется термохимией. Все химические процессы сопровождаются выделением или поглощением теплоты. Реакции, сопровождающиеся выделением теплоты из системы в окружающую среду, называются экзотермическими, сопровождающиеся поглощением теплоты из окружающей среды, называются эндотермическими.
Тепловой эффект реакции, измеренный при постоянных температуре и давлении, называется теплотой реакции Qр, а противоположная ему по знаку величина, описывающая изменение состояния системы в результате протекания реакции энтальпией реакции ![]() rH.
rH.
В качестве основной единицы измерения теплоты в системе СИ установлен джоуль. В качестве единицы измерения теплоты встречается также калория, равная 4,184 Дж. В настоящее время она сохраняется как внесистемная единица для сравнения результатов современных работ с экспериментальными и справочными данными, накопленными за многие предыдущие годы.
Для описания тепловых явлений в химических реакциях принято пользоваться так называемыми термохимическими уравнениями. Термохимические уравнения записываются как обычные уравнения химических реакций, но с указанием величины и знака теплового эффекта реакции. В случае экзотермических реакций с правой стороны уравнения отмечают количество выделившейся теплоты со знаком "плюс", а в случае эндотермических реакций — количество поглощенной теплоты со знаком "минус". При этом у формулы каждого вещества индексом указывается его физическое состояние: газообразное (г), жидкое (ж), кристаллическое (к) или раствор (р-р).
Существует термодинамический способ записи термохимических уравнений — когда в самом уравнении тепловой эффект не указывается, а изменение энтальпии реакции (![]() H) записывается отдельно. Пример записи термохимического уравнения реакции образования карбоната кальция из простых веществ обоими способами:
H) записывается отдельно. Пример записи термохимического уравнения реакции образования карбоната кальция из простых веществ обоими способами:
Caк + C(гр)к+ 3/2O2,г = CaCO3,к + 1206,8 кДж
Caк + C(гр )к+ 3/2O2,г = CaCO3,к , H = –1206,8 кДж
В данной реакции Q 0, соответственно, ΔH
Q 0, соответственно, ΔH
Q 0 – реакция эндотермическая, поглощение теплоты
ПРИМЕР 1.
Каков стандартный тепловой эффект реакции Fe2O3(T) + 2Al(T) = 2Al2O3(T) ΔHº298,
если стандартная теплота образования 2Al2O3(T) равна -1670 кДж/моль, а Fe2O3(T)равна -821 кДж/моль?
Решение. В соответствии с первым законом Гесса тепловой эффект реакции восстановления железа из оксида алюминия (III) и оксида железа (III), т.е.
ΔHº298 = (-1670) – ( -821) = - 849 (кДж/моль)
ПРИМЕР 2.
По стандартным тепловым эффектам сгорания этилового спирта C2H5OH – 1370, уксусной кислоты CH3COOH– 876 и этилацетата CH3COOC2H5 – 2250 кДж/моль. Рассчитайте стандартный тепловой эффект реакции получения этилацетата:
C2H5OH + CH3COOH = CH3COOC2H5 + H2O
Решение. Воспользуемся уравнением, выражающее второе следствие из закона Гесса:
ΔН = (ΔН C2H5OH + ΔН CH3COOH) – (ΔН CH3COOC2H5) = (-1370-876) – (-2250) = 4 (кДж/моль).
Практическая часть
Ход выполнения работы
1.Получите задание у преподавателя с указанием номера варианта.
2.Прочитайте внимательно каждую из задач.
3.Где нужно, составьте план решения задачи.
4.Запишите в тетради тему занятия, номер варианта и решение задач.
Вариант 1
Стандартные теплоты сгорания бутена-1 и бутана равны соответственно (-2719,0) кДж/моль и (-2879,2) кДж/моль. Вычислите тепловой эффект реакции гидрирования бутена:
H2C = CH – CH2 - CH3(г) + H2(г) → С4H10(г)
При стандартных условиях, учитывая, что стандартная теплота образования воды равна – 286,04 кДж/моль.
Определите тепловой эффект реакции сгорания этана в озоне:
C2H6(г) + 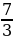 O3(г) = 2CO2(г) + 3H2O(ж),
O3(г) = 2CO2(г) + 3H2O(ж),
Используя следующие данные, что стандартная теплота сгорания этана в кислороде равна -1561,0 кДж/моль.
При сгорании 2 молей фосфористого водорода(фосфорита) PH3 образуется оксид фосфора P2O5 и вода и выделяется 2440 кДж. Определите теплоту образования фосфина, если при образовании оксида фосфора (V) и воды выделяется соответственно 1548 кДж/моль и 286 кДж/моль.
Вариант 2
Стандартная теплота сгорания октана равна – 5512,2 кДж/моль, а теплота сгорания бутена-1 и бутана равны -2711,0 и -2879,2 кДж/моль. По этим определите стандартный тепловой эффект реакции крекинга октана: C8H18 → H2C = CH - CH2 – CH3 +C4H10.
Стандартные теплоты образования оксида азота(II) N2O4(г) и воды равны и -286,04 кДж/моль. Чему равен тепловой эффект реакции в стандартных условиях, уравнение которойN2O4(г) + 4H2(г) = N2(г) + 4H2O(ж).
Даны три уравнения химических реакций:
Ca(тв) + 2H2O(ж) = Ca+2(водн) + 2OH-(водн) + H2(г) + 109 ккал,
CaO(тв) + H2O (ж) = Ca+2 (водн) + 2OH- (водн) + 19,5 ккал,
H2(г) + ½O2(г) = H2O(ж) + 68,3 ккал.
Определите тепловой эффект реакции Ca(тв) + 1/2O2(г) = CaO(тв) + Q.
Вариант 3
При стандартных условиях теплоты полного сгорания белого фосфора равна 760,1 кДж/моль, а теплота полного сгорания черного фосфора равна 722,1 кДж/моль. Чему равна теплота превращения черного фосфора в белый при стандартных условиях?
При сгорании 2 моль этилена в кислороде выделилось 2822 кДж теплоты. Определите теплоту образования этилена, если стандартные теплоты образования CO2 и H2O равны 393 кДж/моль и 286 кДж/моль соответственно.
При сжигании паров этанола в кислороде выделиться 494,2 кДж теплоты и осталось 19,7 л непрореагировавшего кислорода (измерено при давлении 101,3 кПа и температуре 27 ºC). Рассчитайте массовые доли компонентов в исходной смеси, если известно, что теплоты образования оксида углерода (IV), паров воды и паров этанола составляют 393, 5 r кДж/моль,241,8 кДж/моль и 277,0 кДж/моль соответственно.
Контрольные вопросы
Теплоемкость, определение, виды, теплоемкость газов, жидкостей, твердых веществ, зависимость теплоемкости от температуры.
Содержание и формулировка 1-го начала термодинамики.
Что такое тепловой эффект реакции. Соотношение между теплотами реакций при постоянном давлении и при постоянном объеме.
Теплота образования, стандартная теплота образования. Расчет теплового эффекта по теплотам образования.
Теплота растворения. Почему процессы растворения веществ могут протекать не только с экзотермическим, но и с эндотермическим эффектом.
Практическое занятие №2
Термохимические расчеты. Энтальпия
Цель работы: научиться производить термохимические расчеты энтальпии
Теоретические положения
Энтальпия системы (от греч. enthalpo нагреваю) – это однозначная функция H состояния термодинамической системы при независимых параметрах энтропии S и давлении P, которая связана с внутренней энергией U соотношением
|
|
| |
где V – объем системы.
В химии чаще всего рассматривают изобарические процессы (P = const), и тепловой эффект в этом случае называют изменением энтальпии системы или энтальпией процесса:
|
|
| |
|
|
| |
Энтальпия имеет размерность энергии (кДж). Ее величина пропорциональна количеству вещества; энтальпия единицы количества вещества (моль) измеряется в кДж∙моль–1.
В термодинамической системе выделяющуюся теплоту химического процесса условились считать отрицательной (экзотермический процесс, ΔH H 0.
Уравнения химических реакций с указанием энтальпии процесса называют термохимическими. Численные значения энтальпии ΔH указывают через запятую в кДж и относят ко всей реакции с учетом стехиометрических коэффициентов всех реагирующих веществ. Поскольку реагирующие вещества могут находиться в разных агрегатных состояниях, то оно указывается нижним правым индексом в скобках: (т) – твердое, (к) – кристаллическое, (ж) – жидкое, (г) – газообразное, (р) – растворенное. Например, при взаимодействии газообразных H2 и Cl2 образуются два моля газообразного HCl. Термохимическое уравнение записывается так:
|
|
|
|
При взаимодействии газообразных H2 и O2 образующаяся H2O может находиться в трех агрегатных состояниях, что скажется на изменении энтальпии:
|
|
|
|
|
|
|
|
Приведенные энтальпии образования веществ и энтальпии реакций отнесены к стандартным условиям (P = 101,325 кПа) и взяты для температуры T = 298 K. Стандартное состояние термодинамической функции, например, энтальпии, обозначается нижним и верхним индексами: ![]() нижний индекс обычно опускают: Δ
нижний индекс обычно опускают: Δ![]() .
.
Пользуясь табличными значениями ![]()
![]() и
и ![]() , можно рассчитать энтальпии различных химических процессов и фазовых превращений. Основанием для таких расчетов является закон Гесса, сформулированный петербургским профессором Г. И. Гессом (1841 г.): «Тепловой эффект (энтальпия) процесса зависит только от начального и конечного состояния и не зависит от пути перехода его из одного состояния в другое».
, можно рассчитать энтальпии различных химических процессов и фазовых превращений. Основанием для таких расчетов является закон Гесса, сформулированный петербургским профессором Г. И. Гессом (1841 г.): «Тепловой эффект (энтальпия) процесса зависит только от начального и конечного состояния и не зависит от пути перехода его из одного состояния в другое».
Анализ закона Гесса позволяет сформулировать следующие следствия:
Энтальпия реакции равна разности сумм энтальпий образования конечных и начальных участников реакций с учетом их стехиометрических коэффициентов.
| ΔH = ΣΔHобр.конечн – ΣΔHобр.нач |
Энтальпия реакции равна разности сумм энтальпий сгорания начальных и конечных реагентов с учетом их стехиометрических коэффициентов.
| ΔH = ΣΔHсгор.нач – ΣΔHсгор.конечн |
Энтальпия реакции равна разности сумм энергий связей Eсв исходных и конечных реагентов с учетом их стехиометрических коэффициентов.
В ходе химической реакции энергия затрачивается на разрушение связей в исходных веществах (ΣEисх) и выделяется при образованиии продуктов реакции (–ΣEпрод). Отсюда
| ΔH° = ΣEисх – ΣEпрод |
Следовательно, экзотермический эффект реакции свидетельствует о том, что образуются соединения с более прочными связями, чем исходные. В случае эндотермической реакции, наоборот, прочнее исходные вещества.
При определении энтальпии реакции по энергиям связей уравнение реакции пишут с помощью структурных формул для удобства определения числа и характера связей.
Энтальпия реакции образования вещества равна энтальпии реакции разложения его до исходных веществ с обратным знаком.
| ΔHобр = –ΔHразл |
Энтальпия гидратации равна разности энтальпий растворения безводной соли ![]() и кристаллогидрата
и кристаллогидрата ![]()
Из вышесказанного видно, что закон Гесса позволяет обращаться с термохимическими уравнениями как с алгебраическими, т. е. складывать и вычитать их, если термодинамические функции относятся к одинаковым условиям.
Практическая часть
Ход выполнения работы
1.Получите задание у преподавателя с указанием номера варианта.
2.Прочитайте внимательно каждую из задач.
3.Где нужно, составьте план решения задачи.
4.Запишите в тетради тему занятия, номер варианта и решение задач.
Вариант 1
Энтальпии растворения BaCl2(к) и BaCl2·2H2O(к) с образованием раствора хлорида бария (с мольным отношением BaCl2: H2O = 1: 500) соответственно равны –11,18 и 18,74 кДж/моль. Определить величину D Но присоединения воды к BaCl2(к) с образованием BaCl2·2H2O(к).
Вычислить энтальпию химической реакции 4KClO3(к)=KCl(к)+3KClO4(к) по следующим данным: 2KClO3(к)=2KCl(к)+3O2(г); ![]() Но298 = - 95 кДж; 4KClO4(к)=KCl(к)+2O2(г);
Но298 = - 95 кДж; 4KClO4(к)=KCl(к)+2O2(г); ![]() Но298 = 9 кДж/моль.
Но298 = 9 кДж/моль.
Вариант 2
Рассчитать энтальпию связи в молекуле NO на основании следующих термохимических уравнений:
N2(г) + O2(г) = 2NO(г); ![]() Но298 = +182,52 кДж; 2O(г) = O2(г);
Но298 = +182,52 кДж; 2O(г) = O2(г); ![]() Но298 = - 498,34 кДж; N2(г) = 2N(г);
Но298 = - 498,34 кДж; N2(г) = 2N(г); ![]() Но298 = +945,42 кДж.
Но298 = +945,42 кДж.
Вычислить среднюю энтальпию связи P-Cl в молекуле PCl5, используя следующие термохимические уравнения:
P(к, бел.)+5/2Cl2(г)=PCl5(г); ![]() Но1 = - 374,8 кДж;
Но1 = - 374,8 кДж;
P(к, бел.)=P(г); ![]() Но2 = - 17,4 кДж;
Но2 = - 17,4 кДж;
Cl2(г)=2Cl(г); ![]() Но3 = 242,6 кДж.
Но3 = 242,6 кДж.
Вариант 3
Определите стандартную энтальпию образования С2Н5ОН(ж), если стандартные энтальпии сгорания углерода, водорода и этанола при 298 К равны соответственно: -393; -286 и -1366 кДж/моль.
Вычислить среднюю энтальпию связи N-H в молекуле NH3, используя следующие термохимические уравнения:
1/2N2(г)+3/2H2(г)=NH3(г); ![]() Но1 = - 46,2 кДж;
Но1 = - 46,2 кДж;
N2(г)=2N(г); ![]() Но2 = 945,4 кДж;
Но2 = 945,4 кДж;
H2(г)=2H(г); ![]() Но3 = 436,0 кДж.
Но3 = 436,0 кДж.
Контрольные вопросы
Что такое энтальпия, её физический смысл?
Закон Гесса, следствия из него. Термодинамическая и термохимическая системы знаков для тепловых эффектов реакций.
Практическое занятие №3.
Термохимические расчеты. Энтропия
Цель работы: научиться проводить термохимические расчеты энтропии
Теоретические положения
Изменение энтальпии системы не может служить единственным критерием самопроизвольного осуществления химической реакции, поскольку многие эндотермические процессы протекают самопроизвольно. Иллюстрацией этого служит растворение некоторых солей (например, NH4NO3) в воде, сопровождающееся заметным охлаждением раствора. Необходимо учитывать еще один фактор, определяющий способность самопроизвольно переходить из более упорядоченного к менее упорядоченному (более хаотичному) состоянию.
Энтропия (S) – термодинамическая функция состояния, которая служит мерой беспорядка (неупорядоченности) системы. Возможность протекания эндотермических процессов обусловлена изменением энтропии, ибо в изолированных системах энтропия самопроизвольно протекающего процесса увеличивается ΔS 0 (второй закон термодинамики).
Л. Больцман определил энтропию как термодинамическую вероятность состояния (беспорядок) системы W. Энтропия связана с термодинамической вероятностью соотношением:
|
|
| |
Размерность энтропии 1 моля вещества совпадает с размерностью газовой постоянной R и равна Дж∙моль–1∙K–1. Изменение энтропии *) в необратимых и обратимых процессах передается соотношениями ΔS Q / T и ΔS = Q / T. Например, изменение энтропии плавления равно теплоте (энтальпии) плавления ΔSпл = ΔHпл/Tпл. Для химической реакции изменение энтропии аналогично изменению энтальпии
|
|
|
|
термин энтропия был введен Клаузиусом (1865 г.) через отношение Q / T (приведенное тепло).
Здесь ΔS° соответствует энтропии стандартного состояния. Стандартные энтропии простых веществ не равны нулю. В отличие от других термодинамических функций энтропия идеально кристаллического тела при абсолютном нуле равна нулю (постулат Планка), поскольку W = 1.
Энтропия вещества или системы тел при определенной температуре является абсолютной величиной. В табл. 1 приведены стандартные энтропии S° некоторых веществ.
| ||||||||||||||||||||||||||||||||||||||||||||
| Таблица 1. Стандартные энтропии некоторых веществ |
Из табл. 1 следует, что энтропия зависит от:
агрегатного состояния вещества. Энтропия увеличивается при переходе от твердого к жидкому и особенно к газообразному состоянию (вода, лед, пар).
изотопного состава (H2O и D2O).
молекулярной массы однотипных соединений (CH4, C2H6, н-C4H10).
строения молекулы (н-C4H10, изо-C4H10).
кристаллической структуры (аллотропии) – алмаз, графит.
Наконец, рис. 1 иллюстрирует зависимость энтропии от температуры.
|
|
| Рисунок 1 Зависимость энтропии от температуры для свинца: ΔSпл = 8 Дж·моль–1·К–1; Tпл = 600,5 К; ΔSкип = 88 Дж·моль–1·К–1; Tкип = 2013 К |
Следовательно, стремление системы к беспорядку проявляется тем больше, чем выше температура. Произведение изменения энтропии системы на температуру T ΔS количественно оценивает эту тендецию и называется энтропийным фактором.
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж):
|
|
|
Практическая часть
Ход выполнения работы
1.Получите задание у преподавателя с указанием номера варианта.
2.Прочитайте внимательно каждую из задач.
3.Где нужно, составьте план решения задачи.
4.Запишите в тетради тему занятия, номер варианта и решение задач.
Вариант 1
Используя справочные данные, определить стандартную энтропию образования ![]() Sоf,298 NaHCO3(к).
Sоf,298 NaHCO3(к).
Используя справочные данные, определить принципиальную возможность протекания реакции при 298,15 К:
NiO(к) + C(графит) = Ni(к) + CO(г).
Если реакция не будет самопроизвольно протекать при 298,15 К, оценить возможность ее протекания при более высоких температурах.
Используя справочными данными по величинам Sо298, определите возможность самопроизвольного протекания в изолированной системе при 298 К процесса:
KClO3(к)=KCl(к)+3/2O2(к).
Вариант 2
Выбрать процесс, изменение энергии Гиббса которого соответствует стандартной энергии Гиббса образования NO2(г):
а) NO(г) + 1/2O2(г) = NO2(г);
б) N2(г) + 2O2(г) = 2NO2(г);
в) 1/2N2(г) + O2(г) = NO2(г);
г) N(г) + O2(г) = NO2(г).
2. Рассчитать стандартную энергию Гиббса образования D Gоf,298 C2H5OH(ж), используя справочные данные о величинах D Ноf,298 и Sо298.
3. Используя справочные данные, определить стандартную энтропию образования ![]() Sоf,298 K2Cr2O7(к).
Sоf,298 K2Cr2O7(к).
Вариант 3
Используя справочные данные, вычислить при 298,15 К изменение энтропии в реакции:
2NH4NO3(к) = 2N2(г) + 4H2O(г) + О2(г).
На основе расчетов термодинамических величин покажите, чем эффективнее восстанавливать при 298 К Cr2O3(к) до металла - алюминием или магнием:
1) Cr2O3(к)+3Mg(к)=3MgO(к)+2Cr(к); D Gо1;
2) Cr2O3(к)+2Al(к)=Al2O3(к)+2Cr(к); D Gо2.
Используя справочные данные, вычислить при 298 К изменение энтропии в процессе:
Н2(г)+1/2О2(г)=Н2О(г).
Контрольные вопросы
Что такое энтропия, её физический смысл?
Энергия Гиббса. Основные формулы ее расчета.
Практическое занятие №4.
Расчет констант скорости реакции. Кинетика химических реакций.
Цель работы: научиться решать задачи на кинетику химических реакций
Теоретические положения
Любая термодинамически разрешенная химическая реакция должна быть обусловлена определенными факторами, от которых зависят скорость и стадийность (механизм) ее протекания. Скорость и механизмхимических процессов составляют основу химической кинетики. Формальная кинетика позволяет количественно описать ход химического процесса во времени при постоянной температуре в зависимости от концентрации реагирующих веществ и их фазового состава.
Скорость гомогенной химической реакции определяется по изменению концентрации любого из реагирующих веществ в единицу времени. Обычно концентрации выражают в моль/л, а время в секундах. Например, скорость реакции
|
|
|
|
может быть, с одной стороны, определена по убыли веществ A или В, а с другой стороны, по приращению продуктов реакции L и Q. Поскольку все вещества этой реакции взаимодействуют в стехиометрических соотношениях, то скорость реакции может быть выражена через изменение концентрации любого реагента. Другими словами, при фиксированной температуре скорость гомогенной реакции Vi определяется убылью или приращением концентрации реагента Ci за бесконечно малое время dτ:
|
|
| (1) |
Так, скорость реакции N2(г) + 3H2(г) = 2NH3(г) может быть выражена соотношением
|
|
|
Скорость реакции в момент τ – мгновенная скорость Vτ – подчиняется закону действующих масс, который был экспериментально открыт и теоретически обоснован в середине XIX столетия и получил свое название от термина «действующая масса» – синонима современного понятия «концентрация».
Например, если молярные концентрации двух реагирующих веществ А и В выразить через их символы в квадратных скобках, то вероятность нахождения веществ А в точке R будет пропоциональна [A], т. е. ωA=α[A]. Вероятность ωB нахождения вещества в этой точке равна ωB = β[B], а вероятность их одновременного присутствия в точке R (точке столкновения) равна произведению ωA∙ωВ = α[A]∙β[B]. Поскольку только часть столкновений приводит к химической реакции, то скорость реакции образования АВ равна VAB = γ∙α[A]∙β[B] = γ α β [A] [B]. Обозначив γ·α·β = k, получаем для реакции A + B, VAB = k [A] [B]
Коэффициент пропорциональности называют константой скорости. Очевидно, для реакции aA + bB, то есть для a молей вещества А и b молей вещества В ЗДМ формально запишется в виде
|
|
| |
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов. Это определение относится к гомогенным реакциям. Если реакция геторогенная (реагенты находятся в разных агрегатных состояниях), то в уравнениие ЗДМ входят только жидкие или только газообразные реагенты, а твердые исключаются, оказывая влияние только на константу скорости k. Константа скорости k численно равна скорости, если концентрации реагентов постоянны и равны единице.
Закон действующих масс безусловно выполняется только для элементарных химических реакций, протекающих в одну стадию. В других случаях фактическая и вычисленная по закону действующих масс скорости совпадают редко.
Практическая часть
Ход выполнения работы
1.Получите задание у преподавателя с указанием номера варианта.
2.Прочитайте внимательно каждую из задач.
3.Где нужно, составьте план решения задачи.
4.Запишите в тетради тему занятия, номер варианта и решение задач.
Вариант 1
Дайте определение понятию скорость химической реакции. Опишите количественно (где это можно), как влияют на скорость реакции внешние условия (концентрация, температура, давление). Рассчитайте, во сколько раз изменится скорость реакции Н2+С12 = 2НС1 при увеличении давления в 2 раза;
При установлении равновесия Fe2O3 (т) + 3CO (г) = 2Fe (т) + 3CO2 (г) концентрация [CO] = 1 моль/л и [CO2] = 2 моль/л. Вычислите исходную концентрацию [CO]исх, если начальная концентрация CO2 равна нулю.
Температурный коэффициент реакции равен 2,5. Как изменится ее скорость при охлаждении реакционной смеси от изменения температуры от 50 °С до 30 °С?
Вариант 2
Рассчитайте скорость реакции между растворами хлорида калия и нитрата серебра, концентрации которых составляют соответственно 0,2 и 0,3 моль/л, а k=1,5∙10-3л∙моль-1∙с-1
Как следует изменить концентрацию кислорода, чтобы скорость гомогенной элементарной реакции: 2 NО(г)+O2(г) → 2 NО2(г) не изменилась при уменьшении концентрации оксида азота (II) в 2 раза?
При увеличении температуры с 30 до 45оС скорость гомогенной реакции повысилась в 20 раз. Чему равна энергия активации реакции?
Вариант 3
Константа скорости реакции омыления уксусноэтилового эфира: СН3СООС2Н5(р-р) + КОН(р-р)→СН3СООК (р-р)+С2Н5ОН(р-р) равна 0,1 л/моль∙мин. Начальная концентрация уксусноэтилового эфира была равна 0,01 моль/л, а щелочи – 0,05 моль/л. Вычислите начальную скорость реакции и в тот момент, когда концентрация эфира станет равной 0,008 моль/л.
Как следует изменить объем реакционной смеси системы:
8NH3(г) + 3Br2(ж)→6NH4Br(к) + N2(г), чтобы скорость реакции уменьшилась в 60 раз?
Как повлияет на выход хлора в системе:
4HCl(г) +O2(г) ↔2Cl2(г) + 2H2О(ж); ΔНо298 =−202,4кДж
а) повышение температуры; b) уменьшение общего объема смеси; c) уменьшение концентрации кислорода; d) введение катализатора?
Практическое занятие №5.
Расчет констант скорости реакции. Принцип Ле-Шателье
Цель работы: научиться решать задачи, применяя принцип Ле-Шателье
Теоретические положения
При известных ΔH реакции или при Δn ≠ 0 на химическое равновесие можно воздействовать изменением температуры или давления. Химическое равновесие может быть смещено изменением концентраций реагентов. Другими словами, равновесие можно сместить внешним воздействием, руководствуясь принципом Ле Шателье: если на равновесную систему оказывать внешнее воздействие, то равновесие смещается в сторону, противодействующую этому воздействию.
Влияние температуры. Для реакций, идущих с уменьшением энтальпии (экзотермических), повышение температуры будет препятствовать протеканию прямого процесса, то есть смещать реакцию в сторону исходных веществ. Эндотермические реакции при этом будут смещаться в сторону конечных продуктов. Например, при обычных условиях реакция N2 + O2 не идет (ΔH 0), но повышение температуры может сделать эти реакцию осуществимой. Реакция CO + 1/2O2 = CO2, ΔH
Влияние давления. Если реагируют газообразные вещества, то при неизменном числе молей начальных и конечных реагентов повышение общего давления не приведет к смещению равновесия. Если число молей при реакции меняется, то изменение общего давления приведет к смещению равновесия. В частности, реакция 2CO + O2 = 2CO2, протекающая с уменьшением Δn, при повышении общего давления сместится в сторону образования СO2.
Влияние концентраций. В тех реакциях, в которых лучше оперировать концентрациями (реакции в растворах), увеличение концентраций исходных веществ приводит к смещению равновесия в сторону конечных продуктов и наоборот. Так, в реакции этерификации (образование сложного эфира)
|
|
|
|
увеличение концентрации уксусной кислоты или этанола увеличивает выход этилацетата, а добавление в систему воды приводит к омылению, т. е. образованию исходных продуктов.
Практическая часть
Ход выполнения работы
1.Получите задание у преподавателя с указанием номера варианта.
2.Прочитайте внимательно каждую из задач.
3.Где нужно, составьте план решения задачи.
4.Запишите в тетради тему занятия, номер варианта и решение задач.
Вариант 1
В какой из приведенных реакций повышение давления сместит равновесие вправо? Ответ обосновать.
1) 2 NH3 (г) →3 H2 (г) + N2 (г)
2) ZnCO3 (к) →ZnO(к) + CO2 (г)
3) 2HBr (г) →H2 (г) + Br2 (ж)
4) CO2 (г) + C (графит) → 2CO (г)
Используя справочные данные, вычислить температуру, при которой константа равновесия процесса
CO2(г) + C(графит) → 2CO(г)
становится равной 1. Принять, что D НоТ » D Но298, а D SоT » D Sо298.
Вариант 2
При некоторой температуре равновесные концентрации в системе
2HBr (г) → H2 (г) + Br2 (г)
составляли: [HBr] = 0,3 моль/л, [H2] = 0,6 моль/л, [Br2] = 0,6 моль/л. Определить константу равновесия и исходную концентрацию HBr.
Используя справочные данные, рассчитать константу равновесия процесса
С2Н4(г) → С2Н2(г) + Н2(г) при 298 К.
Вариант 3
Для реакции H2(г) + S(г) → H2S(г) при некоторой температуре константа равновесия равна 2. Определить равновесные концентрации H2 и S, если исходные концентрации H2, S и H2S равны, соответственно, 2, 3 и 0 моль/л.
Для реакции 2С3Н8(г) → н-С5Н12(г)+СН4(г) при температуре 1000 К константа равновесия равна 4. Определить равновесную концентрацию н-пентана, если исходная концентрация пропана равна 5 моль/л.
Практическое занятие №6.
Расчет констант скорости реакции. Химическое равновесие.
Цель работы: научиться решать задачи на расчет константы скорости химических реакцийи определение химического равновесия
Теоретические положения
Для определения величины ΔG в условиях, отличных от стандартных, используют уравнение зависимости изобарно-изотермического потенциала от концентрации и температуры.
Из формул расчета энтальпии и энтропии получаем:
|
|
| (1) |
Рассмотрим вместо небольших, но конечных изменений (ΔG, ΔH, ΔS) бесконечно малые изменения всех параметров, входящих в уравнение (1). Тогда оно приобретает вид:
|
| dG = dU + P dV + V dP – T dS – S dT. | (2) |
Подставив в него dU = δQ – δA, получим:
|
| dG = δQ – δA + P dV + V dP – T dS – S dT. | (3) |
Если реакция протекает при постоянной температуре (S dT = 0) и обратимо (ΔQ = T dS), а единственной совершаемой в ходе реакции работой является работа расширения (δА = P dV), то в правой части (3) все члены, кроме V dP, взаимно сокращаются или равны нулю. Тогда получаем:
|
| dG = V dP. |
|
Для одного моля идеального газа V = RT / P и, следовательно,
|
| dG = RT dP / P = RT d (lnP) |
|
Интегрируя, получаем
|
|
| (4) |
Это уравнение позволяет, зная молярную энергию Гиббса идеального газа G1 при парциальном давлении P1, вычислить молярную энергию Гиббса G2 при парциальном давлении P2. Хотя уравнение 4 выведено для обратимой реакции, оно в равной мере применимо и к необратимым процессам, поскольку G является функцией состояния, и ее изменение не зависят от способа перехода из состояния 1 в состояние 2. Допустив, что состояние 1 является стандартным, а состояние 2 произвольным, уравнение (4) можно записать в виде:
|
|
| (5) |
где ![]() – стандартный изобарно-изотермический потенциал вещества j;
– стандартный изобарно-изотермический потенциал вещества j; ![]() – его активная концентрация (активность).
– его активная концентрация (активность).
Для идеальных растворов активная концентрация определяется как отношение концентрации этого вещества при заданных условиях к его концентрации в стандартном состоянии a = C/C°. Вещества в стандартном состоянии имеют a = 1.
В соответствии с (5) энергия Гиббса произвольной химической реакции
|
| aА + bВ = lL + mМ |
|
равна:
|
|
| (6) |
При достижении равновесия (ΔG = 0) уравнение (6) принимает вид
|
|
| (7) |
где ![]()
![]()
![]()
![]() – равновесные значения активных концентраций.
– равновесные значения активных концентраций.
Выражение под знаком логарифма, представляющее собой отношение произведения равновесных активностей продуктов к произведению активностей исходных веществ в степенях их стехиометрических коэффициентов, называется константой равновесия:
|
|
|
Подставив (7) в (6), получим уравнение, носящее название изотермы Вант-Гоффа:
|
|
| (8) |
При определенных условиях активности реагентов могут быть заменены концентрациями или парциальными давлениями. В этих случаях константа равновесия, выраженная через равновесные концентрации Kc или через парциальные давления Kp, принимает вид
|
|
| (9) |
|
|
| (10) |
Уравнения (9) и (10) представляют собой варианты закона действующих масс (ЗДМ) для обратимых реакций в состоянии равновесия. При постоянной температуре отношение равновесных концентраций (парциальных давлений) конечных продуктов к равновесным концентрациям (парциальным давлениям) исходных реагентов, возведенных соответственно в степени, равные их стехиометрическим коэффициентам, величина постоянная (К. Гульдберг, П. Вааге, 1867 г.).
Для газообразных веществ Kp и Kc связаны соотношением Kp = (RT)ΔnKc, где Δn – разность числа молей начальных и конечных газообразных реагентов.
Константа равновесия определяется при известных равновесных концентрациях реагирующих веществ или по известной ΔG° химической реакции.
Практическая часть
Ход выполнения работы
1.Получите задание у преподавателя с указанием номера варианта.
2.Прочитайте внимательно каждую из задач.
3.Где нужно, составьте план решения задачи.
4.Запишите в тетради тему занятия, номер варианта и решение задач.
Вариант 1
При температуре 800 К константа равновесия процесса н-С6Н14(г)+ → 2С3Н6(г)+Н2(г) равна 8,71. Определить D Gоf,800(С3Н6(г)), если D Gоf,800(н-С6Н14(г))=305,77 кДж/моль.
При некоторой температуре равновесные концентрации в системе 2CO (г) + O2 (г) ↔ 2CO2 (г) составляли: [CO] = 0,2 моль/л, [O2] = 0,32 моль/л, [CO2] = 0,16 моль/л. Определить константу равновесия при этой температуре и исходные концентрации CO и O2, если исходная смесь не содержала СО2.
Вариант 2
Для реакции СО(г) + Cl2(г) → СO2Cl2(г) при некоторой температуре равновесная концентрация СO2Cl2(г) равна 1,2 моль/л. Определить константу равновесия данного процесса, если исходные концентрации СО(г) и Cl2(г) равны соответственно 2,0 и 1,8 моль/л.
Определить равновесную концентрацию HI в системе H2(г) + I2(г) ↔ 2HI(г), если при некоторой температуре константа равновесия равна 4, а исходные концентрации H2 , I2 и HI равны, соответственно, 1, 2 и 0 моль/л.
Вариант 3
При некоторой температуре равновесные концентрации в системе 2SО2(г) + О2(г) → 2SO3(г) составляли: [SО2 ]=0,10 моль/л, [О2]=0,16 моль/л, [SО3]=0,08 моль/л. Вычислить константу равновесия и исходные концентрации SО2 и О2.
Константа равновесия гомогенной системы:
СО(г) + Н2О(г) = СО2(г) + Н2(г)
при 850оС равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СО]исх =3 моль/л, [Н2О]исх = 2 моль/л.
Контрольные вопросы
В чем основа химического равновесия?
Перечислите факторы, влияющие на химическое равновесие?
Практическое занятие №7.
Расчет задач на основные законы. Криоскопия
Цель работы: научиться решать задачи на определение температуры замерзания
Теоретические положения
Раствор в отличие от чистой жидкости не отвердевает целиком при постоянной температуре; при некоторой температуре, называемой температурой начала кристаллизации, начинают выделяться кристаллы растворителя и по мере кристаллизации температура раствора понижается (поэтому под температурой замерзания раствора всегда понимают именно температуру начала кристаллизации). Замерзание растворов можно охарактеризовать величиной понижения температуры замерзания ΔТзам, равной разности между температурой замерзания чистого растворителя T°зам и температурой начала кристаллизации раствора Tзам:
![]() (1)
(1)
Рассмотрим Р – T диаграмму состояния растворителя и растворов различной концентрации (рис. 1), на которой кривая ОF есть зависимость давления пара над твердым растворителем, а кривые ОА, ВС, DE – зависимости давления пара над чистым растворителем и растворами с возрастающими концентрациями соответственно. Кристаллы растворителя будут находиться в равновесии с раствором только тогда, когда давление насыщенного пара над кристаллами и над раствором одинаково. Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, температура, отвечающая этому условию, всегда будет более низкой, чем температура замерзания чистого растворителя. При этом понижение температуры замерзания раствора ΔTзам не зависит от природы растворенного вещества и определяется лишь соотношением числа частиц растворителя и растворенного вещества.

Рис. 1 Понижение температуры замерзания разбавленных растворов
Можно показать, что понижение температуры замерзания раствора ΔTзам прямо пропорционально моляльной концентрации раствора:
![]() (2)
(2)
Уравнение (2) называют вторым законом Рауля. Коэффициент пропорциональности K – криоскопическая постоянная растворителя – определяется природой растворителя.
Пример. Вычислить, сколько глицерина C3H5(OH)3 нужно растворить в 200 г воды, чтобы раствор замерзал при — 5°С. Криоскопическая постоянная воды 1,86 град.
Решение.
Молярная масса глицерина: М = (12×3)+(16×3)+(8×1) = 92 г/моль
Воспользуемся II законом Рауля:
ΔTкрист = K·m, где
K — криоскопическая константа,
mв-ва — моляльность вещества в растворе.
Моляльность раствора равна:
m = n/G = g/M·G
ΔTкрист= 1000·K· g/M·G,
где g – масса растворенного вещества,
G – масса растворителя.
Температура кристаллизации Ткрист чистой воды = 0 °С.
Значит понижение температуры кристаллизации
ΔТкрист = 0 – (–5) = 5 °С.
5 = 1000·1,86·g/200·0,92
g = 49,5 г
Таким образом, масса глицерина равна 49,5 г
Практическая часть
Ход выполнения работы
1.Получите задание у преподавателя с указанием номера варианта.
2.Прочитайте внимательно каждую из задач.
3.Где нужно, составьте план решения задачи.
4.Запишите в тетради тему занятия, номер варианта и решение задач.
Вариант 1
Чему равна температура замерзания раствора AlCl3 с молярной концентрацией эквивалента 0,3 моль/л, если его степень диссоциации равна 60%?
Вычислить температуру замерзания раствора 5%-ного этилового спирта, зная, что криоскопическая константа воды 1,860С
Вариант 2
Чему равна температура замерзания раствора AlCl3 с молярной концентрацией эквивалента 0,3 моль/л, если его степень диссоциации равна 60%?
Вычислите температуру кристаллизации раствора мочевины (NН2)2СО, содержащего 5 грамм мочевины в 150 граммах воды. Криоскопическая константа воды равна 1,86 (°С).
Вариант 3
Рассчитайте массовую долю хлорида натрия в физиологическом растворе, осмотическое давление которого при 25оС составляет 762,7 кПа (α=1, ρ=1г/см3).
Определите температуру замерзания раствора, содержащего 1 грамм нитробензола (C6H5NO2) в 10 граммах бензола (C6H6). Криоскопическая константа бензола соответственно равны 5,1 0С. Температура замерзания -5,4 0С.
Практическое занятие №8.
Расчет задач на основные законы. Эбулиоскопия
Цель работы: научиться решать задачи, используя эбулиоскопическую постоянную растворителя.
Теоретические положения
Температура кипения растворов нелетучего вещества всегда выше, чем температура кипения чистого растворителя при том же давлении. Рассмотрим Р – T диаграмму состояния растворителя и растворов различной концентрации (рис.1). Любая жидкость – растворитель или раствор – кипит при той температуре, при которой давление насыщенного пара становится равным внешнему давлению. Соответственно температуры, при которых изобара Р = 1 атм. пересечет кривые ОА, ВС и DE, представляющие собой зависимости давления пара над чистым растворителем и растворами с возрастающими концентрациями соответственно, будут температурами кипения этих жидкостей.
Повышение температуры кипения растворов нелетучих веществ ΔTк = Tк – T°кпропорционально понижению давления насыщенного пара и, следовательно, прямо пропорционально моляльной концентрации раствора. Коэффициент пропорциональности E есть эбулиоскопическая постоянная растворителя, не зависящая от природы растворенного вещества.
![]() (1)
(1)
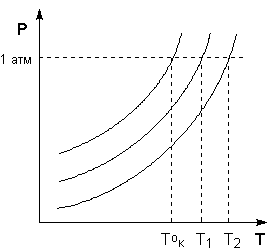
Рис. 1 Повышение температуры кипения разбавленных растворов
Т.о., второй закон Рауля можно в наиболее общем виде сформулировать следующим образом:
Понижение температуры замерзания и повышение температуры кипения разбавленного раствора нелетучего вещества прямо пропорционально моляльной концентрации раствора и не зависит от природы растворенного вещества.
Второй закон Рауля является следствием из первого; данный закон справедлив только для бесконечно разбавленных растворов. Коэффициенты пропорциональности в уравнениях– эбулиоскопическая и криоскопическая константы – имеют физический смысл соответственно повышения температуры кипения и понижения температуры замерзания растворов с моляльной концентрацией, равной 1 моль/кг. Однако, поскольку такие растворы не являются бесконечно разбавленными, эбулиоскопическая и криоскопическая константы не могут быть непосредственно определены и относятся поэтому к числу т.н. экстраполяционных констант.
Пример. Из скольких атомов состоит молекула иода в спиртовом растворе, если раствор 6,35 г йода в 100 г этанола кипит при 78,59оС?
Решение.
Из закона Рауля следует, что:
ΔTкип= 1000·Е· g/M·G,
где Е – эбулиоскопическая постоянная,
g – масса растворенного вещества,
G – масса растворителя,
М – молярная масса растворенного вещества.
Найдем молярную массу растворенного вещества, используя справочные данные:
Е (этанола) = 1,2
Ткип (этанола) = 78,39ºС
ΔTкип = 78,59 – 78,39 = 0,2ºС
М = 1000·Е· g/G·ΔTкип
М = 1000·1,2·6,35/100·0,2 = 381 г/моль
Атомная масса йода равна 126,9,
N = 381/126,9 = 3
Следовательно, молекула иода состоит из 3 атомов
Практическая часть
Ход выполнения работы
1.Получите задание у преподавателя с указанием номера варианта.
2.Прочитайте внимательно каждую из задач.
3.Где нужно, составьте план решения задачи.
4.Запишите в тетради тему занятия, номер варианта и решение задач.
Вариант 1
Сколько граммов глюкозы С6Н12О6 было растворено в 0,5л воды, если температура кипения полученного раствора составила 1020С?
Найти температуру кипения раствора 50-% сахарозы (С12Н22О11)? Эбулиоскопическая константа воды 0,52.
Вариант 2
Найдите относительную молярную массу неэлектролита, если его 10%-ный раствор кипит при 100,60С.
В 200 г воды растворено: 1) 31 г карбамида СО(NH2)2; 2) 90 г глюкозы C6H12O6. Будет ли температура кипения этих растворов одинакова: а) да; б) нет?
Вариант 3
Определите температуру кипения раствора, содержащего 1 грамм нитробензола (C6H5NO2) в 10 граммах бензола (C6H6). Эбулиоскопическая константа бензола соответственно равна 2,57 0С. Температура кипения чистого бензола 80,2 0С.
Некоторый водный раствор неэлектролита кипит при 373,52 К. Какова моляльная концентрация этого раствора: а) СМ = 1; б) СМ = 0,1; в) СМ = 0,01 моль на 1000 г Н2О?
Практическое занятие №9.
Расчет задач на основные законы. Правило фаз
Цель работы: научиться решать задачи на Законы Рауля и принцип Вант-Гоффа
Теоретические положения
Законы Рауля и принцип Вант-Гоффа не выполняются для растворов (даже бесконечно разбавленных), которые проводят электрический ток – растворов электролитов. Обобщая экспериментальные данные, Я.Г. Вант-Гофф пришел к выводу, что растворы электролитов всегда ведут себя так, будто они содержат больше частиц растворенного вещества, чем следует из аналитической концентрации: повышение температуры кипения, понижение температуры замерзания, осмотическое давление для них всегда больше, чем вычисленные. Для учета этих отклонений Вант-Гофф внес в уравнение для растворов электролитов поправку – изотонический коэффициент i:
![]() (1)
(1)
Аналогичная поправка вносится в законы Рауля, и изотонический коэффициент определяется следующим образом:
 (2)
(2)
Изотонический коэффициент для растворов электролитов всегда больше единицы, причем с разбавлением раствора i возрастает до некоторого целочисленного значения.
Для объяснения особенностей свойств растворов электролитов С. Аррениус предложил теорию электролитической диссоциации, основывающуюся на следующих постулатах:
1. Электролиты в растворах распадаются на ионы – диссоциируют;
2. Диссоциация является обратимым равновесным процессом;
3. Силы взаимодействия ионов с молекулами растворителя и друг с другом малы (т.е. растворы являются идеальными).
Диссоциация электролитов в растворе происходит под действием полярных молекул растворителя; наличие ионов в растворе предопределяет его электропроводность. Для оценки полноты диссоциации в теории электролитической диссоциации вводится понятие степень диссоциации α, которая равна отношению числа молекул n, распавшихся на ионы, к общему числу молекул N:
![]() (3)
(3)
Величина степени диссоциации зависит от природы растворителя и растворенного вещества, концентрации раствора и температуры. По величине степени диссоциации электролиты подразделяются на три группы: сильные (α ≥ 0.7), средней силы (0.3 3СОО)2, НgСl2, СdСl2), большинство неорганических кислот и щелочей; к слабым – все органические кислоты, вода, NН4ОН, Н2S и т.д. Электролитами средней силы являются некоторые неорганические кислоты: НF, НСN, Н3PO4.
Пример.Рассчитать изменение давления, необходимое для изменения температуры плавления льда на 1o C. При 0o C энтальпия плавления льда равна 333.5 Дж. г–1, удельные объемы жидкой воды и льда равны Vж. = 1.0002 см3.г–1 и Vтв. = 1.0908 см3. г–1.
Решение. Изменение объема при плавлении льда равно
Vж. – Vтв. = 1.0002 – 1.0908 = –0.0906 см3. г–1 = –9.06![]() 10–8 м3. г–1.
10–8 м3. г–1.
![]() = –1.348
= –1.348![]() 107 (Па. К–1) = –133 атм. К–1.
107 (Па. К–1) = –133 атм. К–1.
Таким образом, при повышении давления на 133 атм температура плавления льда понижается на 1 градус. Знак "минус" показывает, что при повышении давления температура плавления понижается.
Ответ. ![]() P = 133 атм.
P = 133 атм.
Практическая часть
Ход выполнения работы
1.Получите задание у преподавателя с указанием номера варианта.
2.Прочитайте внимательно каждую из задач.
3.Где нужно, составьте план решения задачи.
4.Запишите в тетради тему занятия, номер варианта и решение задач.
Вариант 1
Рассчитать давление, при котором две формы CaCO3 – кальцит и арагонит – находятся в равновесии при 25o C. ![]() fGo кальцита и арагонита при 25o C равны –1128.79 и –1127.75 кДж. моль–1 соответственно. Считать, что плотности кальцита и арагонита равны 2.71 и 2.93 г. см–3 соответственно и не зависят от давления.
fGo кальцита и арагонита при 25o C равны –1128.79 и –1127.75 кДж. моль–1 соответственно. Считать, что плотности кальцита и арагонита равны 2.71 и 2.93 г. см–3 соответственно и не зависят от давления.
Рассчитать температуру, при которой две формы CaCO3 – кальцит и арагонит – находятся в равновесии при давлении 1 атм. При 25o C ![]() fGo кальцита и арагонита равны –1128.79 и –1127.75 кДж. моль–1 соответственно,
fGo кальцита и арагонита равны –1128.79 и –1127.75 кДж. моль–1 соответственно, ![]() fHoравны–1206.92 и –1207.13 кДж. моль–1 соответственно. Считать, что
fHoравны–1206.92 и –1207.13 кДж. моль–1 соответственно. Считать, что ![]() CP = 0.
CP = 0.
Вариант 2
Давление пара диэтилового эфира при 10o C равно 286.8 мм рт. ст., а при 20o C – 432.8 мм рт. ст. Определить мольную энтальпию испарения и нормальную температуру кипения эфира.
Давление пара дихлорметана при 24.1oC равно 400 Торр, а его энтальпия испарения равна 28.7 кДж. моль–1. Рассчитать температуру, при которой давление пара будет равно 500 Торр.
Вариант 3
Давление пара жидкого нафталина C10H8 равно 10 Торр при 85.8oC и 40 Торр при 119.3oC. Определить энтальпию испарения, нормальную точку кипения и энтропию испарения в нормальной точке кипения.
Нормальная точка кипения гексана равна 69.0єC. Оценить а) мольную энтальпию испарения и б) давление пара гексана при 25єC и 60єC.
Практическое занятие №10.
Расчет задач на основные законы. Равновесие в системах
Цель работы: научиться решать задачи на определение равновесия в системах
Теоретические положения
Процесс диссоциации слабых электролитов является обратимым и в системе существует динамическое равновесие, которое может быть описано константой равновесия, выраженной через концентрации образующихся ионов и непродиссоциировавших молекул, называемой константой диссоциации. Для некоторого электролита, распадающегося в растворе на ионы в соответствии с уравнением:
АaВb aАx- + bВy+
константа диссоциации выразится следующим соотношением:
![]() (1)
(1)
Для бинарного (распадающегося на два иона) электролита выражение (1) можно переписать в виде (2):
![]() (2)
(2)
Поскольку концентрация каждого иона для бинарного электролита равна произведению степени диссоциации α на общую концентрацию электролита С, выражение (2) в этом случае можно переписать следующим образом:
![]() (3)
(3)
Для разбавленных растворов можно считать, что (1 – α) = 1. Тогда получаем:
![]() (4)
(4) ![]() (5)
(5)
Т.о., степень диссоциации слабого электролита обратно пропорциональна концентрации и прямо пропорциональна разбавлению раствора; выражение (5) называют законом разбавления Оствальда. Степень диссоциации слабого электролита можно связать с изотоническим коэффициентом. Будем считать, что из N молекул электролита продиссоциировало n молекул, образовав νn ионов (ν – число ионов, на которое диссоциирует молекула). Поскольку изотонический коэффициент показывает, во сколько раз общее число молекул и ионов в растворе больше числа молекул до диссоциации, получаем:
![]() (6)
(6)
![]() (7)
(7)
Соотношение (7) дает возможность, экспериментально определив изотонический коэффициент раствора, рассчитать степень диссоциации слабого электролита.
Практическая часть
Ход выполнения работы
1.Получите задание у преподавателя с указанием номера варианта.
2.Прочитайте внимательно каждую из задач.
3.Где нужно, составьте план решения задачи.
4.Запишите в тетради тему занятия, номер варианта и решение задач.
Вариант 1
При 1273 К и общем давлении 30 атм в равновесной смесиCO2(г) + C(тв) = 2CO(г)
содержится 17% (по объему) CO2. Сколько процентов CO2 будет содержаться в газе при общем давлении 20 атм? При каком давлении в газе будет содержаться 25% CO2?
При 2000oC и общем давлении 1 атм 2% воды диссоциировано на водород и кислород. Рассчитать константу равновесия реакцииH2O(г) = H2(г) + 1/2O2(г) при этих условиях.
Вариант 2
Константа равновесия реакцииCO(г) + H2O(г) = CO2(г) + H2(г)при 500oC равна Kp = 5.5. Смесь, состоящая из 1 моль CO и 5 моль H2O, нагрели до этой температуры. Рассчитать мольную долю H2O в равновесной смеси.
Константа равновесия реакцииN2O4(г) = 2NO2(г)при 25oC равна Kp = 0.143. Рассчитать давление, которое установится в сосуде объемом 1 л, в который поместили 1 г N2O4 при этой температуре.
Вариант 3
Для реакции2HI(г) = H2(г) + I2(г)константа равновесия KP = 1.83![]() 10–2 при 698.6 К. Сколько граммов HI образуется при нагревании до этой температуры 10 г I2 и 0.2 г H2 в трехлитровом сосуде? Чему равны парциальные давления H2, I2 и HI?
10–2 при 698.6 К. Сколько граммов HI образуется при нагревании до этой температуры 10 г I2 и 0.2 г H2 в трехлитровом сосуде? Чему равны парциальные давления H2, I2 и HI?
Сосуд объемом 1 л, содержащий 0.341 моль PCl5 и 0.233 моль N2, нагрели до 250oC. Общее давление в сосуде при равновесии оказалось равно 29.33 атм. Считая все газы идеальными, рассчитать константу равновесия при 250oC для протекающей в сосуде реакцииPCl5 (г) = PCl3 (г) + Cl2(г)
Практическое занятие №11.
Равновесие в растворах электролитов
Цель работы: научиться решать задачи на определение равновесия в растворах электролитов
Теоретические положения
Растворение некоторых веществ сопровождается высвобождением или образованием ионов. При этом возможны диссоциативный и ионизационный механизмы. Диссоциативный механизм превалирует при разрушении ионной кристаллической решетки под воздействием сольватирующего растворителя. Так, ионы, составляющие кристаллическую решетку KCl, приобретают способность проводить электрический ток в любом из двух случаев разрушения кристаллической решетки – под воздействием тепловой энергии (расплав) или под воздействием сольватирующего растворителя (растворение). В последнем случае в раствор переходят готовые ионы, окруженные молекулами растворителя. Процесс взаимодействия ионов кристаллической решетки с молекулами растворителя называется сольватацией.
Ионизационный механизм состоит в том, что в молекулах газообразных, твердых и жидких веществ под воздействием полярных молекул растворителя увеличивается доля ионности настолько, что в раствор могут переходить сольватированные ионы. В зависимости от природы растворителя электролит может быть полностью диссоциирован, либо будет вести себя как слабый электролит:
|
|
|
|
В воде равновесие смещено вправо и растворенный хлористый водород диссоциирован полностью. В бензоле растворенный HCl ведет себя как слабый электролит.
Важной характеристикой электролитов служит степень диссоциации α:
|
|
| |
По величине степени диссоциации электролиты делятся на слабые и сильные. Для сильных электролитов, к которым относятся некоторые минеральные кислоты и щелочи, большинство солей, α 30 %. К слабым относят некоторые минеральные кислоты (HNO2, HCN, H2SO3), большинство оснований, практически все органические кислоты.
Важнейшей характеристикой слабого электролита служит константа диссоциации.
Рассмотрим равновесную реакцию диссоциации слабого электролита HAn:
|
|
|
|
Константа равновесия Kc этой реакции и есть Kд:
|
|
|
|
Если выразить равновесные концентрации через концентрацию слабого электролита C и его степень диссоциации α, то получим
|
|
| |
Это соотношение называют законом разбавления Оствальда. Для очень слабых электролитов при α
|
|
|
|
Тогда
|
|
|
|
Это позволяет заключить, что при бесконечном разбавлении степень диссоциации α стремится к единице.
Рассмотрим диссоциацию N моль электролита, диссоциирующего на n ионов. Тогда можем записать
|
|
|
|
Решая его относительно α, получим
|
|
|
|
Определив экспериментально изотонический коэффициент, можно найти степень диссоциации α в условиях эксперимента.
Кислоты и основания диссоциируют ступенчато. Каждая ступень диссоциации характеризуется своей константой. Так, трехосновная ортофосфорная кислота H3PO4 диссоциирует следующим образом
| ||||||||||||
| |
Важное значение имеет диссоциация воды, поскольку, являясь слабым электролитом и обычным растворителем, она участвует в кислотно-основном равновесии растворенных в ней электролитов.
Вода диссоциирует на ионы:
|
|
|
|
ее константа при 298 K равна
|
|
|
|
При столь малой константе диссоциации концентрация воды остается практически неизменной и равной
|
|
|
|
Отсюда произведение постоянных величин Kд∙[H2O] = [H+]∙[OH–] = const.
Численная величина произведения ионов, на которые диссоциирует вода, называемое ионным произведением воды Kв, равна
|
|
|
|
Таким образом, в пределах 15–25 °C ионное произведение воды Kв = 10–14.
Равенство [H+] и [OH–] соответствует нейтральной среде [H+] = [OH–] = 1 ∙ 10–7, при [H+] 1 ∙ 10–7 – кислой, при [H+] –7 – щелочной.
Задача 1.
Вычислите степень электролитической диссоциации муравьиной кислоты, если известно, что С(НСООН)=0,3 моль/л, а К(НСООН)=2,1.10-4.
| Дано: С(НСООН) = 0,3 моль/л К(НСООН) = 2,1 10-4 α - ? | Решение: Так как С(НСООН) 0,1 моль/л, а К(НСООН) = 10-4, то вычисления проводим по упрощенной формуле закона разбавления Оствальда.
|
Ответ: 2,65 %.
Практическая часть
Ход выполнения работы
1.Получите задание у преподавателя с указанием номера варианта.
2.Прочитайте внимательно каждую из задач.
3.Где нужно, составьте план решения задачи.
4.Запишите в тетради тему занятия, номер варианта и решение задач.
Вариант 1
Равновесие реакции 2NO + O2 = 2NO2 установилось при следующих концентрациях реагирующих веществ (моль/л): С (NO) = 0,5; С (O2) = 0,7; С (NO2) = 2,1. Как изменится скорость прямой и обратной реакций, если в системе уменьшить давление в 2 раза? Произойдет ли при этом смещение равновесия реакции?
Вычислите степень диссоциации и концентрацию ионов NH4+ и концентрацию гидроксид ионов OH- в 0,5 М растворе NН4OH, если константа диссоциации нашатырного спирта составляет 1,8∙10-5.
Вариант 2
Химическое равновесие реакции CO2 + H2 = CO + H2O установилось при следующих концентрациях реагирующих веществ (моль/л): С (CO2) = 7; С (H2) = 5; С (CO) = 10; С (H2O) = 14. Равновесие системы было нарушено из-за уменьшения концентрации H2O до 11 моль/л. Вычислите равновесные концентрации веществ после сдвига равновесия.
Из насыщенного при 15 °С водного раствора хлорида бария массой 19,29 г путем выпаривания получен кристаллогидрат BaCl2.2H2O массой 6,17 г. Найдите растворимость безводного хлорида бария и процентную концентрацию раствора в расчете на безводную соль.
Вариант 3
Какой объем нужно добавить воды к 500 миллилитрам 0,1 Н раствора уксусной кислоты (CH3COOH), чтобы степень диссоциации кислоты удвоилась?
Какое количество ионов водорода содержится в 100 мл 0,1 моль/л раствора уксусной кислоты, если степень ее ионизации составляет 1,36?
Практическое занятие №12.
Ионное произведение воды.
Цель работы: научиться решать задачи на нахождение ионного произведения воды
Теоретические положения
Для определения кислотно-основных свойств раствора пользуются водородным показателем pH. По определению, это отрицательный десятичный логарифм концентрации водородных ионов: pH = –lg [H+].
Очевидно, –lg [H+][OH–] = –lg 1 ∙ 10–14 дает pH + pOH = 14.
Тогда pH 7 соответствует щелочной среде, pH = 7 – нейтральной среде.
Поскольку pH + pOH = 14, можно видеть, что pH может меняться от небольших отрицательных значений до величин, немного превышающих 14 (pH NaOH c C = 2 равен 14,3).
Вода является слабым электролитом и диссоциирует по уравнению: H2O =H+ + OH-. Выражение для
константы диссоциации имеет вид: Кдис = [H+]рав [OH-]рав =1,8 10-16
[H2O ]рав.
Значение Кдис воды определили экспериментально по измерению удельной электропроводности при Т = 25 оС. Чистая вода практически не проводит электрический ток, т.е. άдис(H2O)
[H2O ]рав = [H2O]нач. Рассчитаем молярную концентрацию чистой воды, зная, что 1л воды весит 1 кг (ρ =1кг/л):
См(H2O) = m (H2O) = 1000 г = 55,6 моль/ л.
M (H2O) * V (H2O) 18 г/моль* 1 л
Подставим полученное значение См(H2O) в уравнение для Крав::
Крав * 55,6 = Кw = [H+] [OH-] = 10-14 , где Кw – ионное произведение воды.
В чистой воде [H+] [OH-] = 1 10-14 , тогда [H+] = [OH-] = 10-7 моль/л.
В водных растворах кислот [H+] [OH-] или [H+] 7 моль/л, среда кислая.
В водных растворах щелочей и оснований [H+] OH-], [H+]
При растворении в воде любых по природе веществ остается неизменным - [H+] [OH-] = 1 10-14 .
Для удобства выражения реакции среды водных растворов был введен специальный термин, который назвали водородным показателем (рН). рН – отрицательный десятичный логарифм молярной концентрации ионов водорода:
рН = - lg [H+].
Иногда пользуются также показателем рОН – отрицательный десятичный логарифм молярной концентрации ионов гидроксила. рОН = - lg [ОH-]
В нейтральной среде рН = 7 ; рОН = 7, рН + рОН = 14
В кислой среде рН
В щелочной среде pH 7 ; рОН
Кислотность и щелочность (рН) является важнейшей характеристикой всех водных растворов и естественных водных объектов (реки, озера, моря, океаны ). рН контролирует скорость многих химических, биологических и биохимических процессов, играет важную роль в медицине, в технологии пищевой и перерабатывающей промышленности.
Пример 1 Рассчитайте рН раствора, в 500 мл которого содержится 0,245 г серной кислоты. Степень диссоциации кислоты равна 1.
Решение: Уравнение диссоциации кислоты: H2SO4 2H+ + SO4-2
Выражение для расчета рН: рН = -lgCM (H+), где CM (H+) = n (H+) * άдис * CM (кислоты).
Рассчитаем CM (кислоты) = 0,245 / 98 * 0,5 = 0,05 моль/л
Тогда рН = -lg ( 1 * 2 * 0,05) = -lg 0,1 = 1.
Пример 2 Рассчитайте рН 5,6% раствора КОН, степень диссоциации щелочи в растворе составляет 0,9. Плотность раствора равна 1,02 мл/л.
Решение: Уравнение диссоциации щелочи: КОН К+ + ОН-
Выражение для расчета рН в растворах щелочей : рН = 14 – рОН = 14 – (-lg (ОH-) * άдис *CM (КОН)).
Рассчитаем CM (КОН) = 12 * 1,02 / 56 * 0,1 = 1,02 моль/л
Тогда рН = 14 -lg ( 0,9 * 1 * 1,02) = 13.
Практическая часть
Ход выполнения работы
1.Получите задание у преподавателя с указанием номера варианта.
2.Прочитайте внимательно каждую из задач.
3.Где нужно, составьте план решения задачи.
4.Запишите в тетради тему занятия, номер варианта и решение задач.
Вариант 1
Рассчитайте концентрацию ионов водорода в растворе, если: а) рН=4; б) рОН = 11; в) рН = 12; г) рН = 8.
Вычислите рН 0,1 М растворе НF.
Определите рН 0,02 М. раствора Н2СО3, учитывая только первую ступень диссоциации.
Вариант 2
Рассчитайте рН и рОН раствора, в которых концентрация ионов Н+ составляет: а)10-3; б)10-11; в)10-5; г) 10-1.
Вычислите рН в 0,1 М растворе сернистой кислоты, учитывая только 1-ю ступень диссоциации.
Сравните рН среды в 0,1 М и 0,001 М растворах HCN.
Вариант 3
Во сколько раз различается концентрация ионов ОН- в растворах: а) рН=3 и рОН = 2;
Вычислите рН и степень диссоциации в 0,002 М растворе HCIO.
Рассчитайте рН в растворе Sr(ОН)2, если 200 мл этого раствора содержат 0,074 г гидроксида кальция. Степень диссоциации электролита равна 1.
Практическое занятие №13.
Удельная и эквивалентная электропроводность.
Цель работы: Научиться решать задачи на удельную и эквивалентную электропроводности.
Теоретические положения
Эквивалентной электропроводностью называется электрическая проводимость раствора электролита толщиной 1 м, находящегося между одинаковыми электродами с такой площадью, чтобы объем жидкости, заключенный между ними, содержал 1 моль химического эквивалента растворенного вещества.
Таким образом, если удельная электропроводность характеризует проводимость единичного объема раствора электролита (в системе СИ – 1 м3), в котором содержание данного вещества может быть различным, то эквивалентная электропроводность характеризует электрическую проводимость раствора, содержащего один моль химического эквивалента растворенного вещества. Причем объем самого раствора может изменяться в широких пределах вплоть до бесконечного при бесконечном разбавлении.
Общее же количество электролита, определяющее величину его эквивалентной электропроводности, остается одним и тем же при любой концентрации и в любом объеме раствора. Схема, объясняющая связь между удельной и эквивалентной электропроводностью вещества, представлена на рис. 1.
|
|
|
| Рис. 1. Зависимость между удельной и эквивалентной электрическими проводимостями
| Рис. 2. Зависимость эквивалентной электропроводности растворов электролитов от степени разбавления
|
Эквивалентная электропроводность зависит от тех же факторов, что и удельная.
Для сильных и слабых электролитов λV возрастает с уменьшением концентрации раствора, достигая максимального значения при достаточно большом разбавлении V (рис. 2). Она называется иначе предельной электрической проводимостью и обозначается λ∞.
Эквивалентная электропроводность обозначается греческой буквой λV (ламбда), причем индексом внизу показывают обычно объем раствора (в м3), в котором содержится 1 моль химического эквивалента электролита.
Эквивалентная электропроводность равна удельной электропроводности 1 м3 раствора, умноженной на объем (V) этого же раствора (в м3), содержащий 1 моль химического эквивалента электролита
λV = ϰ ∙ V
Учитывая, что 1/V = С (молярная концентрация эквивалента электролита в растворе, моль/м3)
λV = ϰ/C
Эквивалентная электропроводность измеряется в
См ∙ моль–1 ∙ м2 или Ом–1 ∙ моль–1 ∙ м2. В справочной литературе эквивалентную электропроводность часто приводят в единицах измерения См ∙ моль–1 ∙ см2 или Ом–1 ∙ моль–1 ∙ см2. (При этом удельная электропроводность ϰ выражается в
Ом–1 ∙ см–1 или См ∙ см–1, молярная концентрация эквивалента в моль/см3).
В таких условиях в растворах сильных электролитов ионы находятся на достаточно больших расстояниях друг от друга, электростатические взаимодействия между ними отсутствуют, ионные атмосферы не образуются.
В растворах слабых электролитов степень диссоциации достигает своей максимальной величины (a = 1) и все молекулы распадаются на ионы.
Следовательно, λ∞ в таких условиях зависит только от скорости движения ионов.
Кольрауш установил, что при таком разведении катионы и анионы проводят электричество независимо друг от друга, т.к. силы взаимодействия между ними отсутствуют. В этом случае эквивалентная электропроводность раствора будет равна сумме электропроводностей катионов (λк) и анионов (λа)
λ∞ = λк + λа
Пример. Удельная электропроводность 0.135 моль.л-1 раствора пропионовой кислоты C2H5COOH равна 4.79. 10-2 См. м-1. Рассчитать эквивалентную электропроводность раствора, константу диссоциации кислоты и pH раствора, если предельные подвижности H+ и C2H5COO-равны 349.8 См. см2. моль-1 и 37.2 См.см2 моль-1. соответственно.
Решение.
0 = 349.8 + 37.2 = 387.0 См.см2. моль-1.
= /C? 1000 = 4.79.10-2 См.м-1/0.135 моль.л-1. 1000 = 3.55 См. см2. моль-1.
= / 0 = 3.55/387.0 = 0.009.
![]() = 1.15.10-5 (моль. л-1).
= 1.15.10-5 (моль. л-1).
[H+] = . c =1.24.10-3(моль.л-1).
pH = -lg[H+] = 2.91.
Ответ. = 3.55 См.см2. моль-1; = 0.009; K = 1.15.10-5 моль. л-1; pH = 2.91.
Практическая часть
Ход выполнения работы
1.Получите задание у преподавателя с указанием номера варианта.
2.Прочитайте внимательно каждую из задач.
3.Где нужно, составьте план решения задачи.
4.Запишите в тетради тему занятия, номер варианта и решение задач.
Вариант 1
Удельная электропроводность насыщенного раствора BaCO3 в воде при 18oC равна 25.475. 10-4 см. м-1. Удельная электропроводность воды 4.5. 10-5 См. м-1. Подвижности ионов Ba2+ и CO32- при 18oC равны соответственно 55 и 66 см. см2. г-экв-1. Рассчитать растворимость BaCO3 в воде при 18oC в моль. л-1. считая соль полностью диссоциированной, а подвижности ионов равными подвижностям при бесконечном разведении.
Удельная электропроводность бесконечно разбавленных растворов KCl, KNO3 и AgNO3 при 25oC равна соответственно 149.9, 145.0 и 133.4 См. м2. моль-1. Какова удельная электропроводность бесконечно разбавленного раствора AgCl при 25oC?
Вариант 2
Удельная электропроводность 5%-го раствора Mg(NO3)2 при 18oC равна 4.38 См. м-1. а его плотность - 1.038 г. см-3. Рассчитать эквивалентную электропроводность раствора и кажущуюся степень диссоциации соли в растворе. Подвижности ионов Mg2+ и NO3- при 18oC равны соответственно 44.6 и 62.6 См. см2. г-экв-1.Удельная электропроводность бесконечно разбавленных растворов соляной кислоты, хлорида натрия и ацетата натрия при 25oC равна соответственно 425.0. 128.1 и 91.0 См.м2 .моль-1. Какова удельная электропроводность бесконечно разбавленного раствора уксусной кислоты при 25oC?
Вариант 3
Рассчитать удельную электропроводность абсолютно чистой воды при 25oC. Ионное произведение воды при 25oC равно 1.00. 10-14
Удельная электропроводность 4% водного раствора H2SO4 при 18oC равна 0.168 См. см-1. плотность раствора - 1.026 г.см-3. Рассчитать эквивалентную электропроводность раствора.
Перечень рекомендуемых учебных изданий, Интернет - ресурсов, дополнительной литературы
Основные источники:
Булидорова Г.В. Фазовые равновесия в многокомпонентных системах: учебное пособие/ Г.В. Булидорова; М-во образ. И науки России, Казан. Нац. Исслед. Технол. Ун-т. – Казань: Изд-во КНИТУ, 2014. – 168 с.
Гамеева О. С. Сборник задач и упражнений по физической и коллоидной химии: учебное пособие / О. С. Гамеева. - Санкт-Петербург [и др.]: Лань, 2015.
Кудряшева Н.С. Физическая и коллоидная химия: учебник и практикум для СПО/ Н.С. Кудряшева, Л.Г. Бондарева. – М.: Издательство Юрайт, 2017. – 379 с. – Серия: Профессиональное образование
Физическая химия. Учебное пособие / А. Свиридов, В. Свиридов, Изд-во «Лань», 2014. – 600с.
Дополнительные источники:
1. Белик, В.В. Физическая и коллоидная химия [Текст]: Учебник для СПО / В.В. Белик, К.И. Киенская. -8-е изд. спр. - М.:Академия, 2013.- 288 с.
2. Волков, А.И., Жарский, И.М. Справочник по физической химии: Таблицы/ А.И. Волков И.М. Жарский. – Минск: Литера Гранд; Книжный Дом, 2014.-400 с.
3. Краткий справочник физико-химических величин. Под.ред. А.А. Равделя, А.М. Пономаревой. Л.: Химия, 2013,231с.
4. Барабанов В.П. Адсорбция ионогенных полимеров из растворов: монография / В.П. Барабанов [и др.]; М-во образ. И науки России, Казан. Нац. Исслед. Технол. Ун-т. – Казань: Изд-во КНИТУ, 2014. – 252 с.
5. Основы термохимии. I закон термодинамики: индивидуальные занятия для коллоквиума и практических занятий/сост.: Л.А.Павличенко, Р.И. Юсупова; М-во образ. И науки России, Казан. Нац. Исслед. Технол. Ун-т. – Казань: Изд-во КНИТУ, 2014. – 42 с.
6. Ю.Я. Харитонов. Физическая химия: Издательская группа «ГЭОТАР-Медиа», 2013. – 608 с.
Интернет-ресурсы:
1. Файловый архив для обучающихся – https://studfiles.net.
2. Все для студента по физической и коллоидной химии. http://www.twirpx.com.
3. Журнал «Химияихимики».chemistry-chemists.com
Полезное для учителя




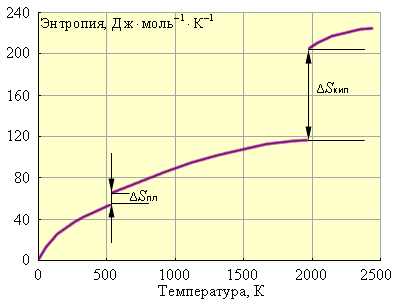
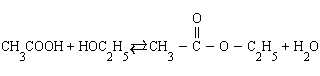
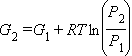
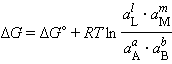

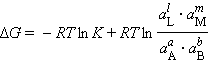
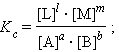
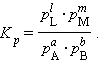

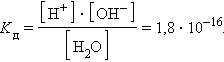
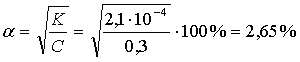 .
.