Просмотр содержимого документа
«Практическая работа: «Получение и расслоение эмульсии бензола с водой. Отношение бензола к бромной воде и раствору перманганата калия."»
Практическая работа:
«Получение и расслоение эмульсии бензола с водой. Отношение бензола к бромной воде и раствору перманганата калия.
https://yandex.ru/video/preview/2082876688878447049
Цель работы: (студенты формулируют самостоятельно)
Ход работы:
Бензол очень токсичен, поэтому соблюдайте правила по ТБ.
1.В пробирку налейте 5-6 капель бензола и добавьте 1-2 мл перманганата калия. 2.Встряхните пробирки. Отметьте наблюдения и запишите их в тетрадь.
Вывод: бензол не обесцвечивает раствор перманганата калия, следовательно, имеет предельный характер.
Таким образом возникают противоречия в строении молекулы бензола.
Использование современных физических и квантовых методов исследования дало возможность создать исчерпывающее представление о строении бензола.
Согласно представлениям о гибридизации орбиталей известно, что атомы углерода находятся в состоянии sp2-гибридизации, т.е. в гибридизации участвует одно s и два р электронных облаков, с образованием трех гибридных облаков (рис. 1).
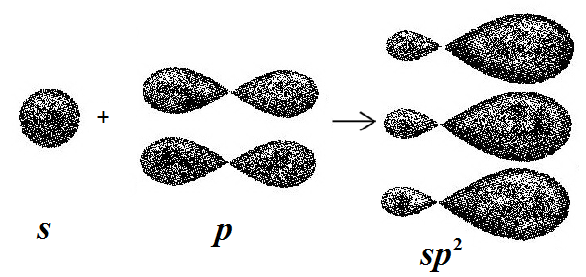
Рис. 1. Перекрывание s и p электронных облаков.
Все 6 атомов углерода имеют по три гибридных облака, которые отталкиваются друга на угол 120 0С и перекрываются между собой и с s-облаками атомов водорода, образуя 12 σ-связей (рис. 2).
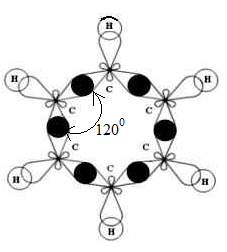
Рис. 2. Схема образования σ-связей в молекуле бензола.
В свою очередь, негибридные р электронные облака каждого атома углерода, которые не участвуют в гибридизации, перекрываются между собой, образуя единое π-электронное облако, т.е. возникает эффект π-сопряжения (рис. 3).


Рис. 3. Перекрывание негибридных р-электронных облаков (а); расположение π-электронного облака (б).
Сочетание 6 σ-связей с единым π-электронным облаком называется ароматической связью. Поэтому бензол относится к ароматическим УВ и является главным представителем этого класса.
Цикл из шести атомов углерода, связанный ароматической связью, называется бензольным кольцом, или бензольным ядром.
Ароматическими УВ (аренами) называются УВ, молекулы которых содержат одно или несколько бензольных колец.
Проведенные позже электронно-графические исследования показали, что все связи между атомами углерода в молекуле бензола имеют одинаковую длину 0,140 нм (это среднее значение между длиной простой связи С – С, равной 0,154 нм, и двойной связи С = С, равной 0,134 нм).
Таким образом, в соответствии с электронным строением бензола молекулу C6H6 изображают следующим образом:
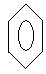
Ароматичность не имеет непосредственного отношения к запаху органических соединений и является понятием, характеризующим совокупность структурных и энергетических свойств некоторых циклических молекул, содержащих систему сопряженных двойных связей. Термин «ароматичность» был предложен потому, что некоторые представители этого класса веществ обладали приятным запахом. Однако большинство ароматических соединений не имеют запаха или пахнут неприятно.
Сформулируйте вывод по работе.





























