Практическая работа № 3: «Получение метана и изучение его свойств».
Ход урока:
1. Запишите цель практической работы:
Цель: получить газ метан и изучить его основные свойства.
2. Запишите вещества и оборудование:
(с указанием их химических формул).
Уксуснокислый натрий, обезвоженный; натронная известь; бромная вода, насыщенный раствор; перманганат калия, 1 н. раствор, газоотводная трубка.
3. Изучите теоретический материал по данной теме:
Метан (лат. methanum; болотный газ), CH4 - простейший по составу предельный углеводород, при нормальных условиях бесцветный газ без вкуса и запаха.
Малорастворим в воде, почти в два раза легче воздуха.
Метан нетоксичен, но при высокой концентрации в воздухе обладает слабым наркотическим действием (ПДК 7000 мг/м3). Имеются данные, что метан при хроническом воздействии малых концентраций в воздухе неблагоприятно влияет на центральную нервную систему.
Накапливаясь в закрытом помещении в смеси с воздухом метан становится взрывоопасен при концентрации его от 4,4 % до 17 %. Наиболее взрывоопасная концентрация в смеси с воздухом 9,5 об.%.
Метан - третий по значимости парниковый газ в атмосфере Земли (после водяного пара и углекислого газа, его вклад в парниковый эффект оценивается 4-9 %).
Основной компонент природного газа (77-99 %), попутных нефтяных газов (31-90 %), рудничного и болотного газов (отсюда произошли другие названия метана - болотный или рудничный газ). В анаэробных условиях (в болотах, переувлажнённых почвах, кишечнике жвачных животных) образуется биогенно в результате жизнедеятельности некоторых микроорганизмов.
Большие запасы метана сосредоточены в метаногидратах на дне морей и в зоне вечной мерзлоты.
Метан также был обнаружен на других планетах, включая Марс, что имеет значение для исследований в области астробиологии. По современным данным, в атмосферах планет-гигантов солнечной системы в заметных концентрациях содержится метан.
Предположительно, на поверхности Титана в условиях низких температур (−180 °C) существуют целые озера, и реки из жидкой метано-этановой смеси. Велика доля метановых льдов и на поверхности Седны.
Получение:

Химические свойства:
Метан - первый член гомологического ряда насыщенных углеводородов (алканов), наиболее устойчив к химическим воздействиям.
Подобно другим алканам вступает в реакции радикального замещения - галогенирования, сульфохлорирования, сульфоокисления, нитрования и других, но обладает меньшей реакционной способностью по сравнению с другими алканами.
Для метана специфична реакция с парами воды, в которой в промышленности применяется в качестве катализатора никель, нанесённый на оксиде алюминия (Ni/Al2O3) при 800-900 °C или без катализатора при 1400-1600 °C.
Образующийся в результате реакции синтез-газ может быть использован для последующих синтезов метанола, углеводородов, уксусной кислоты, ацетальдегида и других продуктов.
Применение метана:
Метан используется в качестве топлива для печей, водонагревателей, автомобилей, турбин и др. Для хранения метана используется активированный уголь.
Жидкий метан в сочетании с жидким кислородом также используется в качестве ракетного топлива, например в двигателях BE-4 и Raptor.
Как основной компонент природного газа, метан важен для производства электроэнергии, сжигая его в качестве топлива в газовой турбине или парогенераторе. По сравнению с другими видами углеводородного топлива метан производит меньше углекислого газа на каждую единицу выделенного тепла.
При температуре около 891 кДж/моль теплота сгорания метана ниже, чем у любого другого углеводорода. Тем не менее, он производит больше тепла на массу (55,7 кДж/г), чем любая другая органическая молекула из-за его относительно большого содержания водорода, что составляет 55 % теплоты сгорания, но отдаёт только 25 % молекулярной массы метана. Во многих городах метан подаётся в дома для отопления и приготовления пищи.
В этом контексте его обычно называют природным газом, содержание энергии в котором составляет 39 мегаджоулей на кубический метр. Сжиженный природный газ (СПГ) представляет собой преимущественно метан (CH4), превращаемый в жидкую форму для удобства хранения или транспортировки.
Рафинированный жидкий метан используется в качестве ракетного топлива. Метан, как сообщается, имеет преимущество перед керосином в том, что он наносит меньше углерода на внутренние части ракетных двигателей, что уменьшает сложность повторного использования ускорителей.
Метан используется в качестве сырья в органическом синтезе, в том числе для изготовления метанола.
4. Просмотрите видео - ролики проведённых экспериментов и запишите ход экспериментов, наблюдение при проведении опыта, уравнение химической реакции.
Опыт № 1. Получение метана и его горение.
Для просмотра видео эксперимента перейдите по ссылке:
https://www.youtube.com/watch?v=QZ1VwuzSwZs
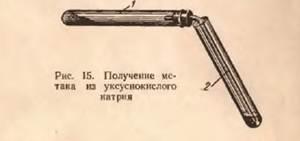
В сухую пробирку 1, снабженную пробкой с газоотводной трубкой (рис. 15), помещают смесь из обезвоженного уксуснокислого натрия и натронной извести (смеси едкого натра и оксида кальция в отношении 1:2 для предотвращения разрушения стекла щелочью) (высота слоя 6 -10 мм). Затем укрепляют пробирку горизонтально и нагревают смесь в пламени горелки.
При нагревании натриевой соли уксусной кислоты с натронной известью происходит расщепление соли с образованием метана.
Наблюдение:….
Уравнение реакции:…
Опыт № 2. Отношение метана к бромной воде и перманганату калия.
Для просмотра видео эксперимента перейдите по ссылке:
https://www.youtube.com/watch?v=0mBWErqZueg
В пробирку 2 помещают 5 капель раствора перманганата калия и в пробирку 3 - 5 капель бромной воды.
Не прекращая нагревания смеси в пробирке 1, вводят поочередно конец газоотводной трубки в пробирки 2 и 3.
Наблюдение:….
Уравнение реакции:…
5. Сделайте вывод о ходе практической работы, запишите его.



























