
ФГБОУ ВО «Бурятский государственный университет»
Кафедра неорганической и органической химии
Шадрина Олеся Андреевна
ПОЛУЧЕНИЕ ЖЕЛЕЗОСОДЕРЖАЩИХ АЛЮМОСИЛИКАТОВ МЕТОДОМ ИНТЕРКАЛИРОВАНИЯ И ИЗУЧЕНИЕ ИХ КАТАЛИТИЧЕСКИХ СВОЙСТВ
Научный руководитель:
д.х.н., доцент Ханхасаева С.Ц.
Улан-Удэ
2018 г.
СУЛЬФАНИЛАМИДНЫЕ ПРЕПАРАТЫ
ЖИВОТНОВОДСТВО
РАСТЕНИЕВОДСТВО
Использование антибиотиков
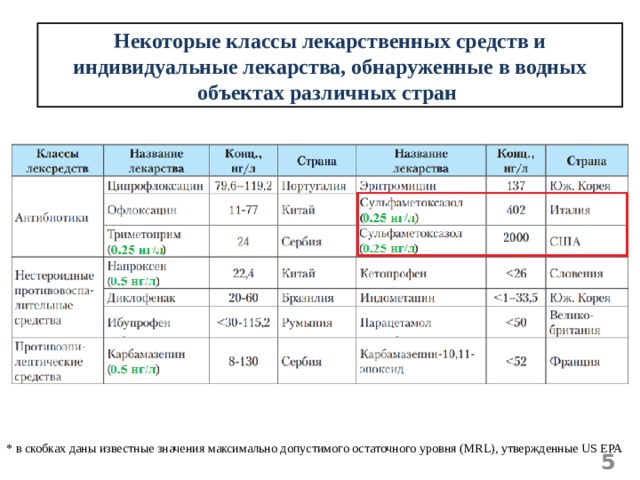
Некоторые классы лекарственных средств и индивидуальные лекарства, обнаруженные в водных объектах различных стран
* в скобках даны известные значения максимально допустимого остаточного уровня (MRL), утвержденные US EPA
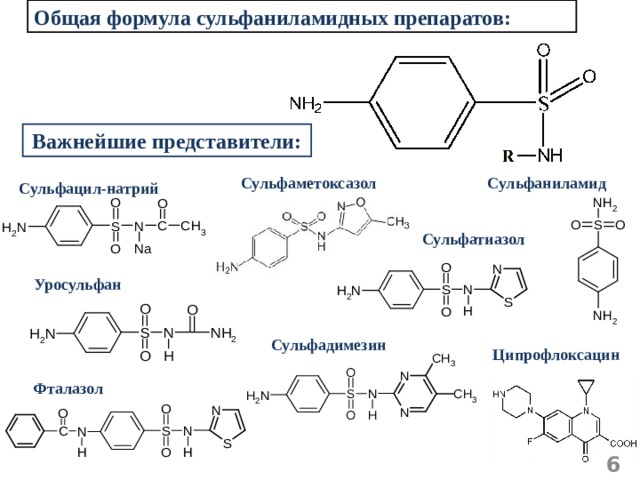
Общая формула сульфаниламидных препаратов:
Важнейшие представители:
Сульфаметоксазол
Сульфаниламид
Сульфацил-натрий
Сульфатиазол
Уросульфан
Сульфадимезин
Ципрофлоксацин
Фталазол
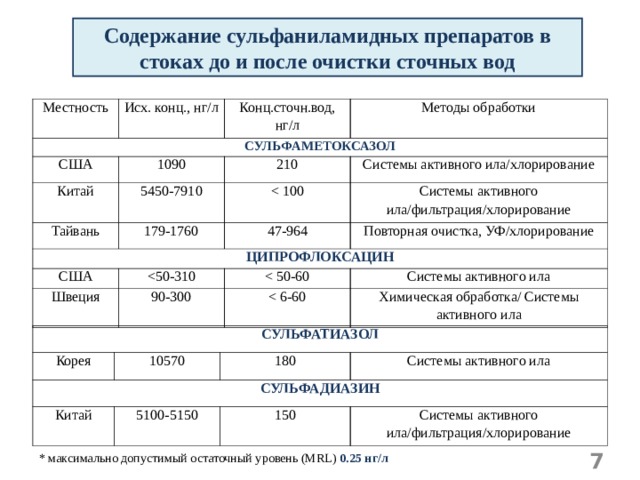
Содержание сульфаниламидных препаратов в стоках до и после очистки сточных вод
Местность
Исх. конц., нг/л
СУЛЬФАМЕТОКСАЗОЛ
Конц.сточн.вод, нг/л
США
Методы обработки
1090
Китай
210
5450-7910
Тайвань
ЦИПРОФЛОКСАЦИН
179-1760
Системы активного ила/хлорирование
Системы активного ила/фильтрация/хлорирование
47-964
США
Повторная очистка, УФ/хлорирование
Швеция
90-300
Системы активного ила
Химическая обработка/ Системы активного ила
СУЛЬФАТИАЗОЛ
Корея
СУЛЬФАДИАЗИН
10570
Китай
180
Системы активного ила
5100-5150
150
Системы активного ила/фильтрация/хлорирование
* максимально допустимый остаточный уровень (MRL) 0.25 нг/л
Advanced Oxidation Processes
(AOP)

Цель : получение железосодержащих алюмосиликатов методом интеркалирования и изучение их каталитических свойств.
Задачи :
- Получить железосодержащие материалы из природного слоистого алюмосиликата – монтмориллонита и полиоксокомплексов железа.
- Определить текстурные характеристики и содержание железа в материалах.
- Изучить кинетику окисления п -аминобензолсульфаниламида (СА) в системе « H 2 O 2 / Fe -монтмориллонит/УФ».
- Исследовать влияние физико-химических параметров (загрузка катализатора, начальные концентрации ПВ и СА, рН) на эффективность окисления СА.
- Исследовать состав промежуточных продуктов окисления СА.
- Определить изменение общего органического углерода (TOC) при фотоокислительной деструкции СА.
- Изучить токсичность растворов СА методом биоиндикации сточных вод.
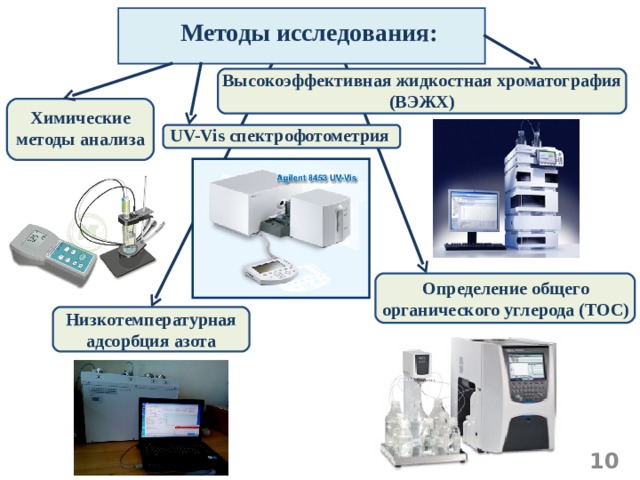
Методы исследования:
Высокоэффективная жидкостная хроматография (ВЭЖХ)
Химические методы анализа
UV-Vis спектрофотометрия
Определение общего органического углерода (ТОС)
Низкотемпературная адсорбция азота
10
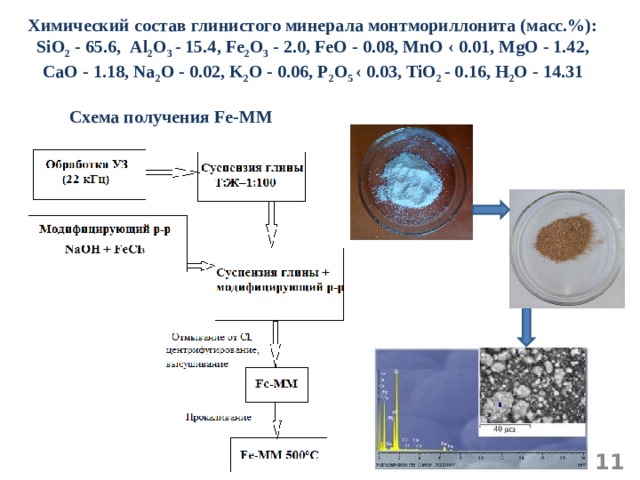
Химический состав глинистого минерала монтмориллонита (масс.%): SiO 2 - 65.6, Al 2 O 3 - 15.4, Fe 2 O 3 - 2.0, FeO - 0.08, MnO ‹ 0.01, MgO - 1.42, CaO - 1.18, Na 2 O - 0.02, K 2 O - 0.06, P 2 O 5 ‹ 0.03, TiO 2 - 0.16, Н 2 О - 14.31
Схема получения Fe -М М
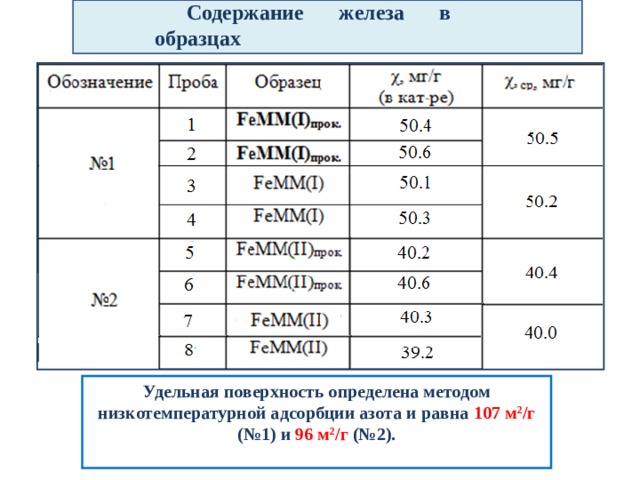
Содержание железа в образцах
Удельная поверхность определена методом низкотемпературной адсорбции азота и равна 107 м 2 /г (№1) и 96 м 2 /г (№2).
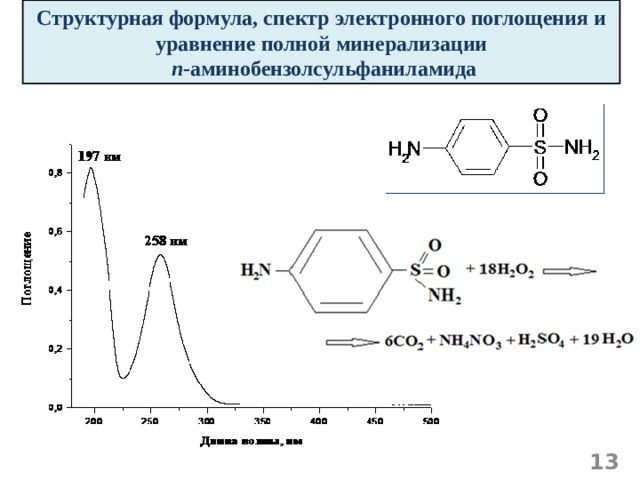
Структурная формула, спектр электронного поглощения и уравнение полной минерализации
п -аминобензолсульфаниламида
![Тестирование каталитических свойств FeMM № 1 и FeMM № 2 Схема фотокаталитического реактора Условия окисления: [ СА ] = 30-110 мг/л, рН 4.0-6.0, [ ПВ ] = 2.6-15.7 мМ, содержание FeMM 0.5-2.0 г/л, 20 0 С К СА = (С 0 -С)/С 0](https://fsd.multiurok.ru/html/2020/10/29/s_5f9a57c525235/img13.jpg)
Тестирование каталитических свойств FeMM № 1 и FeMM № 2
Схема фотокаталитического реактора
Условия окисления:
[ СА ] = 30-110 мг/л, рН 4.0-6.0, [ ПВ ] = 2.6-15.7 мМ, содержание FeMM 0.5-2.0 г/л, 20 0 С
К СА = (С 0 -С)/С 0
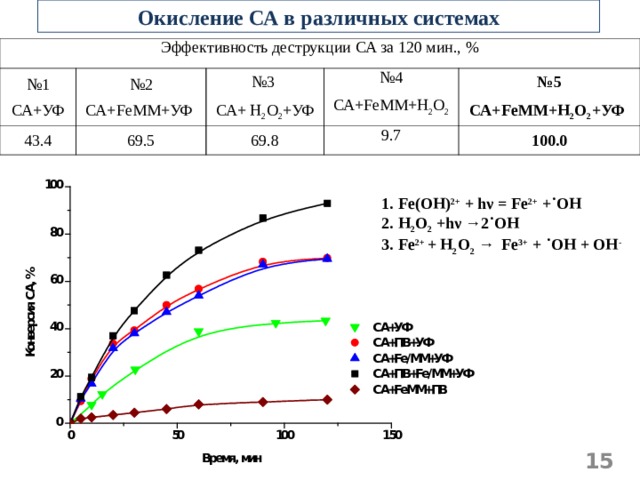
Окисление СА в различных системах
Эффективность деструкции СА за 120 мин., %
№ 1 СА+УФ
43.4
№ 2 СА+ FeMM +УФ
№ 3
СА+ H 2 O 2 +УФ
69.5
69.8
№ 4 СА+ FeMM + H 2 O 2
№ 5 СА+ FeMM + H 2 O 2 +УФ
9.7
100.0
1. Fe ( OH ) 2+ + h ν = Fe 2+ +˙ OH
2. H 2 O 2 +h ν →2˙OH
3. Fe 2+ + H 2 O 2 → Fe 3+ + ˙OH + OH -
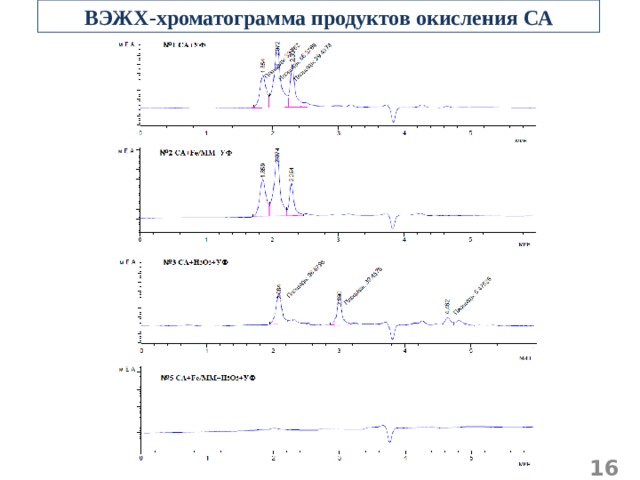
ВЭЖХ-хроматограмма продуктов окисления СА
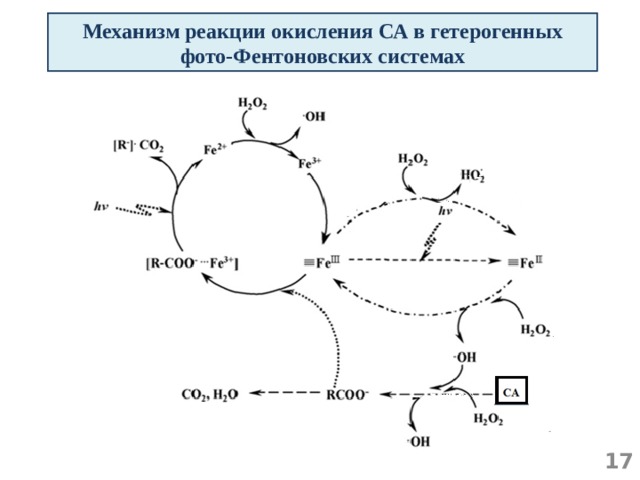
Механизм реакции окисления СА в гетерогенных фото-Фентоновских системах
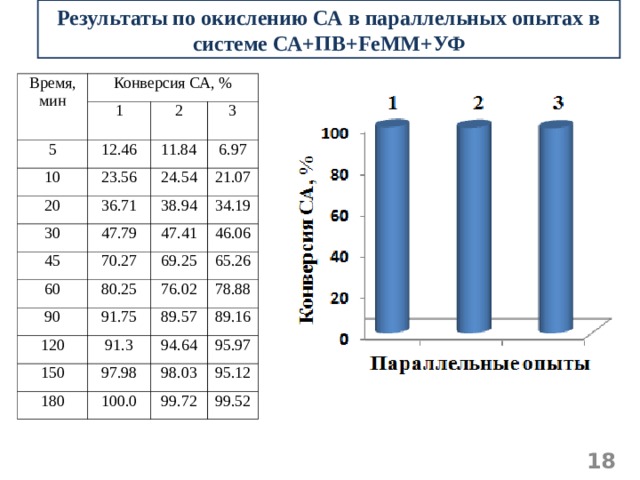
Результаты по окислению СА в параллельных опытах в системе СА+ПВ+ FeMM +УФ
Время, мин
Конверсия СА, %
5
1
12.46
10
2
3
11.84
23.56
20
6.97
24.54
36.71
30
21.07
38.94
47.79
45
34.19
47.41
60
70.27
46.06
69.25
80.25
90
120
65.26
76.02
91.75
150
91.3
89.57
78.88
89.16
94.64
97.98
180
95.97
98.03
100.0
95.12
99.72
99.52
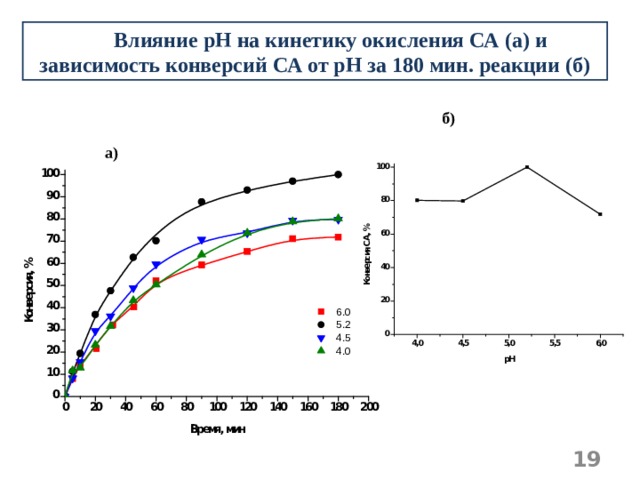
Влияние рН на кинетику окисления СА (а) и зависимость конверсий СА от рН за 180 мин. реакции (б)
б)
а)
![Влияние начальных концентраций ПВ на конверсию СА Влияние мольных соотношений [ ПВ ] / [ СА ] на конверсию СА 1. Fe 2+ + Н 2 О 2 → Fe 3+ + ОНˉ + ОН˙ 2. Н 2 О 2 + НО˙ → HO 2 ˙ + Н 2 О 3. HO 2 ˙+ НО˙ → Н 2 О+О 2](https://fsd.multiurok.ru/html/2020/10/29/s_5f9a57c525235/img19.jpg)
Влияние начальных концентраций ПВ на конверсию СА
Влияние мольных соотношений [ ПВ ] / [ СА ] на конверсию СА
1. Fe 2+ + Н 2 О 2 → Fe 3+ + ОНˉ + ОН˙
2. Н 2 О 2 + НО˙ → HO 2 ˙ + Н 2 О
3. HO 2 ˙+ НО˙ → Н 2 О+О 2
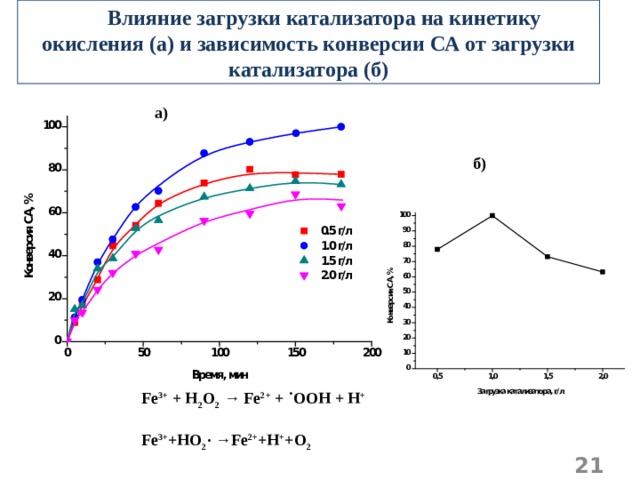
Влияние загрузки катализатора на кинетику окисления (а) и зависимость конверсии СА от загрузки катализатора (б)
а)
б)
Fe 3+ + H 2 O 2 → Fe 2+ + ˙OOH + H +
Fe 3+ +HO 2 ∙ →Fe 2+ +H + +O 2
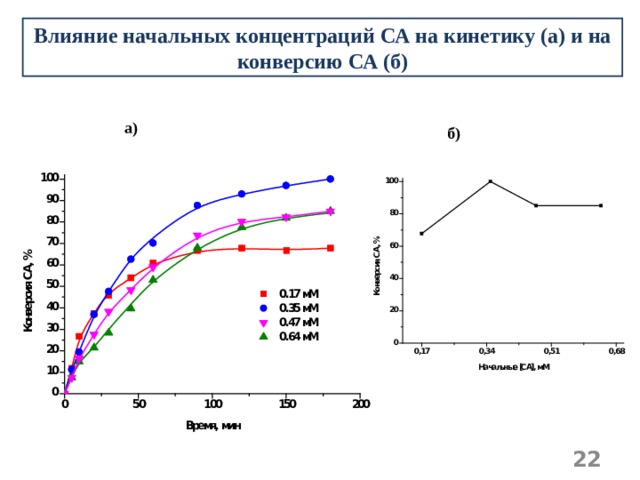
Влияние начальных концентраций СА на кинетику (а) и на конверсию СА (б)
а)
б)
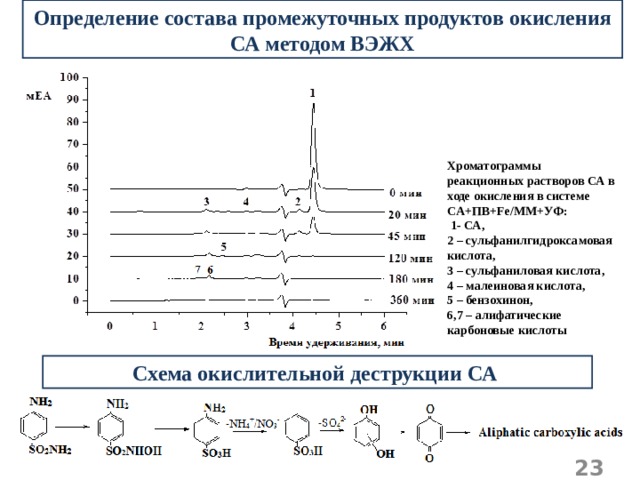
Определение состава промежуточных продуктов окисления СА методом ВЭЖХ
Хроматограммы реакционных растворов СА в ходе окисления в системе СА+ПВ+ Fe / MM +УФ:
1- СА,
2 – сульфанилгидроксамовая кислота,
3 – сульфаниловая кислота,
4 – малеиновая кислота,
5 – бензохинон,
6,7 – алифатические карбоновые кислоты
Схема окислительной деструкции СА
![Оптимальные условия фотоокислительной деструкции СА (20 0 С, λ =254 нм, интенсивность излучения 5 .0*10 -7 Эйнштейн*мин -1 ): [ СА ] = 0.35 мМ [ ПВ ] = 5.2 мМ [ ПВ ] / [ СА ] = 18 моль/моль рН 5.2 содержание FeMM 1.0 г/л](https://fsd.multiurok.ru/html/2020/10/29/s_5f9a57c525235/img23.jpg)
Оптимальные условия фотоокислительной деструкции СА (20 0 С, λ =254 нм, интенсивность излучения 5 .0*10 -7 Эйнштейн*мин -1 ):
[ СА ] = 0.35 мМ
[ ПВ ] = 5.2 мМ
[ ПВ ] / [ СА ] = 18 моль/моль
рН 5.2
содержание FeMM 1.0 г/л
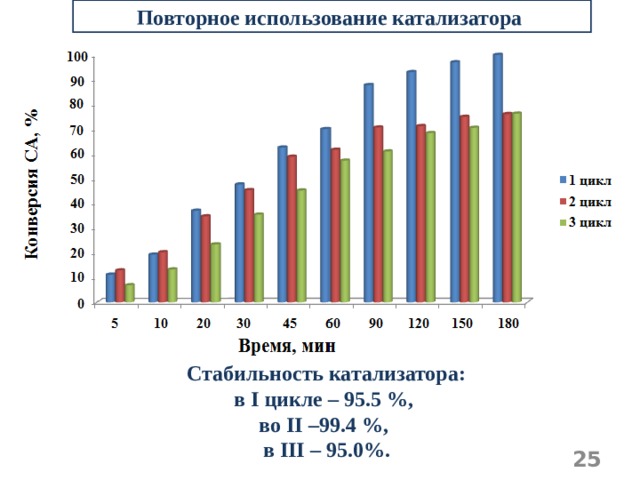
Повторное использование катализатора
Стабильность катализатора:
в I цикле – 95.5 %,
во II –99.4 %,
в III – 95.0%.
![Результаты актинометрических измерений Химический актинометр K 3 [ Fe ( C 2 O 4 ) 3 ]*3 H 2 O . Под действием света протекает реакция: 2[ Fe ( C 2 O 4 ) 3 ] -3 + hν → 2 Fe 2+ + 5 C 2 O 4 2- +2 CO 2 Проба D (акт.) Холостая 0.08 2 N Fe 2+ , моль 0.27 I , Эйнштейн*мин -1 1.8*10 -6 3 6.0*10 -6 ΔC t , моль / л - 0.29 ΔN t , моль 4.8*10 -7 - 6.5*10 6 4.02*10 -6 - 5.2*10 -7 Ф, моль / Эйнштейн 1.61*10 -7 - 4.16*10 -6 0.062 1.66*10 -7 N Fe 2+ =10 -3 · V 1 · V 3 · D / V 2 · l · ε Интенсивность: I =10 -3 · V 1 · V 3 · D / V 2 · l ·Ф ε · t Квантовый выход фотодеструкции СА: Ф= ∆N t /( I · t ) ∆ C t – изменение концентрации СА Денисов Е. Т. Кинетика гомогенных химических реакций / Е. Т. Денисов // Москва: Высшая школа. 1988. 391 с.](https://fsd.multiurok.ru/html/2020/10/29/s_5f9a57c525235/img25.jpg)
Результаты актинометрических измерений
Химический актинометр K 3 [ Fe ( C 2 O 4 ) 3 ]*3 H 2 O .
Под действием света протекает реакция:
2[ Fe ( C 2 O 4 ) 3 ] -3 + hν → 2 Fe 2+ + 5 C 2 O 4 2- +2 CO 2
Проба
D (акт.)
Холостая
0.08
2
N Fe 2+ , моль
0.27
I , Эйнштейн*мин -1
1.8*10 -6
3
6.0*10 -6
ΔC t , моль / л
-
0.29
ΔN t , моль
4.8*10 -7
-
6.5*10 6
4.02*10 -6
-
5.2*10 -7
Ф, моль /
Эйнштейн
1.61*10 -7
-
4.16*10 -6
0.062
1.66*10 -7
N Fe 2+ =10 -3 · V 1 · V 3 · D / V 2 · l · ε
Интенсивность: I =10 -3 · V 1 · V 3 · D / V 2 · l ·Ф ε · t
Квантовый выход фотодеструкции СА: Ф= ∆N t /( I · t )
∆ C t – изменение концентрации СА
Денисов Е. Т. Кинетика гомогенных химических реакций / Е. Т. Денисов // Москва: Высшая школа. 1988. 391 с.
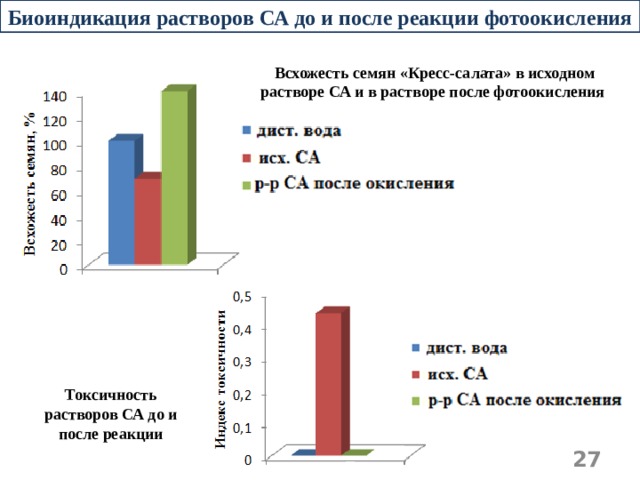
Биоиндикация растворов СА до и после реакции фотоокисления
Всхожесть семян «Кресс-салата» в исходном растворе СА и в растворе после фотоокисления
Токсичность растворов СА до и после реакции
ВЫВОДЫ:
- Синтезированы два образца железосодержащего материала из природного слоистого алюмосиликата – монтмориллонита с содержанием железа 40.2 мг/г и 50.3 мг/г, с удельной поверхностью 107 м 2 /г и 96 м 2 /г.
- Показано, что из полученных материалов FeMМ №1 является более активным катализатором в фотоокислении растворов СА в системе « H 2 O 2 / Fe -монтмориллонит/УФ».
- Установлены закономерности влияния рН, начальных концентраций [ H 2 O 2 ] и [СА], содержания катализатора FeMМ №1 на кинетику фотоокисления СА, и установлены оптимальные значения этих физико-химических параметров, позволяющие добиться высокой эффективности окисления СА.
- Изучен состав промежуточных продуктов фотоокислительной деструкции СА методом ВЭЖХ. Установлено, что промежуточными продуктами фотоокисления СА являются сульфаниловая кислота, сульфанилгидроксамовая кислота, бензохинон и алифатические кислоты, которые полностью окисляются до CO 2 , H 2 O , NH 4 NO 3 , H 2 SO 4 .
- Изучена токсичность растворов СА методом биоиндикации с использованием семян Кресс-салата. Показано, что в растворе СА после реакции окисления загрязнение отсутствует.
- Разработана новая гетерогенная фото-Фентоновская окислительная система « H 2 O 2 / Fe -монтмориллонит/УФ», позволяющая осуществить фотоокисление сульфаниламидов до экологически безопасных продуктов.

СПАСИБО ЗА ВНИМАНИЕ !
 0.71 " width="640"
0.71 " width="640"
Индекс токсичности воды: J = ( B к -В о )/В о
где J – индекс токсичности, B к – всхожесть семян в контроле,
В о - всхожесть семян в опытном варианте.
Показатели загрязнения воды
Показатели
Степень загрязнения
Всхожесть, %
Загрязнение отсутствует
Индекс токсичности
Слабое загрязнение
90-100
Среднее загрязнение
65-90
Сильное загрязнение
30-65
0.10-0.35
0.36-0.70
0.71

Условия ВЭЖХ-анализа проб реакционных растворов СА:
мобильная фаза – CH 3 CN : H 2 O = 20:80,
длина волны 254 нм,
скорость потока подвижной фазы 0.5 мл/мин,
температура печи 30 0 С,
объем ввода пробы 5 мкл.




















![Тестирование каталитических свойств FeMM № 1 и FeMM № 2 Схема фотокаталитического реактора Условия окисления: [ СА ] = 30-110 мг/л, рН 4.0-6.0, [ ПВ ] = 2.6-15.7 мМ, содержание FeMM 0.5-2.0 г/л, 20 0 С К СА = (С 0 -С)/С 0](https://fsd.multiurok.ru/html/2020/10/29/s_5f9a57c525235/img13.jpg)





![Влияние начальных концентраций ПВ на конверсию СА Влияние мольных соотношений [ ПВ ] / [ СА ] на конверсию СА 1. Fe 2+ + Н 2 О 2 → Fe 3+ + ОНˉ + ОН˙ 2. Н 2 О 2 + НО˙ → HO 2 ˙ + Н 2 О 3. HO 2 ˙+ НО˙ → Н 2 О+О 2](https://fsd.multiurok.ru/html/2020/10/29/s_5f9a57c525235/img19.jpg)



![Оптимальные условия фотоокислительной деструкции СА (20 0 С, λ =254 нм, интенсивность излучения 5 .0*10 -7 Эйнштейн*мин -1 ): [ СА ] = 0.35 мМ [ ПВ ] = 5.2 мМ [ ПВ ] / [ СА ] = 18 моль/моль рН 5.2 содержание FeMM 1.0 г/л](https://fsd.multiurok.ru/html/2020/10/29/s_5f9a57c525235/img23.jpg)

![Результаты актинометрических измерений Химический актинометр K 3 [ Fe ( C 2 O 4 ) 3 ]*3 H 2 O . Под действием света протекает реакция: 2[ Fe ( C 2 O 4 ) 3 ] -3 + hν → 2 Fe 2+ + 5 C 2 O 4 2- +2 CO 2 Проба D (акт.) Холостая 0.08 2 N Fe 2+ , моль 0.27 I , Эйнштейн*мин -1 1.8*10 -6 3 6.0*10 -6 ΔC t , моль / л - 0.29 ΔN t , моль 4.8*10 -7 - 6.5*10 6 4.02*10 -6 - 5.2*10 -7 Ф, моль / Эйнштейн 1.61*10 -7 - 4.16*10 -6 0.062 1.66*10 -7 N Fe 2+ =10 -3 · V 1 · V 3 · D / V 2 · l · ε Интенсивность: I =10 -3 · V 1 · V 3 · D / V 2 · l ·Ф ε · t Квантовый выход фотодеструкции СА: Ф= ∆N t /( I · t ) ∆ C t – изменение концентрации СА Денисов Е. Т. Кинетика гомогенных химических реакций / Е. Т. Денисов // Москва: Высшая школа. 1988. 391 с.](https://fsd.multiurok.ru/html/2020/10/29/s_5f9a57c525235/img25.jpg)


 0.71 " width="640"
0.71 " width="640"



















