МКОУ «Кужникская СОШ»
Теория и практика ЕГЭ по теме
«Строение вещества»
Автор: учитель химии и биологии
Махмудов Абдулла Махмудович
2023 г.
ХИМИЧЕСКАЯ СВЯЗЬ.
Химическая связь - это взаимодействие атомов, обуславливающее устойчивость молекулы или кристалла как целого. Химическую связь можно представить как электронно-ядерные взаимодействия между различными атомами.
Основные виды химической связи.
| Ковалентная образуется за счет общих электронных пар
| Ионная, за счет электростатического притяжения между ионами | Металлическая, между атом-ионами и общими электронами |
| неполярная | Полярная
|
| 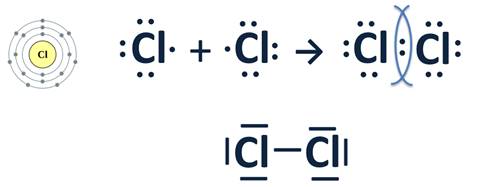
Между одинаковыми атомами, ЭО не различается | 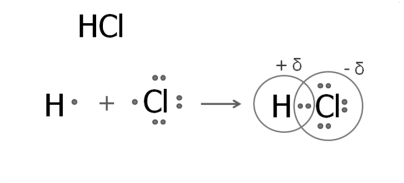
Между различными атомами. Происходит оттягивание электронной пары в сторону более электроотрицательного атома. |

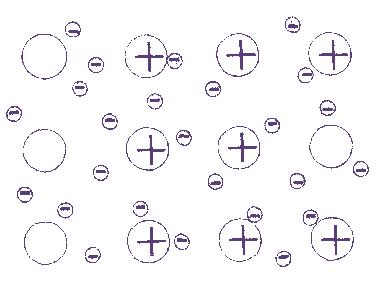
Электрон полностью переходит от одного атома к другому, образуются ионы
| 
|
| 
| 
Образуется полярная* молекула - диполь, где более электроотрицательный атом хлора заряжен отрицательно, а водорода – положительно *Слово «полярная» исходит из слова «полюс», полюса + и - | 
|
| Простые вещества: H2, Br2, O2, Cl2 N2, I2, F2, O3 P4, S8, Cn, Sin и др. А также в сложных веществах между симметрично расположенными атомами: -О-О- -S-S- и т. д.
| Между разными неметаллами: HCl, H2O NO2, SO3 CH4, SF6 H2SO4 HCOOH Между металлами и неметаллами, если значение ЭО различается слабо: FeS, ZnS Fe2O3 и др. | а) между щелочным и щелочно-земельным металлом и неметаллом: Na2O LiH Ca3N2 и т. д. б) между металлом и галогеном KBr, FeCl3, ZnI2 и т. д. в) между ионами в солях и щелочах |
В металлах и сплавах |
Механизмы образования ковалентной связи.
| Обменный | Донорно-акцепторный (в комплексных соединениях) |
|
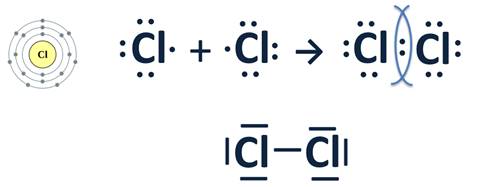
| 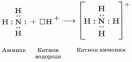
атом азота – донор электронной пары ион водорода – акцептор электронной пары
|
Примеры образования связи по донорно-акцепторному механизму:
– в молекуле угарного газа CO одна связь образована по донорно-акцепторному механизму: C≡O;
– в ионе аммония NH4+ , фосфония РH4+ и в ионах органических аминов CH3-NH2+;
– в комплексных соединениях, между центральным атомом и группами лигандов, например, в тетрагидроксоцинкате натрия Na2[Zn(OH)4] две связи между цинком и гидроксид-ионами; ионы типа AlCl-4, BF-4 и др.
– в азотной кислоте и ее солях — нитратах: HNO3, КNO3, в некоторых других соединениях азота: NO2, N2O5…
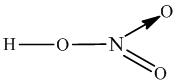
– в молекуле озона O3.
Кратность химической связи - число общих электронных пар, образующих связь между двумя атомами. Чем выше кратность связи, тем она прочнее.
| Одинарные | H―H |
| Двойные | O = O |
| Тройные | 
|
Необходимо уметь составлять структурные формулы простых веществ и соединений.
Полярность связи обусловлена разницей в электроотрицательности атомов. Чем разница ЭО элементов выше, тем больше и полярность молекулы.
| 
|

|
|
| ―→ ―→ ―→ Полярность связи возрастает (возрастает разница в зарядах).
| Данные молекулы образованы ковалентной полярной связью, но в целом они неполярные, так как симметрично расположенные связи компенсируют друг друга. |
|
Длина связи зависит от радиуса атомов, чем он больше, тем длиннее связь. | HF
| 
|
| HCl
| 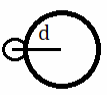
|
| HBr
| 
|
| HI
| 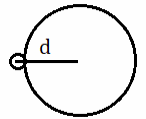
|
Прочность химической связи больше при меньшей длине связи, меньшей полярности и большей кратности связи.
Можно привести бесконечное число примеров с разными видами связи. Необходимо уметь составлять структурные формулы веществ и уметь анализировать.
- Соли и щелочи. Между атомами внутри сложного иона связь ковалентная полярная, а между самими ионами - ионная.
| Сульфат бария 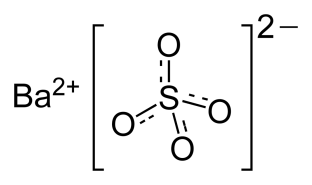
↗ ↖ ионная связь ковалентная полярная связь
| гидроксид натрия Na+ [O―H]- ↗ ↖ ионная связь ковалентная полярная связь
|
| нитрат аммония 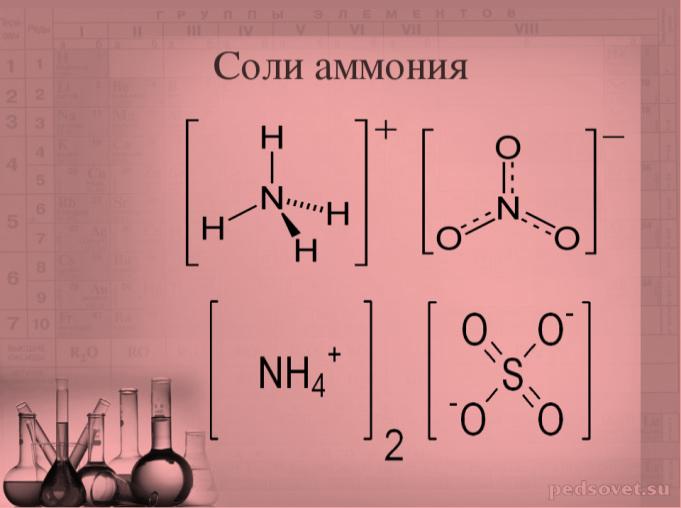
|
|
- Пероксиды и ацетилениды. Ионная и ковалентная неполярная связи.
| Пероксид натрия Na+ [O―O]2- Na+ ↗ ↑ ↖ ионная связь ков. непол. ионная связь
|
 ацетиленид серебра (I) ацетиленид серебра (I)
|
карбид кальция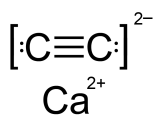
|
|  Пирит Пирит
|
- Пероксид водорода, этилен, ацетилен, бензол. Ковалентная полярная и неполярная
Пероксид водорода
H→O―O←H
↗ ↑ ↖
полярная связь ков. непол. полярная связь
↘ ↓ ↙
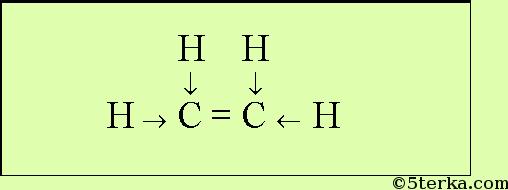
Этилен
Бензол 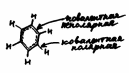
Ковалентная неполяная связь имеется только в случае симметричного расположения атомов и групп относительно химической связи. Например, в молекулах пропана или пропилена нет неполярных связей:
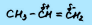
Также в большинстве оксидов отсутствуют неполярные связи. Атомы элемента в оксидах связаны через кислород:
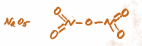
Но как исключение можно привести формулу, здесь одна связь ковалентная неполярная:

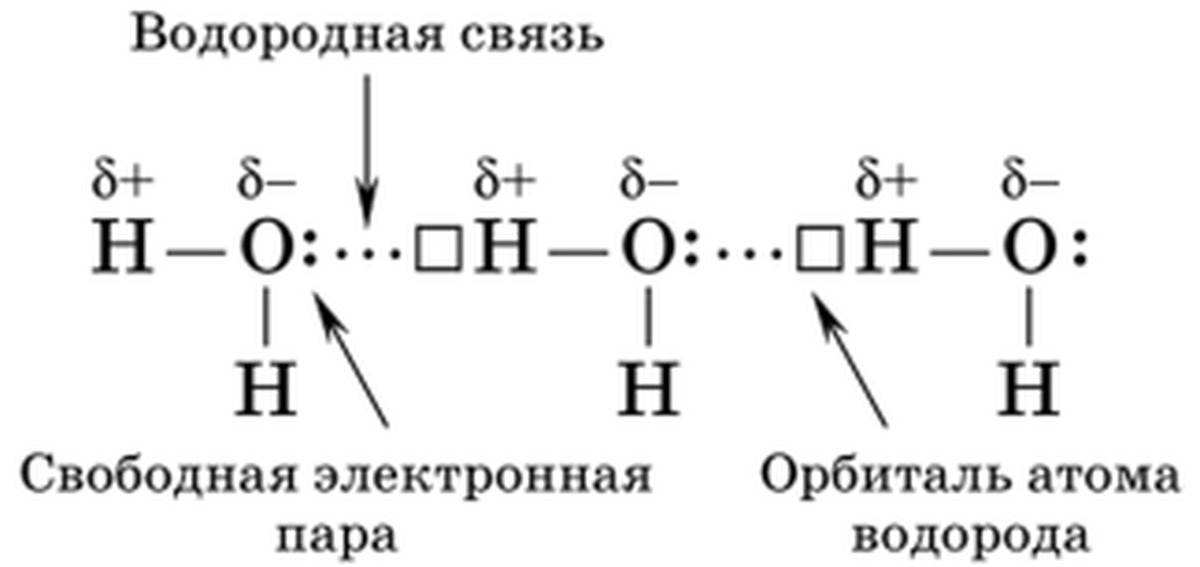
Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильнополярные ковалентные связи — H-F, H-O или H-N.
Водородные связи во много раз слабее, чем обычные ковалентные, но сильнее, чем простые взаимодействия между молекулами.
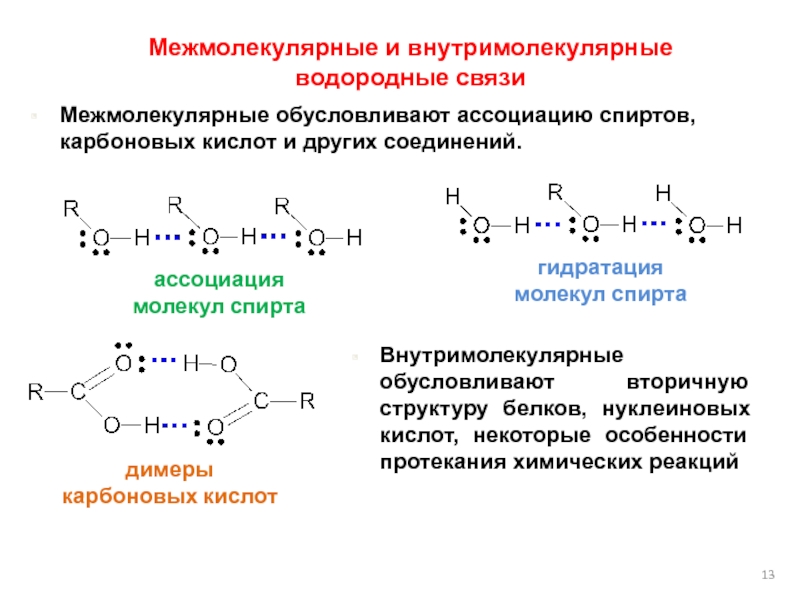
Водородные связи о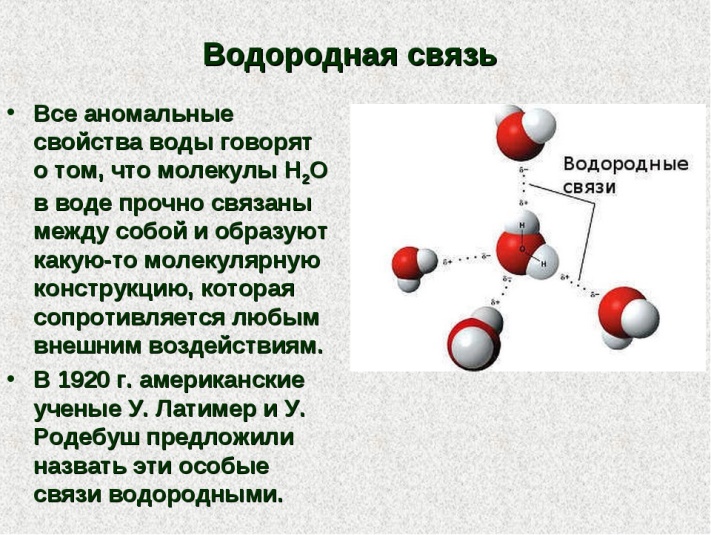 бразуются между молекулами воды, аммиака, фтороводорода, спиртов и фенолов, альдегидов с водой (но не между молекулами альдегидов), кабоновых кислот, внутри белков и нуклеиновых кислот.
бразуются между молекулами воды, аммиака, фтороводорода, спиртов и фенолов, альдегидов с водой (но не между молекулами альдегидов), кабоновых кислот, внутри белков и нуклеиновых кислот.
ТИПЫ СТРОЕНИЯ ВЕЩЕСТВ.
| ВЕЩЕСТВА |
|
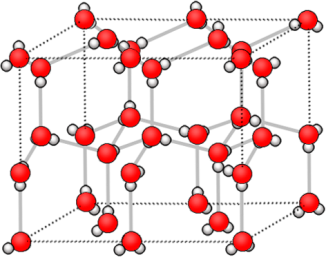
Молекулярные
|
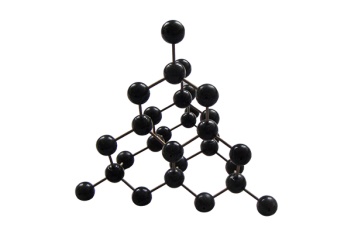
Немолекулярные |
| Имеют постоянный состав | не имеют постоянного состава |
| атомные | ионные | металлические |
| состоят из молекул | состоят из атомов, связанных ковалентными связями | состоят из ионов | состоят из атом-ионов, связанных общими электронами |
| 
| 
| 
| 
|
| Имеют низкие tпл, жидкости, газы, хрупкие твердые вещества из-за того, что молекулы между собой связаны слабыми взаимодействиями. | Твердые, тугоплавкие вещества. Часто алмазоподобные. Атомы в кристалле связаны прочными ковалентными связями. | Твердые, чаще всего тугоплавкие, растворимые в воде. | Обладают металли-ческим блеском, электро- и теплопроводностью. |
| 1. Простые вещества с ковалентной неполярной связью: H2, Br2 O2, Cl2 N2, I2 F2, O3 P4, S8, С60 2. Сложные вещества с ковалентной полярной связью: -большинство органических соединений (за исключением солей) CH3OH, C2H4 и т. д. - кислоты, -оксиды, H2O, NO2, SO3, P2O5 и т. д. -летучие водородные соединения: HCl, NH3, PH3 и т. д. -и др. SF6, CS2, PCl3, H2O2, N2H4 …
|
1.Простые вещества с ковалентной неполярной связью: С – алмаз и графит, Si, Ge, B и т. д.
Графит мягкий из-за слоистого строения
2. Некоторые сложные вещества с ковалентной полярной связью: SiO2 - кремнезем, SiC - карборунд, Al2O3 – корунд Некоторые сульфиды: Al2S3, FeS
Нитрид бора BN Карбид алюминия Al4C3 | Это вещества, в которых присутствует ионная связь:
1.Соли (в том числе органические).
2.Щелочи.
3.Оксиды, нитриды, фосфиды, пероксиды, карбиды, ацетилениды и др. соединения активных металлов. |
Металлы и сплавы |
Какие два из приведенных веществ имеют немолекулярное строение?
Литий
Этанол
Ацетат натрия
Хлор
Хлороводород
Выберите два вещества молекулярного строения.
Cl2O
CaO
Sr(OH)2
C2H2
Au
Выберите два вещества с атомной кристаллической решеткой.
SH4
SiO2
Na2SiO3
Sin
SiF6
В каких двух веществах присутствует ионная связь?
Сульфид свинца
Графит
Оксид азота (II)
Иодид калия
Гидроксид натрия
Выберите два вещества молекулярного строения, в которых содержится ковалентная неполярная связь.
I2
Cl2O
MgCl2
С2H2
Sin
Выберите два вещества молекулярного строения c ковалентной полярной связью.
Кислород
Оксид углерода (IV)
Серная кислота
Оксид кремния (IV)
Магний
Выберите два вещества немолекулярного строения, в которых содержится ковалентная полярная связь.
Хлорид магния
Сульфат натрия
Бромид аммония
Фосфорная кислота
Этилен
Выберите два вещества немолекулярного строения, в которых содержится ковалентная неполярная связь.
Корунд
Карбонат калия
Алмаз
Пероксид натрия
Пероксид водорода
Выберите два вещества, в которых есть химическая связь, образованная по донорно-акцепторному механизму.
H2S
NH4HS
Zn(OH)2
Na[Al(OH)4]
ZnS
Выберите два вещества, в которых есть химическая связь, образованная по донорно-акцепторному механизму.
CH3NH3Br
KF
P2O5
Na2CO3
CO
Выберите два вещества, в которых присутствует двойная связь.
Хлор
Водород
Кислород
Серная кислота
Гидроксид натрия
Выберите два вещества, молекулы которых полярны.
HBr
Br2
CH3Cl
CH4
S8
Укажите два вещества, в которых такая же связь, как и в оксиде калия.
Кремнезем
Фосфин
Едкий натр
Хлорид цинка
Углекислый газ
Какие два, из данных веществ, имеют наиболее низкую температуру плавления?
СаF2
SiO2
Al2O3
SO3
H3PO4
Выберите две молекулы с наибольшей длиной связи.
HBr
HI
HF
H2O
HCl
В каких двух веществах присутствует связь такого же типа, как и в молекулах белого фосфора?
H2O2
I2O5
CaS
H3PO4
I2
Выберите два вещества, имеющие ионные и ковалентные полярные связи.
Оксид железа (III)
Угольная кислота
Нитрат рубидия
Фосфид калия
Хлорид аммония
Выберите два вещества, у которых химическая связь наиболее прочна.
Cl2
N2
O2
I2
Br2
Из предложенного перечня выберите два вещества немолекулярного
строения, имеющие ковалентную полярную связь.
1) гидроксид натрия
2) нитрид калия
3) хлорид бария
4) хлороводород
5) оксид кремния
Из предложенного перечня выберите два вещества, в которых присутствует ковалентная полярная связь.
1) фторид серы(VI)
2) оксид натрия
3) фторид натрия
4) сульфат магния
5) бор
Какие виды химической связи присутствуют в оксалате натрия? Какой тип кристаллической решетки он образует?
Почему, при обычных условиях, вода является жидкостью, а сероводород - газ имея при этом большую молекулярную массу?
Какие виды химической связи присутствуют в гидразине?
Почему сложные эфиры быстрее улетучиваются чем спирты и карбоновые кислоты, из которых они получены, имея при этом более высокую молекулярную массу?
Почему азот как простое вещество является относительно инертным при том, что как химический элемент он является сильным окислителем?
Какие виды химической связи присутствуют молекуле Р4О10?
Какие виды химической связи имеются в циклопентане? Какой тип кристаллической решетки образует твердый циклопентан (toпл. = -94оС)?
Почему СО2 это газ, а SiO2 – твердое алмазоподобное вещество?
Изобразите структурную формулу озона. По какому механизму образованы связи в этой молекуле?
Ответы:
| 1 | 13 | 11 | 34 |
| 2 | 14 | 12 | 13 |
| 3 | 24 | 13 | 34 |
| 4 | 45 | 14 | 45 |
| 5 | 14 | 15 | 12 |
| 6 | 23 | 16 | 15 |
| 7 | 23 | 17 | 35 |
| 8 | 34 | 18 | 23 |
| 9 | 24 | 19 | 15 |
| 10 | 15 | 20 | 14 |
21. Ковалентные полярные, неполярные и ионные. Ионная кристаллическая решетка.
22. Это объясняется наличием водородных связей между молекулами воды, за счет чего и удерживаются.
23. В молекулах гидразина ковалентные полярные и неполярные связи, а между молекулами – водородные.
24. Большая летучесть эфиров, по сравнению со спиртами и карбоновыми кислотами, обусловлена отсутствием между их молекулами водородных связей.
25. Атомы в молекуле азота удерживаются прочной тройной связью, при этом имеющие сравнительно небольшую длину связи.
26. Только ковалентные полярные.
27. Ковалентные полярные, неполярные. Молекулярная кристаллическая решетка.
28. СО2 является молекулярным веществом, а SiO2 имеет атомное строение. Атомы кремния и кислорода в кристаллической решетке диоксиде кремния удерживаются прочными ковалентными связями, образуя как бы одну гигантскую молекулу.
29. Двойная связь между двумя атомами кислорода образуется по обменному механизму, а связь с третьим атомом кислорода – по донорно-акцепторному.










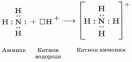





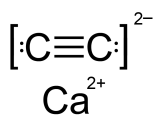
 Пирит
Пирит 

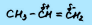
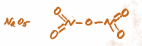

 бразуются между молекулами воды, аммиака, фтороводорода, спиртов и фенолов, альдегидов с водой (но не между молекулами альдегидов), кабоновых кислот, внутри белков и нуклеиновых кислот.
бразуются между молекулами воды, аммиака, фтороводорода, спиртов и фенолов, альдегидов с водой (но не между молекулами альдегидов), кабоновых кислот, внутри белков и нуклеиновых кислот.






















