ПЛАН-КОНСПЕКТ
проблемного урока по химии для учащихся 9 класса
Тема урока: «Гидролиз солей»
Тип урока: урок изучения нового материала.
Вид урока: комбинированный, проблемный.
Форма проведения урока: лабораторный опыт, беседа.
Цель урока:
Способствовать формированию у учащихся понятия «гидролиз», умения писать краткие ионные уравнения реакций гидролиза,
Развивать у учащихся память, наблюдательность, логическое мышление,
Воспитывать у учащихся аккуратность, уважение к окружающим, любовь к предмету.
Оборудование: на столах учащихся: растворы хлорида натрия, сульфата алюминия, карбоната натрия, лакмуса, штатив с пробирками, чистые листочки и карточки для проведения проверочной работы, таблица растворимости, периодическая система.
На столе у учителя: демонстрационный штатив с четырьмя пронумерованными пробирками с растворами хлорида натрия, сульфата алюминия, карбоната натрия, карбоната кальция, вода.
1 этап: постановка учебной проблемы (15 минут)
1. Первому учащемуся (левая часть доски)
-записать на доске окраску индикатора в различных средах
Нейтральная кислая щелочная
Лакмус
Фенолфталеин
Метиловый оранжевый
2. (средняя часть доски)
- на какие ионы диссоциируют следующие вещества? Допишите уравнения реакций.
Второй учащийся третий учащийся четвертый учащийся
H Cl → Na OH→ Na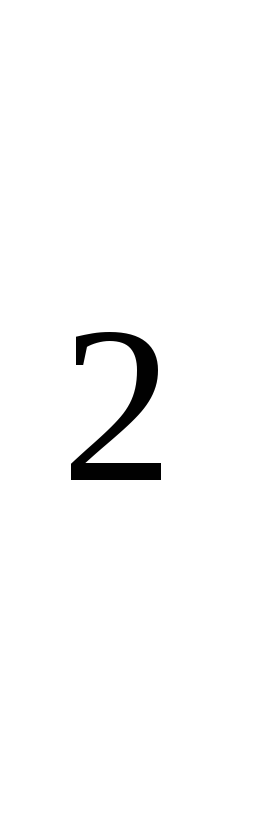 CO
CO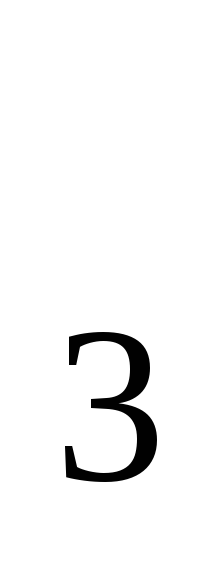 →
→
H NO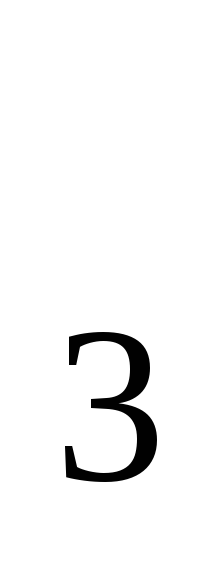 → KOH→ Al
→ KOH→ Al (SO
(SO )3 →
)3 →
H SO→
SO→ Ba(OH)
Ba(OH) →
→ Na Cl →
Na Cl →

3. Третий учащийся (правая часть доски)
Запиши по две формулы веществ сильных электролитов
Кислоты Основания Соли
? ? ?
? ? ?
В это время с классом учитель проводит фронтальный опрос по следующим вопросам:
Какие вещества называются электролитами?
Вещества с какой связью относятся к электролитам?
Какие вещества называются неэлектролитами?
Вещества с какой связью относятся к неэлектролитам?
Разбираем ответы учащихся у доски.
Вопросы первому учащемуся:
-какие вещества называются индикаторами?
Вопросы второму учащемуся:
-дать определение кислотам с точки зрения теории электролитической диссоциации.
-почему все кислоты одинаково изменяют окраску индикаторов?
Вопросы третьему учащемуся:
- дать определение щелочам с точки зрения теории электролитической диссоциации.
-почему все щелочи одинаково изменяют окраску индикаторов?
Вопросы четвертому учащемуся:
- дать определение солям с точки зрения теории электролитической диссоциации.
Вопросы пятому учащемуся:
- какие электролиты называются сильными?
- какие электролиты относятся к слабым?
Постановка проблемы
Вопрос к классу:
- будут ли растворы солей изменять окраску индикаторов? (ПРОБЛЕМА!)
Выдвижение гипотез
Обсуждаем.
Да. Почему?
Нет. Почему?
Учащиеся должны сказать: «Скорее всего, нет, так как нет ионов водорода и нет гидроксид ионов.»
Проверка гипотез
2 этап : лабораторный опыт (4 мин)
Проделаем опыт: (напомнить о ТБ)
Налейте в три пробирки по 2 мл. следующих солей
1пробирка - карбонат натрия
2 пробирка - сульфат алюминия
3 пробирка – хлорид натрия
и прилейте в каждую из них несколько капель лакмуса. Запишите цвет раствора в тетради, определите среду раствора.
Запись в тетради и на доске должна быть следующая:
1 пробирка 2 пробирка 3 пробирка
Na2 CO3 Al2 (SO4)3 NaCl
+ + +
Лакмус лакмус лакмус
Окр. ? ? ?
Среда ? ? ?
Выдвижение новой проблемы.
Вопрос к классу: Почему же соли изменяют окраску индикаторов? (ПРОБЛЕМА)
Подводящий к теме диалог:
Почему соли изменяют окраску индикаторов?
Откуда появляется избыток ионов водорода, избыток гидроксид ионов?
Какое вещество кроме соли находиться в растворе? Или Что является растворителем соли?
Может ли происходить взаимодействие ионов соли и воды?
3 этап Объяснение новой темы. (12 мин)
Называю тему урока и цель.
Записываем в словарь определение гидролиза.
(от греческого «гидро»- вода, «лизис» - разложение).
Объясняем первый случай.
Na 2CO3 → 2 Na+ + CO32 – определяем генезис соли (происхождение)
С. Сл.
С водой всегда взаимодействует ион, вошедший в состав соли из слабого электролита.
CO3 2- + HOH → HCO3- + OH- (краткое ионное уравнение реакции гидролиза по первой ступени) среда щелочная
Записываем вывод в тетрадь: гидролиз солей, образованных сильным основанием и слабой кислотой происходит по аниону, среда щелочная (лакмус окрашивается в синий цвет).
Объясняем второй случай.
2. Al 2 (SO 4)3 → 2Al 3+ + 3SO 2-
Сл. С.
Al3+ + HOH → Al (OH)2+ + H+
Записываем вывод в тетрадь: гидролиз солей, образованных слабым основанием и сильной кислотой происходит по катиону, среда кислая (лакмус окрашивается в красный цвет)
Na Cl → Na+ + Cl-
С. С. Гидролиз не происходит (лакмус фиолетовый).
Ca CO3→ Ca + CO32-
Сл. Сл.
Ca2+ + HOH→ CaOH+ + H+
CO3 2- +HOH → HCO- + OH-
H+ + OH- →HOH
Записываем вывод в тетрадь: гидролиз солей, образованных слабым основанием и слабой кислотой происходит и по катиону, и по аниону, среда нейтральная (лакмус фиолетовый).
4 этап реализация продукта.(3 мин)
Делаем выводы.
Что такое гидролиз? Как происходит гидролиз солей, образованных сильным основанием и слабой кислотой? Как происходит гидролиз солей, образованных слабым основанием и сильной кислотой? Как происходит гидролиз солей образованных сильным основанием и сильной кислотой? Как происходит гидролиз солей, образованных слабым основанием и слабой кислотой? Составляем шпаргалку:
Сл. Силь.- кислая
Сильн. слаб. – щелочная
Сл. Сл. – нейтр.
Сильн. Сильн. - нейтральная
Записываем ДЗ. (записано заранее на левой обратной стороне доски): параграф 6, упр. 8 стр. 20.
Работаем устно. Назовите среду раствора следующих солей (правая обратная сторона доски, записано заранее).
Na NO 3 Fe Cl3 Ba CO3 Na2 S Ca CO3
Выставить оценки, прокомментировать.
Проверочная письменная работа (Обучающая 5 минут).
Задание на листочках у каждого на столе (карточки 25 вариантов)
1 вариант. Написать краткие ионные уравнения гидролиза солей по первой ступени:
хлорид калия, сульфид натрия, нитрат цинка
Собрать листочки. Урок закончен.
4

























