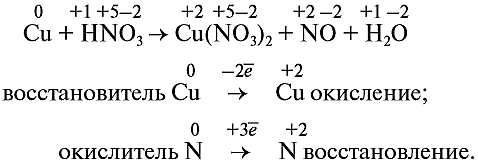Муниципальное бюджетное общеобразовательное учреждение
средняя общеобразовательная школа № 25 имени И.А. Копылова ГОЩ (корпус 2)
141146 Московская область, городской округ Щёлково, п. Фряново, ул. Первомайская, д. 12
тел./факс 8(49656)35735
Методическая разработка урока химии в 8 классе
на тему:
«ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ»

Составитель
Казаринова Марина Сергеевна,
учитель физики
2020 г.
Тип урока: комбинированный урок с использованием презентации.
Педагогические технологии: технология проблемного диалога на этапе изучения нового материала, технология развития мотивации достижений, элементы здоровьесберегающих технологий.
Цель урока:
сформировать представление у учащихся об окислительно-восстановительных процессах, окислителях и восстановителях.
Задачи урока:
Обучающие:
рассмотреть сущность окислительно-восстановительных процессов;
создать условия для самостоятельного решения учебных и познавательных задач (понимания процессов окисления и восстановления, их взаимосвязи);
формировать ключевые компетенции, т.е. универсальные способы деятельности, применимые в различных ситуациях (анализировать, планировать, делать выводы);
закрепить навыки в составлении уравнений окислительно-восстановительных реакций методом электронного баланса.
Развивающие:
совершенствовать умения высказывать суждение о типе химической реакции, анализируя степень окисления атомов в веществах;
продолжить развитие логического мышления, умений наблюдать, делать выводы, работать с алгоритмами, формировать интерес к предмету.
Воспитательные:
формировать потребность в познавательной деятельности и ценностное отношение к знаниям, совершенствовать трудовые навыки;
научить слушать учителя и своих одноклассников, быть внимательным к себе и окружающим, оценивать себя и других, вести беседу;
воспитать культуру общения через работу в парах "ученик - ученик", "учитель - ученик".
Планируемые образовательные результаты:
Предметные - сформировать умение определять окислительно-восстновительные реакции, окислитель, восстановитель, окисление, восстановление, составлять уравнения окислительно-восстановительных реакций, используя метод электронного баланса.
Метапредметные - формирование умения использовать знаково-символические средства для раскрытия сущности процессов «окисления» и «восстановления»; умения создавать обобщения, устанавливать аналогии, осуществлять классификацию, делать выводы.
Личностные - понимание единства естественнонаучной картины мира. Понимание значимости естественнонаучных знаний в повседневной жизни, технике, медицине, для решения практических задач.
Основные понятия, изучаемые на уроке: окислительно-восстановительные реакции, окислитель, восстановитель, окисление, восстановление.
Средства обучения:
компьютерная презентация;
периодическая система Д. И. Менделеева;
таблица растворимости.
Хронологическая карта урока:
Организационный момент – 1 мин.
Актуализация знаний – 9 мин.
Изучение нового материала – 25 мин.
Закрепление полученных знаний – 5 мин.
Выводы – 1 мин.
Рефлексия учебной деятельности – 2 мин.
Домашнее задание – 2 мин.
Ход урока
Организационный момент.
Добрый день, ребята! Как мы с вами уже знаем, в природе постоянно происходят превращения разных веществ, которые можно выразить с помощью химических уравнений. Жизнь на нашей планете невозможна без химических реакций, постоянно происходящих вокруг нас.
Актуализация знаний.
Дыхание у человека – это одна из главных загадок жизни человека, ключ к множеству факторов жизни: здоровью, продолжительности жизни, развитию необычных высоких способностей человека.
Человек может прожить неделю без воды, месяц - без пищи, несколько дней - без сна, но через 5 – 7 минут он умрёт, если не будет дышать.
Дыхание позволяет человеку лучше познать себя, восстанавливать энергетические запасы организма. У человека 100 триллионов клеток и все они должны дышать.
А что использует для дыхания человек? (ответ учеников: - Кислород).
Какую степень окисления почти всегда имеет кислород – (-2).
Что такое степень окисления – (условный заряд элемента, рассчитанный исходя из условий, что все связи в соединении ионные).
А кто является его главным поставщиком кислорода в воздух? – (Растения).
Как называется процесс, протекающий в зеленых частях растений? – (Фотосинтез).
Демонстрация «Горение спички».
Какой процесс мы наблюдаем? – (Горение).
Реакции горения применяются для получения тепла, света, механической энергии. Именно с их помощью ракеты и самолеты поднимаются в космос.
Процессы дыхания, фотосинтеза, горения, брожения, извержения вулканов, грозового разряда, образования перегноя, коррозии металлов и многие другие – все это окислительно-восстановительные реакции.
Как вы считаете, возможно, ли было возникновение жизни на нашей планете без участия окислительно-восстановительных процессов? – (Нет)
Поэтому окислительно-восстановительные реакции требуют к себе особого уважения.
Запишите в тетради тему урока: «Окислительно-восстановительные реакции».
Изучение нового материала.
Сегодня на уроке мы будет рассматривать процессы, в основе которых лежат … (окислительно-восстановительные реакции).
Многообразие классификаций химических реакций по различным признакам (направлению, числу и составу реагирующих и образующих веществ, использованию катализатора, тепловому эффекту) можно дополнить еще одним признаком. Это признак – изменение степени окисления атомов химических элементов, образующих реагирующие вещества. (учебник стр.229)
По этому признаку различают химические реакции
Химические реакции
(запись на доске, ученики в тетрадь)


реакции, протекающие с изменением реакции, протекающие без изменения степени окисления элементов степени окисления элементов
Например, в реакции
+1 +5 -2 +1 -1 +1 -1 +1 +5 -2
 AgNO3 + HCl AgCl + HNO3
AgNO3 + HCl AgCl + HNO3
Степени окисления атомов химических элементов после реакции не изменились.
А вот в другой реакции – взаимодействие соляной кислоты с цинком
+1 -1 0 +2 -1 0
 2HCl + Zn ZnCl2 + H2
2HCl + Zn ZnCl2 + H2
Атомы двух элементов, водорода и цинка, изменили свои степени окисления: водород с +1 на 0, а цинк – с 0 на +2. Следовательно, в этой реакции каждый атом водорода получил по одному электрону, а каждый атом цинка – отдал два электрона.
+1 0
 2H + 2e H2
2H + 2e H2
0 +2
 Zn - 2е Zn
Zn - 2е Zn
Определив степени окисления элементов в уравнении реакции, можно определить, какой атом является окислителем, какой — восстановителем.
Итак, мы должны усвоить основные понятия нашего урока:
Окислительно-восстановительные реакции – это химические реакции, которые протекают с изменением степени окисления атомов химических элементов или ионов, образующих реагирующие вещества.
(Учебник, стр. 230)
Восстановитель — атом или ион, который отдает электрон, а сам окисляется. Его степень окисления при этом понижается.
(Учебник, стр. 230)
Окислитель — атом или ион, который принимает электрон, а сам восстанавливается.
(Учебник, стр. 230)
Восстановление — процесс присоединения электронов, который сопровождается понижением степени окисления.
(Учебник, стр. 231)
Окисление — процесс отдачи электрона, который сопровождается повышением степени окисления.
(Учебник, стр. 231).
Физкультминутка.
Мы на химии писали и немножечко устали,
Мы немножко отдохнем и учиться вновь начнем - (встаем).
Электрон изображаем, путь его мы повторяем,
Как электроны по кругу перемещаются,
Наши головы вращаются - (круговые движения головой).
Пробирку все изображаем, руки вверх мы поднимаем - (руки вверх).
Реакция осуществляется, осадок вниз весь опускается - (руки вниз).
Упражнение повторим, пробирку вновь изобразим - (руки вверх, вниз).
Теперь представим мы весы - (руки в стороны).
Мы взвесить вещество должны – (покачали руками вверх-вниз)
На левую чашку вещество положили - (наклон влево),
На правую разновесы поместили - (наклон вправо).
Покачались, покачались, к равновесию пришли - (встали ровно).
Всё, немножечко размялись – вновь учиться мы должны! – (сели за парты).
А теперь давайте рассмотрим составление уравнений окислительно-восстановительных реакций методом электронного баланса. В основе метода электронного баланса лежит правило: общее число электронов, которые отдаёт восстановитель, всегда равно общему числу электронов, которые присоединяет окислитель.
Среди изученных нами реакций к окислительно-восстановительным реакциям относятся:
1. Взаимодействие металлов с неметаллами
2 Mg + O2 =2 Mg O
![]()

![]() Восстановитель Mg0 - 2e Mg+2 2 окисление
Восстановитель Mg0 - 2e Mg+2 2 окисление
 Окислитель O2 + 4e 2O-2 1 восстановление
Окислитель O2 + 4e 2O-2 1 восстановление
2. Взаимодействие металлов с кислотой
0 +1 +2 0
Mg +H2SO4 = Mg SO4+H2
0 +2
![]()

![]() Восстановитель Mg - 2e Mg 2 окисление
Восстановитель Mg - 2e Mg 2 окисление
 Окислитель 2 H1 + 2e 2 H0 1 восстановление
Окислитель 2 H1 + 2e 2 H0 1 восстановление
3. Взаимодействие металлов с солью
Cu S O4 + Mg =Mg S O4+Cu
![]()

![]() Восстановитель Mg0 -2e Mg+2 2 окисление
Восстановитель Mg0 -2e Mg+2 2 окисление
 Окислитель Cu+2 +2e Cu0 1 восстановление
Окислитель Cu+2 +2e Cu0 1 восстановление
А теперь давайте все вместе разберем пример. Диктуется реакция, один учащийся самостоятельно составляет схему реакции у доски (слайд № 17):
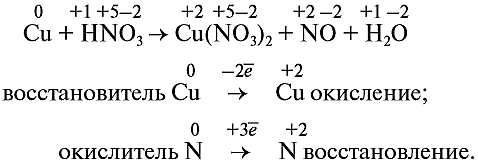
Из этого примера видно, что число электронов, принятых окислителем, может отличаться от числа электронов, отданных восстановителем. Но этого быть не должно(!), так как при этом нарушается закон сохранения материи. Значит, число отданных электронов должно равняться числу принятых электронов. А для этого следует изменить число атомов окислителя и восстановителя, поставив соответствующие коэффициенты. Например, в данном случае:

Эти коэффициенты (3 и 2) означают, что три атома меди отдают шесть электронов, а два атома азота принимают шесть электронов:

Или в краткой форме:

Теперь осуществлён баланс (равенство) электронов, поэтому именно эти коэффициенты из электронного баланса (3 и 2) должны быть в уравнении реакции

Но теперь не осуществляется баланс по азоту! Где же допущена ошибка? Дело в том, что в электронном балансе учитываются только электронные процессы окисления и восстановления, т. е. учитываются только те атомы, которые меняют степени окисления, а часть атомов не изменила ее:

Отсюда правило: коэффициенты электронного баланса ставят только к тем атомам, которые с данной степенью окисления встречаются в химическом уравнении один раз.
Исправим ошибку и уравняем атомы остальных элементов:
Проверим по кислороду:
до реакции: 8 · 3 = 24 атома;
после реакции: 3 · 3 · 2 + 2 + 4 = 24 атома.
Правила расстановки коэффициентов методом электронного баланса
1. Расставить степени окисления.
2. Выписать элементы, изменившие степени окисления, указав число отданных и принятых электронов. Определить окислитель и восстановитель.
3. Поставить дополнительные коэффициенты, уравняв число отданных и принятых электронов.
4. Проверить эти коэффициенты: они должны соответствовать числу атомов данного элемента в молекуле. Например, если дополнительный коэффициент нечётный, а в молекуле чётное число атомов, то оба дополнительных коэффициента удваиваются.
5. Проверенные коэффициенты переносят в уравнение, считая атомы, к тем элементам, которые с данной степенью окисления встречаются в уравнении ОДИН раз.
6. Затем уравнивают атомы:
металлов;
неметаллов;
водорода.
Закрепление полученных знаний.
Выполним еще одно задание на закрепление (работа в парах).
Составьте уравнение электронного баланса, расставьте коэффициенты в уравнении реакции:
HNO3 + H2S = H2SO4 + NO + H2O.
Проверьте друг друга, сравнив результаты с ответами в презентации.
Решение:
HNO3 + H2S = H2SO4 + NO + H2O.
Составим электронные уравнения:
N+5 +3e— = N+2 | 8 окислитель
S-2 — 8e— = S+6 | 3 восстановитель
Сложим два уравнения
8N+5 +3S-2 — = 8N+2 + 3S+6
Подставим коэффициенты в молекулярное уравнение:
8HNO3 +3H2S = 3H2SO4 + 8NO + 4H2O.
Выводы.
Итак, подведем итоги и сделаем выводы:
окислительно-восстановительные реакции – это единство двух противоположных процессов окисления и восстановления;
сутью окислительно-восстановительных реакций является переход электронов от одних атомов, молекул и ионов к другим;
окислительно-восстановительные реакции играют огромную роль во всех жизненных процессах, поэтому очень важно научиться грамотно их составлять.
Рефлексия учебной деятельности.
В конце нашего урока я хочу попросить вас выразить свое мнение, настроение об уроке, выбрав и подняв вверх соответствующий смайлик, (каждому ученику раздаются наборы карточек со смайликами)
Поставьте оценку полученным вами в ходе урока знаниям и, если ваша оценка «5», поднимите руки вверх и скажите: - «Я МОЛОДЕЦ!».
Домашнее задание.
Ребята, запишите домашнее задание (запись на доске).
Параграф 43:
- запишите основные определения урока;
- приведите примеры важнейших восстановителей и окислителей;
- расставьте коэффициенты в уравнениях реакций, укажите восстановитель и окислитель:
а) KNO3 = KNO2 + O2;
б) Mg+ N2 = Mg3N2.
Решение:
а) 2KNO3 = 2KNO2 + O2
N+5 +2e— = N+3 | 2 окислитель
2O-2 -4e— = O20 | 1 восстановитель
2N+5 + 2O-2 = 2N+3 + O20;
б) 3Mg + N2 = Mg3N2
N2 +6e— = 2N-3 | 2 | 1 окислитель
Mg0 -2e— = Mg+2 | 6 | 3 восстановитель
N2 + 3Mg0 = 2N-3 + 3Mg+2.
Используемая литература:
Габриелян О.С. Химия. 8 класс: учеб. для ОУ. – 16-е изд., стереотип. – М.: Дрофа, 2010. – 270 с.
Денисова Л.В., Черногорова Г.М. Химия: Таблица Д.И. Менделеева и справочные материалы: Пособие для уч-ся. – М.: Гуманитар. изд. центр ВЛАДОС, 2004. – 16 с.
Аликберова Л.Ю. Полезная химия: задачи и истории. – М.: Дрофа, 2005. – 187 с.
Хомченко Г.П. Химия для поступающих в ВУЗы: Учеб.пособие. – 2-е изд., испр. – М.: Высш.шк., 1994. – 447 с.
http://zadachi-po-khimii.ru/obshaya-himiya/zadachi-k-razdelu-okislitelno-vosstanovitelnye-reakcii.html
http://lara1972kav.blogspot.com/2012/08/blog-post_21.html
Приложение № 1 (слайд № 24)
Приложение № 2 (слайд № 25)









 AgNO3 + HCl AgCl + HNO3
AgNO3 + HCl AgCl + HNO3  2HCl + Zn ZnCl2 + H2
2HCl + Zn ZnCl2 + H2 
 Окислитель O2 + 4e 2O-2 1 восстановление
Окислитель O2 + 4e 2O-2 1 восстановление 
 Окислитель 2 H1 + 2e 2 H0 1 восстановление
Окислитель 2 H1 + 2e 2 H0 1 восстановление  Окислитель Cu+2 +2e Cu0 1 восстановление
Окислитель Cu+2 +2e Cu0 1 восстановление