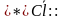План-конспект урока по химии в 8 классе по теме «Степень окисления»
Составитель: Шамилова Иминат Гаджибабаевна, учитель химии МКОУ «Куркентская сош№1 им. Рагимова М.М.»
Цель урока: создание условий для формирования знаний о степени окисления.
Задачи урока:
образовательные - изучить степень окисления элемента как условный заряд атома;
развивающие - научить: составлять формулы бинарных соединений ,определить степени окисления элементов в формуле; сравнивать понятия «степень окисления» и «валентность»;
воспитательные - воспитывать положительное отношение к знаниям.
Планируемые результаты:
предметные - уметь составлять формулы бинарных соединений;
метапредметные - уметь различать понятия «степень окисления» и «валентность», расставляя степени окисления составлять формулы бинарных соединений;
личностные - понимать важность знания степени окисления элементов и применять эти знания на практике.
Тип урока: урок получения новых знаний.
Оборудование: компьютер,проектор,экран, ряд электроотрицательности элементов, периодическая система химических элементов .
Методы и методические приемы:
словесно-наглядный
самостоятельная работа в группах
Этапы урока
1.Актуализация знаний
Ребята, давайте мы с вами вспомним, что нам известно о химических связях.
- Какие виды химической связи нам известны? (ионная, ковалентная. металлическая)
-Ребята, у нас на доске написаны формулы веществ, укажите вид химических связей в них(ученики поочередно называют виды связей в соединениях: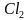 ,
, 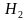 O, СаО, С
O, СаО, С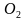 ,
, 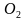 ,Ва,
,Ва, 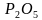 ,
, 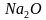 , NН3, С
, NН3, С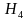 , Са
, Са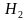 ,LiCl
,LiCl
-Дайте определение ионной связи. (связь, образующаяся между противоположно заряженными ионами)
-Как она образуется?(при взаимодействии атомов типичных металлов и типичных неметаллов) Н/р взаимодействие натрия и хлора 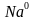 +
+ 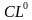 =
= 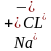
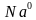 (атом) -1e=
(атом) -1e=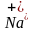 (ион)
(ион)
– натрию легче отдать один электрон, чем получить недостающие.
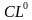 (атом)+1е=
(атом)+1е= 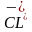 (ион)
(ион)
– хлору, наоборот, легче принять один электрон, чем отдать семь электронов. (схему образования ионной связи в молекуле хлорида натрия ученик показывает на доске) Вывод: атом металла легко отдает свой наиболее отдаленный от ядра электрон атому неметалла, который предоставит ему свободное место на своем внешнем энергетическом уровне. Атом металла приобретет положительный заряд, а атом неметалла- отрицательный.
-Дайте определение ковалентной связи . (связь, образующаяся в результате образования общих электронных пар)
- Что называют электроотрицательностью? (способность атомов химического элемента смещать к себе общие электронные пары, образующие химическую связь)
-На какие типы делится ковалентная связь по электроотрицательности? (полярная, неполярная)
-Как образуется ковалентная полярная связь? Н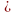 +
+ 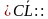 = H (
= H (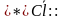
(ученик показывает на доске) и какие два полюса возникают в молекуле (положительный и отрицательный) отсюда вывод: такую связь называют полярной.
-Как же называются число ковалентных связей, которыми атом одного элемента связан с атомами этого же или других элементов? (валентностью)
2.Изучение нового материала.
Учитель предлагает решить проблему: какие заряды получили бы водород и хлор при образовании между ними связи, если представить, что электрон полностью перешел от атома водорода к атому хлора, как и в хлориде натрия? (получили бы заряды +1 и -1)
-Такие условные заряды называют степенью окисления. Можно предположить, что в ковалентных полярных соединениях общие электроны (связующие электроны) полностью переходят к более электроотрицательному атому и потому соединения состоят только из положительно и отрицательно заряженных ионов.
-Давайте ребята, попробуем дать определение степени окисления и продолжим изучать ее.
Запишите тему урока в тетрадь (открывается тема урока на экране)
(учащиеся записывают тему в тетрадях)
На экране появляются формулы веществ . Учащимся предлагается определить : какие атомы в соединениях будут иметь отрицательные значения, какие-положительные (они определяют по электроотрицательности)
В ходе обсуждения учащиеся приходят к выводу, что металлы всегда имеют положительную степень окисления. Нулевую степень окисления имеют атомы в молекулах простых веществ и атомы в свободном состоянии.
Учитель предлагает составлять формулы веществ , зная степени окисления элементов. Аналогично они работали с понятием «валентность», когда выводили формулу ковалентного соединения или определяли валентность элемента по формуле.
Далее учитель предлагает учащимся сравнивать понятия «степень окисления» и «валентность».
Сходство: и валентность, и степень окисления определяется числом внешних электронов
Различие:
а) валентность не имеет знака заряда, а степень окисления имеет;
б) степень окисления может равняться нулю, а валентность нулю равняться не может .
3.Закрепление
Работа по карточкам (групповая)
1.У всех групп одинаковые задания (составление формул бинарных соединений по степеням окисления и наоборот, зная формулу, определить степени окисления элементов) на выполнение дается 5мин.
Оценивание группами по очереди друг друга.
Учитель поясняет задания, помогает группам справиться с работой.
Если определили правильно, то ставим себе 10 баллов(5 -за составление формул, 5 -за определение степеней окисления элементов)
2.Найдите ошибки в предложенных формулах, зная степени окисления кислорода и водорода (индивидуальные карточки-у всех одинаковые) время-4мин. Ответы проверяют сами, ставят баллы (ответы появляются на экране).
Ученики заносят баллы в оценочный лист и выводят общую сумму баллов.
Учитель выводит критерии отметок:
13-14 баллов – «5»
10-12 баллов- «4»
7 -9 баллов «3»
-Поднимите руку, у кого «5». А «4» есть?
Ставятся оценки.
4.Задание на дом: параграф 18 Задания 1,2
5.Рефлексия. Ученики пишут, что понравилось, какие моменты особо запомнились
6.Подведение итогов.
Карточки №1. Составить формулы оксидов магния, натрия, водорода, алюминия, лития.
Карточка №2. Найдите степени окисления элементов в веществах: МпО, ВаН2, СН4,Си2О, МпО2.
Карточка №3. Найдите ошибки в предложенных формулах, зная степени окисления кислорода и водорода: КО КН СаН, НО






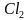 ,
, 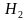 O, СаО, С
O, СаО, С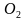 ,
, 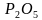 ,
, 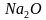 , NН3, С
, NН3, С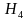 , Са
, Са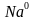 +
+ 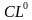 =
= 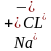
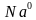 (атом) -1e=
(атом) -1e=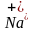 (ион)
(ион)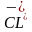 (ион)
(ион) +
+ 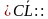 = H (
= H (