Тема. Первый закон термодинамики и применение к различным процессам.
Цель урока. Добиться усвоения учащимися закона сохранения и превращения энергии для тепловых процессов - первого закона термодинамики.
Задачи урока:
1.образовательные: закрепить, обобщить и углубить знания обучающихся об изопроцессах; исследовать первый закон термодинамики для различных процессов(изохорного, изотермического, изобарного, адиабатного);показать всеобщность этого закона, используя межпредметные связи курсов физики, биологии, технологии и познаваемость мира; формировать целостное восприятие мира.
2.воспитательные: формирование активной жизненной позиции и информационной культуры.
3.развивающие: развитие навыков самостоятельной работы, правильной физической речи обучающихся, умение выделять главное, обобщать, анализировать, применять знания на практике.
Оборудование : компьютеры, мультимедийный проектор, диски “ Microsoft Office в школе”, “Открытая физика”, Живая физика, дидактический материал-учебные тематические тесты по физике, учебник физики для 10 класса (Г.Я.Мякишев, Б.Б.Буховцев, Н.Н Сотский), раздаточный материал(Приложение 1),компьютерная презентация, термометры(для каждого ученика),таблицы: “Внутренняя энергия”, “1 закон термодинамики”.
Эпиграф. Немецкий ученый – философ И. Кант сказал так: “Все наше знание начинается с опыта”.
План урока.
1. Организационный момент .
2. Тема, задачи, цели урока. Актуализация знаний
3.Изучение первого закона термодинамики.
а) фронтальный эксперимент;
б) связь между какими величинами выражает данный закон?
в) формулировка закона и математическая запись закона;
г) когда и кто впервые сформулировал данный закон?
д) опыты, подтверждающие справедливость закона;
е) применение первого закона термодинамики к различным процессам.
ё) учёт и использование закона на практике.
5.Закрепление.
1)решение качественных задач.
2) решение расчетных задач
6.Подведение итогов.
7.Домашнее задание 80-81,упр.15, №1-3
Ход урока.
1.Оргмомент.
2. Актуализация знаний.
Мы изучаем основы термодинамики и для того, чтобы приступить к изучению первого закона термодинамики, необходимо полученные знания вспомнить и закрепить. Для этого выполним задание №1.(карточки с задание лежат на партах для каждого ученика).
Задание 1.
Вариант 1.
1.Броуновское движение - это:
А) тепловое движение взвешенных в жидкости (или газе) частиц; Б) хаотическое движение взвешенных в жидкости частиц; В) упорядоченное движение молекул жидкости; Г) упорядоченное движение взвешенных в жидкости частиц.
2. Какая из приведённых ниже формул позволяет рассчитать среднюю кинетическую энергию поступательного движения молекул газа:
А) p=nkT; Б) E=3/2kT; В) p=1/3m0nv2
3. Как изменится давление идеального газа при увеличении абсолютной температуры в 2 раза и объёма в 2 раза? (масса газа не изменяется)
А) увеличится в 4 раза; Б) уменьшится в 4 раза; В) не изменится; Г) увеличится в 2 раза.
4. Процесс изменения термодинамической системы при постоянном давлении называют:
А) изотермическим; Б) изохорным; В) изобарным.
5. Какое выражение соответствует закону Бойля-Мариотта:
А) V/T=const; Б) pV=const; В) p/T=const; Г) pT=const.
6. На рисунке график зависимости p(V), m=const. Какой процесс изменения газа изображён на рисунке?
А) изотермическое расширение; Б) изобарное расширение; В) изобарное сжатие; Г) изохорное нагревание.

Задание 1. Вариант 2
Какое из следующих положений противоречит основам МКТ:
А) вещество состоит из молекул; Б) молекулы вещества движутся беспорядочно; В) все молекулы взаимодействуют друг с другом; Г) все молекулы вещества имеют одинаковые скорости.
2. Какая из приведённых ниже формул позволяет вычислить число частиц:
А) N= ; Б) v=m/M; В) p=nkT.
; Б) v=m/M; В) p=nkT.
3. Как изменится давление идеального газа, если число молекул газа и его объём увеличится в 2 раза, а температуру оставить неизменной?
А) увеличится в 2 раза; Б) уменьшится в 2 раза; В) увеличится в 4 раза; Г) не изменится.
4. Внутренняя энергия одноатомного идеального газа равна:
А) 
 ; Б)
; Б) 
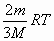 ; В)
; В) 
 ; Г)
; Г) 
 .
.
5. Газ, взаимодействие между молекулами которого пренебрежимо мало, называется:
А) реальным; Б) абсолютным; В) идеальным; Г) свободным.
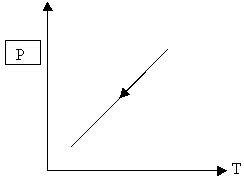
6. На рисунке график зависимости p(Т), m=const. Какой процесс изменения газа изображён на рисунке?
А) изохорное нагревание; Б) изохорное охлаждение; В) изотермическое сжатие; Г) изобарное расширение.
Взаимопроверка. Ответы
| Вариант 1 | Вариант 2 |
| 1. А | 1. Г |
| 2. Б | 2. А |
| 3. В | 3. Г |
| 4. В | 4. В |
| 5. Б | 5. В |
| 6. В | 6. Б |
4.Изучение первого закона термодинамики. Немецкий ученый – философ И. Кант сказал так: “Все наше знание начинается с опыта”.
Учитель. Мы ежедневно встречаемся с явлениями, проводим элементарные физические опыты, не задумываясь об их объяснении.
Выполним задание 2.
Задание 2.
Фронтальный опыт «Изменение внутренней энергии тела при совершении работы»
НЕ ЗАБУДЬТЕ О ПРАВИЛАХ ТЕХНИКИ БЕЗОПАСНОСТИ!!!
Задание 2.План опыта.
Налейте в пробирку 10 мл воды и измерьте ее температуру.
Закройте пробирку пробкой (или большим пальцем, если нет пробки) и заверните в бумагу. Энергично встряхивайте воду в пробирке в течение 40 секунд (время засеките по секундомеру в часах ).
Откройте пробирку и снова измерьте температуру воды.
Ответьте на вопросы: а) как изменилась внутренняя энергия воды во время опыта? б) каким способом вы изменяли внутреннюю энергию воды в опыте? в) зачем пробирку с водой необходимо было заворачивать в бумагу во время опыта? г) что можно сказать о зависимости изменения внутренней энергии тела от совершённой работы?
Учитель. К середине 19 века многочисленные опыты показали, что механическая энергия никогда не пропадает бесследно.
Закон сохранения энергии:
Энергия в природе не возникает из ничего и не исчезает: количество энергии неизменно, она только переходит из одной формы в другую. (Падает, например, молот на кусок свинца и свинец нагревается - потенциальная энергия молота переходит в кинетическую, затем механическая энергия превратилась во внутреннюю энергия тела). Закон сохранения и превращения энергии, распространённый на тепловые явления, носит название первого закона термодинамики.
В термодинамике рассматриваются тела, положение центра тяжести которых практически не меняется. Механическая энергия таких тел остаётся постоянной, изменяться может лишь внутренняя энергия каждого тела. Нагревание тела может происходить без сообщения ему какого-либо количества теплоты, а только за счет совершения работы, что мы и наблюдали в проделанном опыте. Либо за счёт теплообмена с окружающими телами.
Опыт. Изменение состояния термодинамической системы "теплоприёмник - газ" путём теплопередачи.
Учитель В общем случае при переходе системы из одного состояния в другое внутренняя энергия изменяется одновременно как за счёт совершения работы, так и за счёт передачи теплоты.
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты переданного системе:
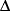 U=Q+A.
U=Q+A.
Если система изолирована (замкнутая) то есть над ней не совершается работа (А=0) и она не обменивается теплотой с окружающими телами (Q=0). То в этом случае согласно первому закону термодинамики 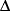 U=0 (U1 =U2). Внутренняя энергия изолированной системы остаётся неизменной (сохраняется).
U=0 (U1 =U2). Внутренняя энергия изолированной системы остаётся неизменной (сохраняется).
Учитывая, что A/ = - А, получим Q=A/ + 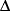 U
U
Количество теплоты, переданное системе, идёт на изменение её внутренней энергии и на совершение системой работы над внешними телами.
Учитель. Первый закон термодинамики был открыт в середине 19 века немецким учёным врачом Майером (1814-1878)( Р. Майер пришёл к открытию закона и к мысли о том, что энергия может превращаться. И солнечная энергия превращается в энергию растений и остального живого), английским учёным Д. Джоулем(1818 - 1889) и получил наиболее точную формулировку в трудах немецкого учёного Г Гельмгольца (1821-1894) который записал закон в математической форме и доказал невозможность создания вечного двигателя-устройства, способного совершать неограниченное количество работы без затрат топлива или каких –либо других материалов.
У первого закона термодинамики особая история открытия, отличная от открытия других законов. Обычно сначала формулируется закон, а затем создаются технические устройства. В этом случае было наоборот.
(На экран проецируется следующие сведения:)
1736 год - паровая лодка
1770 год – паровая повозка
1775 год - отказ Парижской Академии наук принимать проекты вечных двигателей
1807 год - пароход Фултона
1824 год – паровоз Стефенсона
1842 год - статья Р. Майера “Замечания о силах неживой природы”
Учитель. Если к системе не поступает теплота, то работа Аі может быть совершена только за счет убыли внутренней энергии.
Аі =-ΔU.
После того как запас энергии окажется исчерпанным, двигатель перестанет работать.
| Процесс | Постоянная физическая величина | Модель установки | I закон термодинамики и его особенности |
| изохорный | V = соnst | 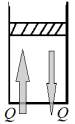
| ΔU=Q; ΔV=0; Aʹ=0; A=0 Если Q0; ΔU0; ΔT0 Если Q0 |
| изобарный | P = const | 
| Q = ΔU + Aʹ; Если Q0; ΔU0; Aʹ 0; A Если Q0 |
| изотермический | Т = const | 
| T = const; ΔT = 0; ΔU = 0; Q = Aʹ Если Q0; Aʹ0; ΔV0 Если Q0; AʹΔV |
| адиабатический | Q = 0 в теплоизоля- ционной системе | 
Q=0 | Q = 0; ΔU = A
Aʹ0; ΔUΔT0; ΔV |
Л.Винч писал «О, искатели постоянного двигателя, сколько пустых проектов создали вы в подобных поисках».В 1775 г. Парижская академия наук сделала заключение: Построение вечного двигателя абсолютно невозможно», и перестала рассматривать любые проекты вечных двигателей.
е) применение первого закона термодинамики к различным процессам.
(Самостоятельная работа учащихся в группах. Исследование первого закона термодинамики и запись уравнений первого закона термодинамики для различных процессов (работа с учебником Ф10 п.27и заполнение таблицы):
■ 1 группа - изохорный процесс стр.207.
■ 2 группа - изотермический процесс стр.208.
■ 3 группа - изобарный процесс стр. 208.
■ 4 группа - адиабатный процесс стр. 208.
( Запишите в тетрадь.)
Учитель. Адиабатным называется процесс изменения объема и давления газа при отсутствии теплообмена с окружающими телами.
Примеры адиабатных процессов:
сжатие воздуха в воздушном огниве;
сжатие воздуха в дизеле;
образование серебряных облаков.
(Систематизация материала. Заполнение таблицы №1 в группах.
Проверка правильности заполнения таблицы №1 с помощью учебной компьютерной программы «Открытая Физика» (возможна самопроверка и взаимопроверка, заслушать ответы на вопросы).
6. Обобщение изученного материала:
■ Внутренняя энергия идеального газа не изменяется только при изотермическом процессе.
■ Внутренняя энергия идеального газа изменяется за счёт теплопередачи при изохорном процессе.
■ Внутренняя энергия идеального газа изменяется за счёт теплопередачи и за счёт совершения работы газом при изобарном процессе.
■ Изменение внутренней энергии в теплоизолированной системе равно работе внешних сил при адиабатном процессе.
Новое - знакомство с графиком адиабатного процесса, квазистатистический процесс, энтропия («Открытая Физика»).
IV. Закрепление материала.
Решение задач:
а) качественных
Задача №1
Определите процессы, в которых участвует термодинамическая система идеальный газ, и прочитайте уравнение первого закона термодинамики для каждого случая?
а)
Ответ: происходит теплопередача, и над газом совершается работа, то есть изменяется объём, давление, температура, внутренняя энергия газа: 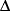 U=Q+A.
U=Q+A.
б)

Ответ: газу сообщается количество теплоты, следовательно газ совершает работу, то есть объём газа увеличивается; в зависимости от значений Q и А происходит изменение внутренней энергии: 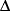 U=Q-A.
U=Q-A.
в)
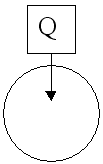
Ответ: газ нагревается, внутренняя энергия увеличивается, давление увеличивается, объём остаётся прежним:  U=Q.
U=Q.
г)

Ответ: газ охлаждается, и над ним совершается работа, то есть возможно изменение внутренней энергии:  U=А - Q.
U=А - Q.
д)

Ответ: газ охлаждается, температура его уменьшается, внутренняя энергия тоже уменьшается:  U= - Q.
U= - Q.
е)

Ответ: система остаётся в равновесном состоянии: 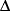 U=0.
U=0.
2. Обращали ли вы внимание на туманное облачко, которое появляется у горлышка бутылки с охлажденной газированной водой сразу, после ее открывания? Чем это вызвано? (В бутылке с газированной водой, всегда, имеется немного сжатого газа. При открывании бутылки, газ адиабатически расширяется, совершая против сил атмосферного давления, работу. В результате температура газа понижается, внутренняя энергия его уменьшается. Водяной пар, который содержится в газе, конденсируется в виде туманного облачка).
б) количественных
1.При изохорном нагревании газу было передано от нагревателя 250 Дж теплоты.
2.Какова работа, совершенная газом? Что произошло с его внутренней энергией? (Aʹ= 0; ΔU = 250 Дж)
3. При адиабатическом сжатии газа была совершена работа 200 Дж. Что произошло при этом с внутренней энергией газа? ( ΔU = – 200 Дж)
4.Идеальный газ, находясь в тепловом контакте с окружающими телами, совершил работу 300 Дж. При этом внутренняя энергия газа увеличилась на 300 Дж. Получал или отдавал газ количество теплоты и сколько?
Дано:
A’ = 300 Дж;
ΔU = 300 Дж;
___________
Q - ?
Решение.
Q = ΔU + A’
Q = 300 Дж + 300 Дж =
= 600 Дж;
Ответ: получил 600 Дж.
5.Какое количество теплоты получил идеальный газ, взятый в количестве двух молей при изобарном нагревании на 50 градусов Кельвина и как при этом изменилась его внутренняя энергия?
Ответ: Q =2077 Дж
А`=Р*ΔV=m/М*R*ΔT= =ν*R*ΔT
ΔU= 3/2*ν*R*ΔT
Q = ΔU + A`
Q = 3/2*ν*R*ΔT + ν*R*ΔT = 5/2* ν*R*ΔT =
=2,5*2моль*8,31Дж/моль*К**50К = 2077 Дж
6.Для изобарного нагревания газа, количество вещества которого 800 моль на 500 градусов Кельвина ему сообщили количество теплоты 9,4 МДж. Определите работу газа и изменение его внутренней энергии.
Ответ: ΔU =6,1 МДж
А`=ν* R*ΔT= 800моль*8,31Дж/мольК *500К= 33,24*10^4 Дж
ΔU = Q - A`
ΔU = Q - ν* R*ΔT = 9,4*10^6 Дж –800моль*8,31Дж/мольК *500К= 6,1 МДж
Итоги урока.
Учитель читает рассказ американского писателя – фантаста Джэкобса “Обезьянья лапа”:
• В скромную семью приезжает в гости сержант из Индии. Он показывает хозяевам талисман – высушенную обезьянью лапу, которая может выполнять любые желания его владельцев. Собравшиеся решают испытать талисман. Хозяин просит у обезьяньей лапы 200 фунтов стерлингов.
• Раздаётся стук в дверь. Входит служащий той фирмы, где работает сын хозяина. Он сообщает, что в результате несчастного случая сын хозяина погиб. Фирма не считает себя виновной за случившееся, но в порядке компенсации просит принять пособие в размере 200 фунтов стерлингов.
• Какое отношение имеет этот рассказ к нашей теме? (учащиеся отвечают)
• Учитель: Вы видите, что закон, на основе которого определяется изменение внутренней энергии, – один и тот же для всех явлений природы: физических, химических, биологических и даже общественных. Значит, энергия ниоткуда не возникает и никуда не исчезает, она переходит из одного вида в другой. Ещё древние греки считали: “Из ничего ничего не бывает”.
Значение этого закона трудно переоценить. На основе его проверяется новая установка или механизм. Если закон в новой теории не выполняется, то новая теория несостоятельна.
• Подведение итогов
• Выставление оценок.
• Домашнее задание.
• § 80, упр. 15 (1-3) .
• Заключительное слово
11


































