
Периодический закон и периодическая система элементов Д.И. Менделеева

Открытие Периодического закона
В основу своей классификации химических элементов Д.И. Менделеев положил два их основных и постоянных признака:
- величину атомной массы
- свойства образованных химическими элементами веществ.
И только с открытием строения атома, удалось грамотно сформулировать периодический закон

Открытие Периодического закона
При этом он обнаружил, что свойства элементов в некоторых пределах изменяются линейно (монотонно усиливаются или ослабевают), затем после резкого скачка повторяются периодически , т.е. через определённое число элементов встречаются сходные .

Первый вариант Периодической таблицы
На основании своих наблюдений 1 марта 1869 г. Д.И. Менделеев сформулировал периодический закон, который в начальной своей формулировке звучал так: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов

Периодический закон
Д.И. Менделеева
Если написать ряды один под другим так, чтобы под литием находился натрий , а под неоном – аргон , то получим следующее расположение элементов:
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar
При таком расположении в вертикальные столбики
попадают элементы, сходные по своим свойствам.
При переходе от лития к фтору происходит закономерное ослабление металлических свойств и усиление неметаллических.
При переходе от фтора к следующему по значению атомной массы элементу натрию происходит скачок в изменении свойств ( Nа повторяет свойства Li )

Периодический закон Д.И. Менделеева
Современная трактовка Периодического закона:
Свойства химических элементов и образуемых ими соединений находятся в периодической зависимости от величины заряда их атомных ядер.
Почему существует такая зависимость можно понять разобравшись со строением атома, но это позже.
А в этой теме мы разберем строение периодической системы и отметим закономерности изменения свойств атомов.

Р
19
30,974
ФОСФОР
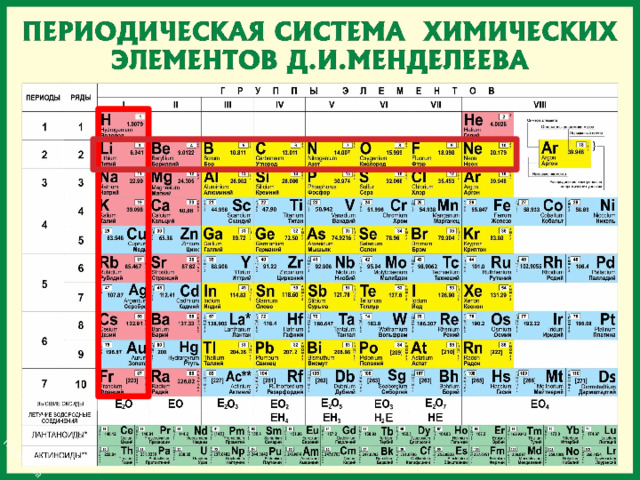
Итак периодическая система состоит из ячеек, В КОТОРЫХ ЕСТЬ СИМВОЛ хэ, ЕГО НАЗВАНИЕ. ПОРЯДКОВЫЙ НОМЕР И ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА
ЭТИ ЯЧЕЙКИ складываются в вертикальные и горизонтальные ряды.
7
7
Итак периодическая система состоит из ячеек, В КОТОРЫХ ЕСТЬ СИМВОЛ хэ, ЕГО НАЗВАНИЕ. ПОРЯДКОВЫЙ НОМЕР И МАССА АТОМА ИЛИ МАССОВОЕ ЧИСЛО
ЭТИ ЯЧЕЙКИ складываются в вертикальные и горизонтальные ряды.
7

7
Периоды
Периоды - горизонтальные ряды химических элементов, всего 7 периодов. Периоды делятся на малые (I,II,III) и большие (IV,V,VI), VII-незаконченный.
7

Периоды
7
Каждый период (за исключением первого) начинается типичным металлом (Li, Nа, К, Rb, Cs, Fr) и заканчивается благородным газом (Не, Ne, Ar, Kr, Хе, Rn), которому предшествует типичный неметалл.

7
Группы
вертикальные столбцы элементов с одинаковым числом электронов на внешнем электронном уровне, равным номеру группы.
7

7
Группы
Различают главные (А) и побочные подгруппы (Б) .
Главные подгруппы состоят из элементов малых и больших периодов.
Побочные подгруппы состоят из элементов только больших периодов.
Такие элементы назваются переходными .
7

7
Переходные элементы В ТАБЛИЦЕ ОБЫЧНО ВЫДЕЛЕНЫ ОТДЕЛЬНЫМ ЦВЕТОМ. ЗДЕСЬ окрашены в голубой цвет.
Элементы главных подгрупп по химическим свойствам значительно отличаются от элементов побочных подгрупп. Особенно наглядно это различие в VII и VIII группах периодической системы элементов.
Например главную подгруппу в VIII группе составляют благородные газы He, Ne, Ar, Kr, Xe, Rn (РОДОН), а побочная подгруппа представлена триадами элементов: Fe, Co, Ni — в IV периоде, Ru, Rh, Pd — в V периоде, Os, Ir, Pt — в VI периоде. В отличие от благородных газов названные элементы имеют ярко выраженные металлические свойства.
7

7
Периодическая таблица химических элементов
Запомнить!!!
- Номер периода = число энергетических уровней атома.
- Номер группы = число внешних электронов атома.
(Для элементов главных подгрупп)
в котором находится элемент
7
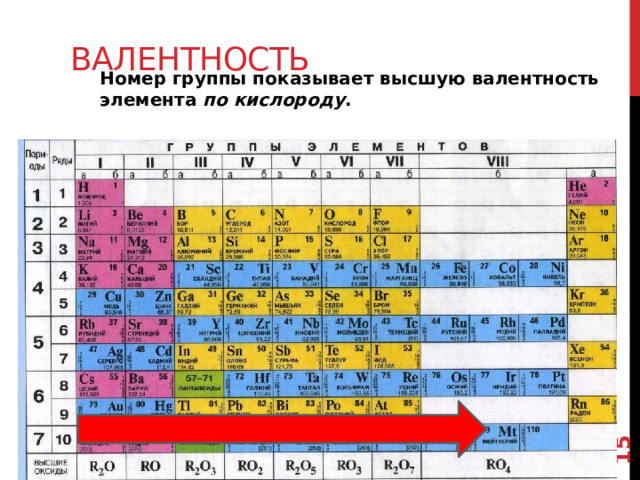
Валентность
7
Номер группы показывает высшую валентность элемента по кислороду .
Поскольку внешние электроны отвечают за образование связей между атомами, то номер группы связан с валентностью следующим правилами:
Это значит что в соединениях с кислородом , т.е. в оксидах, атомы проявляют валентность равную номеру группы. Это справедливо для высших оксидов.
Мы видим, что в этих соединенияхвалентность возрастает от 1 до 8
7

7
Валентность
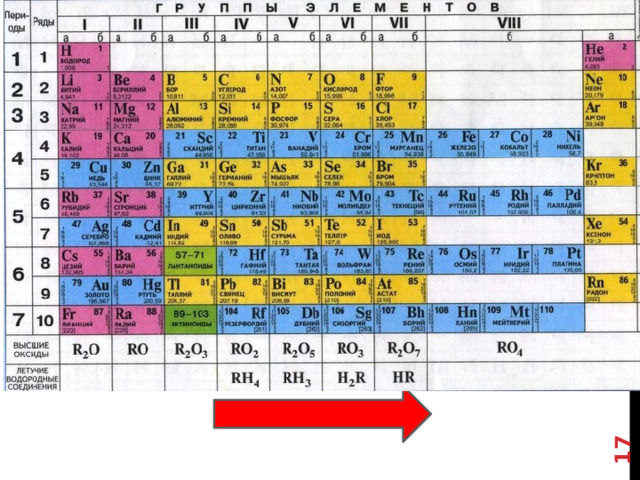
Элементы IV, V, VI и VII групп образуют летучие водородные соединения.
Номер группы показывает валентность элемента в соединениях с водородом .
8-№группы
Элементы главных подгрупп характеризуются также валентностью по водороду.
Поскольку, Элементы IV, V, VI и VII групп образуют летучие водородные соединения.
Номер группы = валентность элемента в соединениях с водородом .
7
7
Валентность по водороду при переходе от элементов IV группы к элементам VII группы уменьшается от 4 до 1. Напротив, валентность этих элементов по кислороду в том же направлении возрастает от 4 до 7.
7

7
Изменение радиуса атома в периоде
Радиус атома уменьшается с увеличением зарядов ядер атомов в периоде.
В начале периода расположены элементы с небольшим числом электронов на внешнем электронном слое и, соответственно, большим радиусом атома .
7

7
Изменение радиуса атома в периоде
В одной группе с увеличением номера периода атомные радиусы возрастают .

7
Изменение радиусов атомов в таблице Д.И. Менделеева
В правом верхнем углу располагаются эл. С наименьшим радиусом
7

7
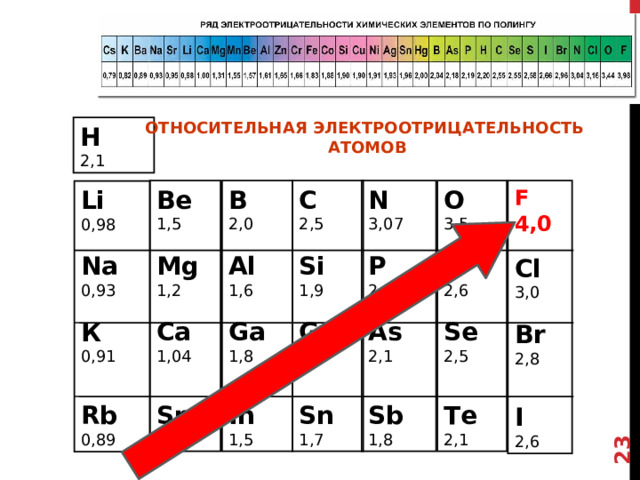
Электроотрицательность
Электроотрицательность - это способность атома притягивать электронную плотность.
Электроотрицательность в периоде увеличивается с возрастанием заряда ядра химического элемента, то есть слева направо.
Электроотрицательность - это способность атома притягивать электронную плотность .
Или это способность атомов оттягивать к себе электроны других атомов
Чем больше положительный заряд в ядре атома, тем больше притяжение к этому ядру
Электроотрицательность в периоде увеличивается с возрастанием заряда ядра химического элемента, то есть слева направо . .
7

7
Электроотрицательность в группе увеличивается с уменьшением числа электронных слоев атома (снизу вверх).
Самым электроотрицательным элементом является фтор (F), а наименее электроотрицательным – франций (Fr).
7
ОТНОСИТЕЛЬНАЯ ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ
АТОМОВ
Н
2,1
С
В
О
F
Be
N
2,5
3,5
2,0
3,07
4,0
1,5
Al
S
Сl
Mg
Si
P
1,6
2,6
2,2
3,0
1,9
1,2
Br
Se
As
Ga
Ca
Ge
2,0
1,8
1,04
2,8
2,1
2,5
Sb
Те
In
I
Sn
Sr
2,1
1,8
0,99
1,5
2,6
1,7
Li
0,98
Na
0,93
К
0,91
Rb
0,89
Давайте посмотрим на численные значения ЭО для следующих элементов в таблице.
Мы видим, что действительно ЭО растет слева-направо и снизу – вверх.
Т.е. , можно сказать, что она увеличивается в таблице Менделеева По диагонали
Т.о. ,еще раз отмечу, Самым электроотрицательным элементом является фтор (F)
Существует Наиболее распространённая шкала относительных атомных электроотрицательностей Полинга, которая охватывает значения от 0,7 для атомов франция или 0,79 для цезия и до 4,0 для атомов фтора.
7

7
Окислительно-восстановительные
свойства
Восстановительные свойства атомов - способность терять электроны при образовании химической связи.
Окислительные свойства атомов -способность принимать электроны при образовании химической связи.
1) С понятием ЭО напрямую связаны следующие свойства простых веществ
Восстановительные свойства атомов - способность терять электроны при образовании химической связи.
Окислительные свойства атомов -способность принимать электроны при образовании химической связи.
7

7
Окислительно-восстановительные
свойства
В главных подгруппах снизу вверх, в периодах – слева направо окислительные свойства простых веществ элементов возрастают , а восстановительные свойства, соответственно, убывают.
7
7
электроотрицательность
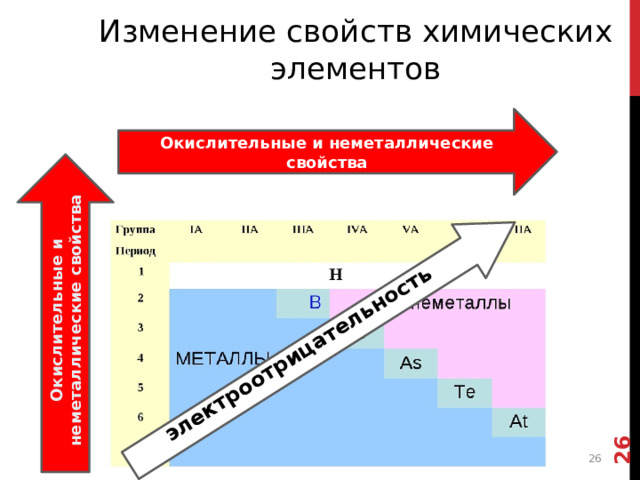
Окислительные и неметаллические свойства
Изменение свойств химических элементов
Окислительные и неметаллические свойства
Т.о. окислительные свойства растут в том же направлении, что и ЭО.
Такое сильное различие в ОК-ВС свойствах разделяет табл.Менделеева на два полюса:
В нижнем левом углу располагаются сильнйшие восстановители - это активные металлы
А в верхнем правом типичные неметаллы – или сильнейшие окислители.
7
7
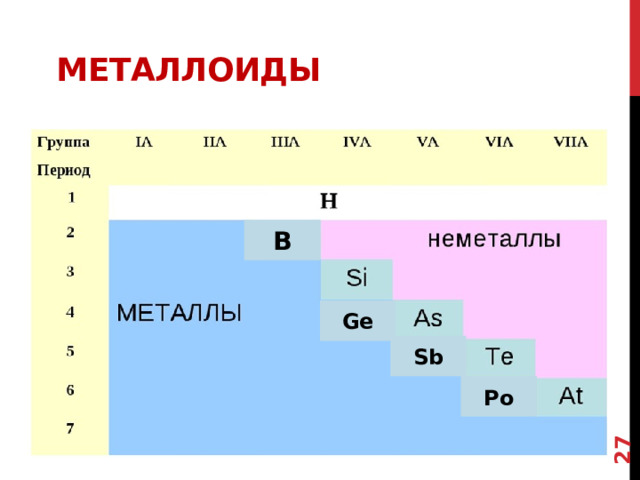
МЕТАЛЛОИДЫ
B
Ge
На границе располагаются элементы, которые обладают свойствами металлов, и неметаллов- их называют МЕТАЛЛОИДЫ ИЛИ ПОЛУМЕТАЛЛЫ
Это: бор (B), кремний (Si), мышьяк (As), сурьма (Sb),теллур (Te), полоний (Po).
По своим химическим свойствам полуметаллы являются неметаллами, но по типу проводимости относятся к проводникам.
Sb
Po
7

7
МЕТАЛЛОИДЫ
По своим химическим свойствам полуметаллы являются неметаллами, но по типу проводимости относятся к проводникам.

7
СТРОЕНИЕ АТОМА

7
СТРОЕНИЕ АТОМА
1911 г Английский ученый Эрнест Резерфорд предложил планетарную модель атома
В настоящий момент существует несколько моделей атомов. Мы рассмотрим две из них: модель Резерфорда (классическая) и вторая- квантово-механическая . Первая модель довольно проста для понимания, но она не подходит для описания атомов со сложной структурой.
7
Строение
атома
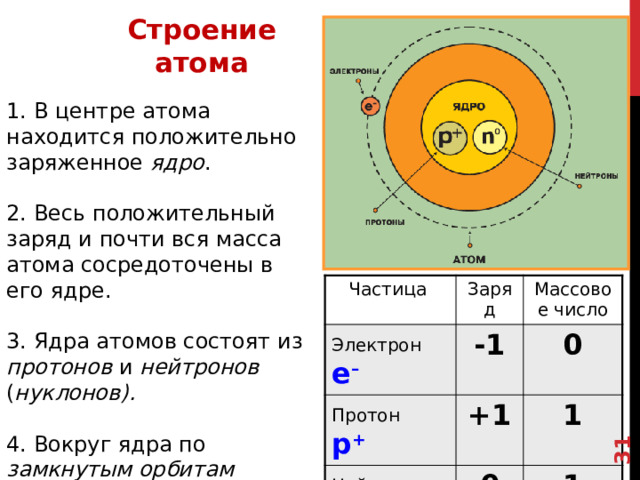
1. В центре атома находится положительно заряженное ядро .
2. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре.
3. Ядра атомов состоят из протонов и нейтронов ( нуклонов).
4. Вокруг ядра по замкнутым орбитам вращаются электроны.
Частица
Электрон е –
Заряд
Массовое число
-1
Протон р +
0
Нейтрон n 0
+1
0
1
1
Итак, упрощенно модель атома можно представить следующим образом….
В Представленной таблице даны такие характеристики электрона , протона и нейтрона как заряд и массовое число.
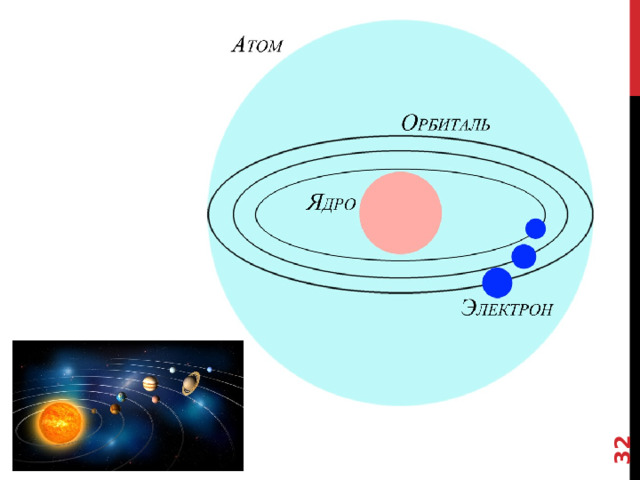
В модели Резерфорда электроны, несущие отрицательный заряд, в атоме движутся по определенным электронным орбитам - по аналогии с движениями планет Солнечной системы. Каждая планета движется по своей орбите, так и электроны вращаются вокруг ядра атома.
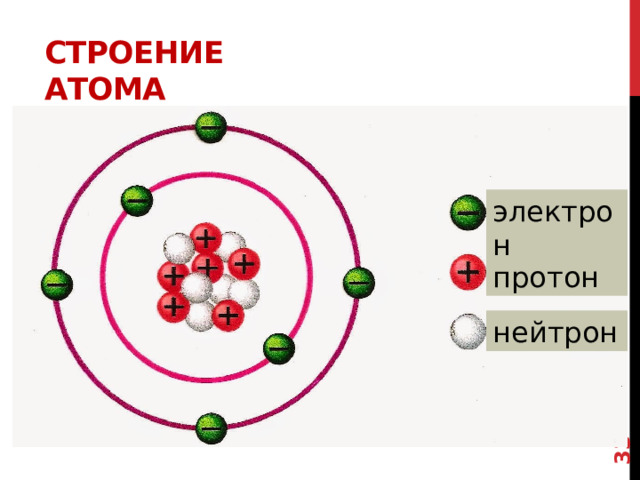
Строение атома
электрон
протон
В соответствии с этой моделью, мы будем изображать строение атома следующим образом. В центре находится ядро, а по всему объему движутся электроны
Так как атом в целом электронейтрален, то количество электронов (-1) должно быть таким же как количество протонов (+1)
но как узнать сколько протонов, нейтронов и электронов содержится в атоме конкретного химического элемента.
Для этого необходимо вспомнить что же такое химический элемент?
нейтрон
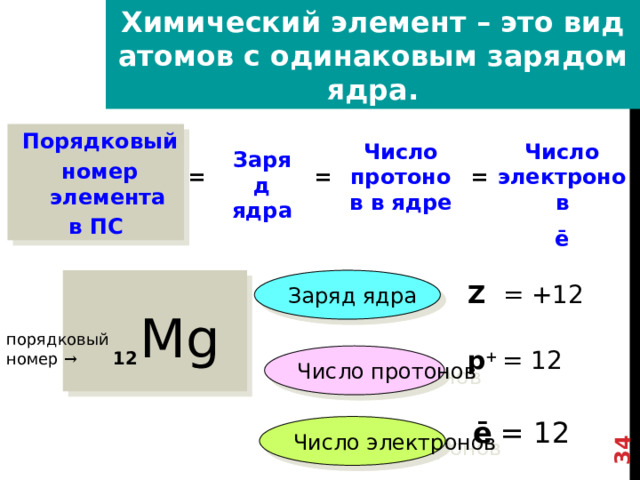
Химический элемент – это вид атомов с одинаковым зарядом ядра.
34
Порядковый
номер элемента
в ПС
Число протонов в ядре
Число электронов
ē
Заряд ядра
=
=
=
Заряд ядра
Z = +12
Mg
Химический элемент – это вид атомов с одинаковым зарядом ядра
В периодической системе все ХЭ располагаются в соответствии с величиной заряда их атомных ядер
Таким образом номер ХЭ в период.системе это и есть Заряд ядра
А Заряд ядра определяется числом протонов в этом ядре, число протонов в свою очередь=числу электронов
порядковый номер →
р + = 12
12
Число протонов
ē = 12
Число электронов
34

34
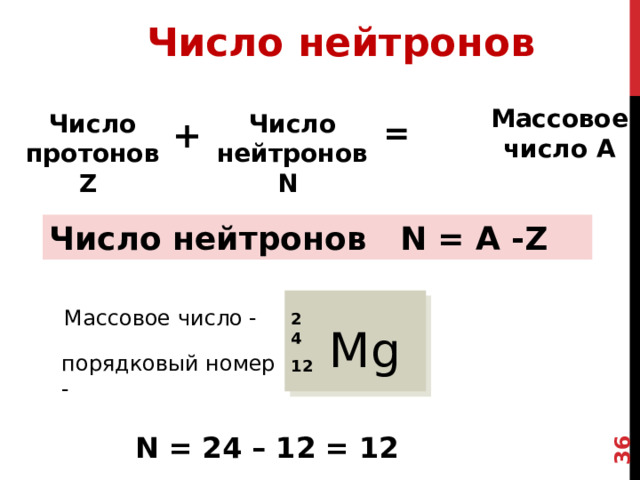
Число нейтронов
Во атомах одного химического элемента число
протонов р + всегда одинаково (равно заряду ядра Z), а число нейтронов N бывает разным.
34
Число нейтронов
Массовое число А
Число нейтронов N
Число протонов Z
=
+
Число нейтронов N = A -Z
Массовое число -
Масса атома в а.е.м. или массовое число мы можем найти в ПС, оно определяется массой всех протонов и массой всех нейтронов ядра
Т.о. получаем формулу для нахождения числа нейтронов конкретного атома
Давайте найдем чило нейтронов для атома магния
24
Mg
порядковый номер -
12
N = 24 – 12 = 12
34
34
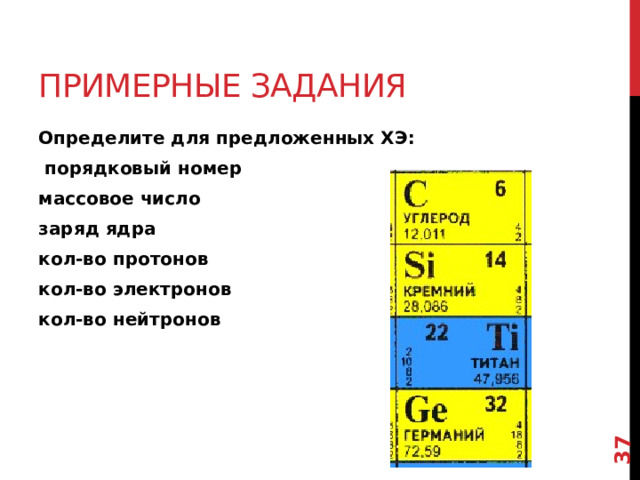
Примерные задания
Определите для предложенных ХЭ:
порядковый номер
массовое число
заряд ядра
кол-во протонов
кол-во электронов
кол-во нейтронов
Выполнив это задание вы увидите, что кол-во нейтронов не обязательно равно кол-ву протонов
34
38
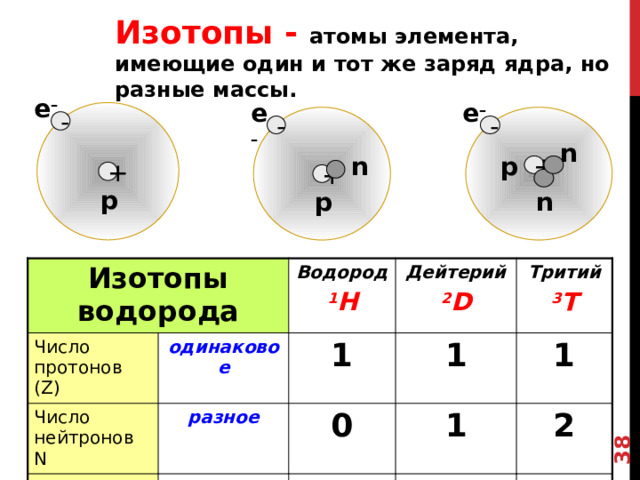
Изотопы - атомы элемента, имеющие один и тот же заряд ядра, но разные массы.
е –
е –
е –
-
-
-
n
р
n
+
+
+
р
n
р
Изотопы водорода
Число протонов (Z)
Число нейтронов N
Водород
одинаковое
Массовое число А
Дейтерий
1
разное
1 H
0
разное
1
Тритий
2 D
1
1
1
3 T
2
2
3
Существуют ХЭ, имеющие один и тот же заряд ядра, но разные массы, такие элементы называются ИЗОТАПАМИ.
Давайте рассмотрим изотопы самого простого ХЭ ВОДОРОДА.
НА СЕГОДНЯШНИЙ ДЕНЬ ИХ ВСЕГО 3 : ВОДОРОД (ИМЕЕТ 1 ПРОТОН И НЕ ИМЕЕТ НЕЙТРОНОВ)
ДЕЙТЕРИЙ (1ПРОТОН+1 НЕЙТРОН
ТРИТИЙ (1 ПРОТОН И 2 НЕЙТРОНА)
Т.о., ОДИНАКОВЫЙ ЗАРЯД ЯДРА ПОЗВОЛЯЕТ ПРИЧИСЛИТЬ ДАННЫЕ АТОМЫ К ОДНОМУ ХИМИЧЕСКОМУ ЭЛЕМЕНТУ – ВОДОРОДУ.
38

Изотопы хлора
35
37
17 Сl
17 Сl
75%
25%
Известно, что в природе хлор может находиться в виде двух стабильных изотопов. с массовым числом 35 и 37 Доли их содержания соответственно равны 75 и 25%
ТАК, ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА ПРЕДСТАВЛЕННАЯ В ТАБЛИЦЕ МЕНДЕЛЕЕВА РАВНА ПРИМЕРНО 35,5
Ar = 0.75 * 35 + 0.25 * 37 = 35.5
38

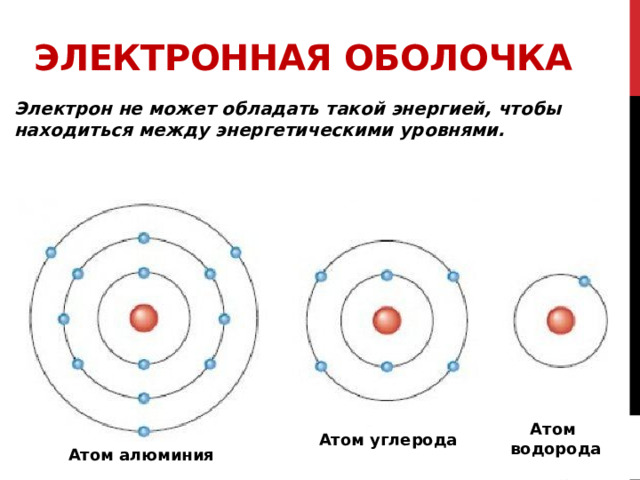
Электронная оболочка - совокупность всех электронов в атоме, окружающих ядро.
38
все электронЫ в атоме, окружающиЕ ядро ОБРАЗУЮТ ЭЛЕКТРОННУЮ ОБОЛОЧКУ
38

Электронная оболочка
38
Электрон в атоме находится в связанном состоянии с ядром и обладает энергией, которая определяет энергетическиий уровень на котором находится электрон.
Электрон в атоме находится в связанном состоянии с ядром и обладает энергией , которая определяет энергетическиий уровень на котором находится электрон.
Как Каждая планета движется по своей орбите, так и электроны вращаются вокруг ядра атома.
Каждая такая орбита для электрона получила название "энергетическиий уровень ".
38
Электронная оболочка
38
Электрон не может обладать такой энергией, чтобы находиться между энергетическими уровнями.
Энергия электрона зависит от радиуса его орбиты. Минимальная энергия у электрона, который находится на ближайшей к ядру орбите.
Чем выше уровень, тем слабее связь с ядром. И ТЕМ ВЫШЕ ЭНЕРГИЯ ЭЛЕКТРОНА.
Атом
водорода
Атом углерода
Атом алюминия
38
38
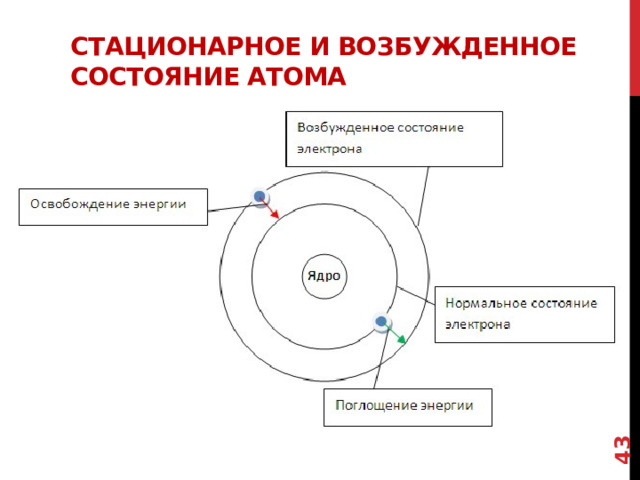
Стационарное и возбужденное состояние атома
ИМЕННО ПОЭТОМУ электрон может перескакивать с одной орбиты на другую и обратно ТОЛЬКО ПОГЛОЩАЯ ИЛИ ИСПУСКАЯ ПОРЦИЮ ЭНЕРГИИ.
КОТОРАЯ НАЗЫВАЕТСЯ КВАНТОМ
При поглощении кванта энергии электрон переходит на орбиту с более высокой энергией ИЛИ ГОВОРЯТ, ЧТО АТОМ ПЕРЕХОДИТ В возбужденное состояние .
38
38
1
Е 1
2
ядро
3
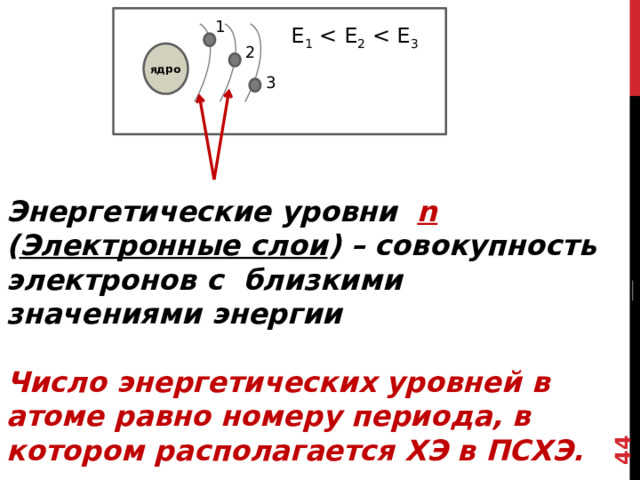
Энергетические уровни n ( Электронные слои ) – совокупность электронов с близкими значениями энергии
Число энергетических уровней в атоме равно номеру периода, в котором располагается ХЭ в ПСХЭ.
Итак,
Замомнить!
38
Определите
38
Число энергетических уровней для
Н, Li, Na, K, Сu

38
Распределение электронов по уровням
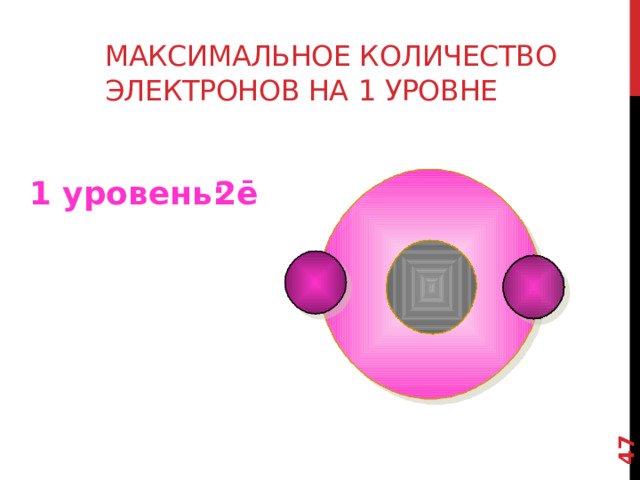
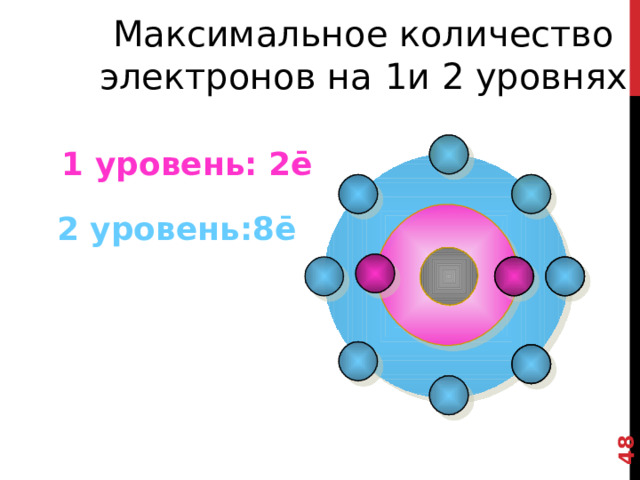
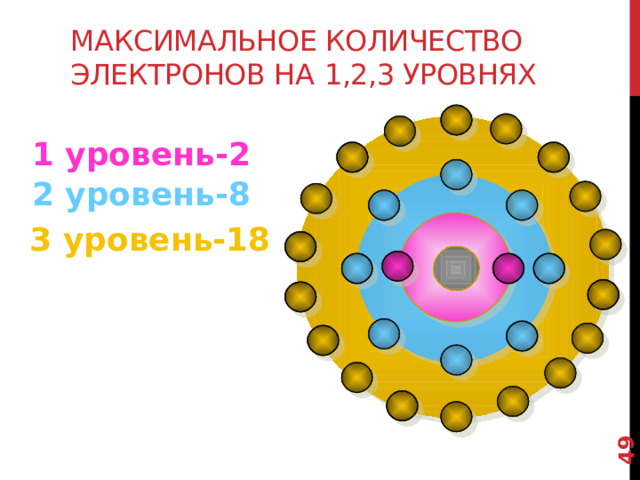
N=2n 2 формула для вычисления максимального количества электронов на энергетических уровнях, где n-номер уровня.
1 Й уровень - 2 электрона.
2 Й уровень - 8 электронов.
3 Й уровень - 18 электронов.
Давайте посмотрим, как Распределяются электроны по энергетическим уровням
Каждый уровень может вместить определенное количествол электронов.
Существует формула для вычисления максимального количества электронов на энергетических уровнях, N=2n 2
Так
38
38
Максимальное количество электронов на 1 уровне
1 уровень:
2ē
38
38
Максимальное количество электронов на 1и 2 уровнях
1 уровень: 2ē
2 уровень:8ē
38
38
Максимальное количество электронов на 1,2,3 уровнях
1 уровень-2
2 уровень-8
3 уровень-18
38

Схема электронного строения
Порядковый номер
заряд ядра +6 , общее число ē – 6 ,
- Углерод 6 С находится во втором периоде
- два энергетических уровня ( в схеме изображают скобками, под ними пишут число электронов на данном энергетическом уровне ):
6 С +6 ) )
чтобы каждый раз не рисовать такие сложные картинки, ВВЕЛИ схематичное обозначение электронного строения атома,
например ХЭ углерод порядковый номер = 6
… где скобки обозначают – энергетический уровень. А число под скобкой – это кол-во электронов
2 4
38
38

Энергетические уровни , содержащие максимальное число электронов, называются завершенными .
38
Они обладают повышенной устойчивостью и стабильностью
Энергетические уровни, содержащие меньшее число электронов, называются незавершенными
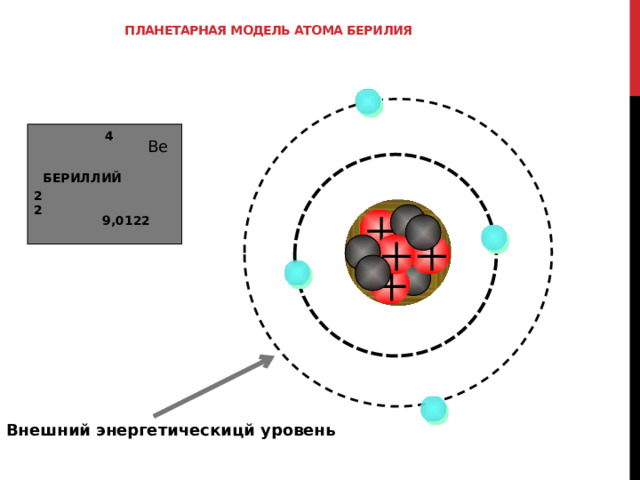
Планетарная модель атома берилия
4
Be
БЕРИЛЛИЙ
2
2
9,0122
Так для атома берилия, 1 эн. Уровень является завершенным, а 2 –ой НЕЗАВЕРШЕННЫМ.
2-ОЙ энергетический уровень называется внешним, а электроны на этом уровне – внешними электронами.
Внешний энергетическицй уровень
52

52
Периодическая таблица химических элементов
Число энергетических = № периода
уровней атома.
Число внешних электронов = № группы
Вспомним, что
52

52
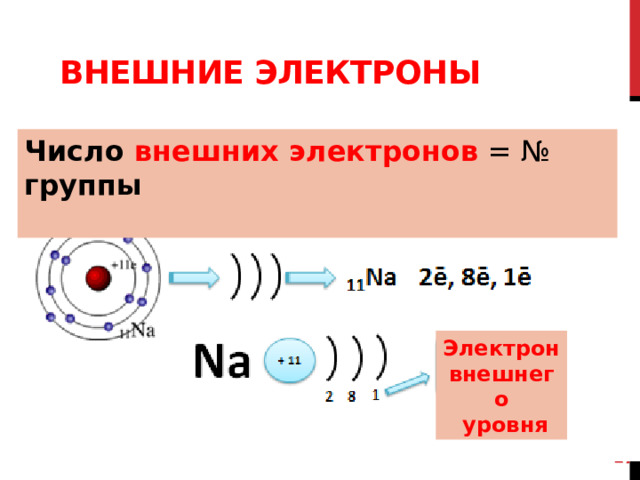
Na
11
22,99
натрий
Составим схему электронного строения для атома натрия
Натрий порядковый номер 11
11 протонов и 11 электронов
Находится в 3 периоде и в 1 группе – используем эту информацию для составления схемы электронного строения атома
54
54
Внешние электроны
Число внешних электронов = № группы
Мы убедились, что атом натрия имеет 1 электрон на внешнем слое
Итак, мы разобрались с распределение электронов по энергетическим уровням, теперь разберем из чего состоят энергетические уровни
Электрон
внешнего
уровня
54

Строение энергетических уровней
Каждый энергетический уровень состоит из подуровней: s , p , d , f .
Подуровень состоит из орбиталей.
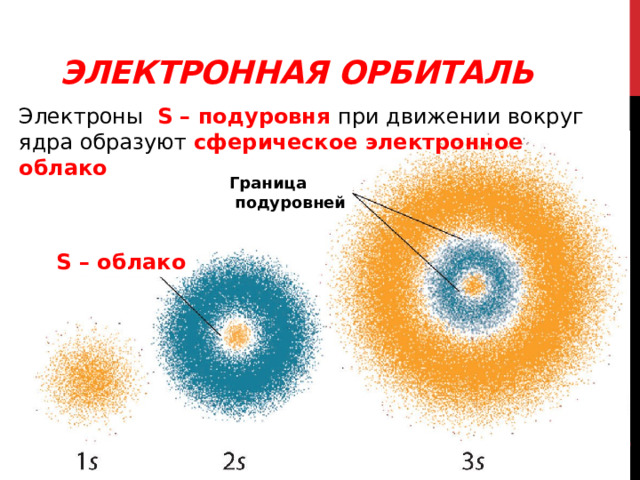
Электронная орбиталь - область наиболее вероятного местонахождения электрона в пространстве
54
Электронная орбиталь
Электроны S – подуровня при движении вокруг ядра образуют сферическое электронное облако
Граница
подуровней
S – облако
Это можно представить следующим образом
54
54
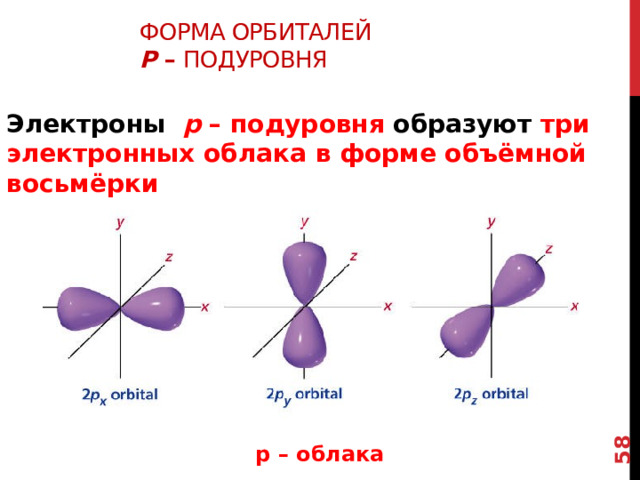
Форма орбиталей p – подуровня
Электроны p – подуровня образуют три электронных облака в форме объёмной восьмёрки
Но существуют и орбитали более сложных форм, например,
Электроны p – подуровня образуют три электронных облака в форме объёмной восьмёрки
р – облака
54

54
Форма орбиталей p – подуровня
Объединив их в пространстве получим вот такой объемный цветок
54
54
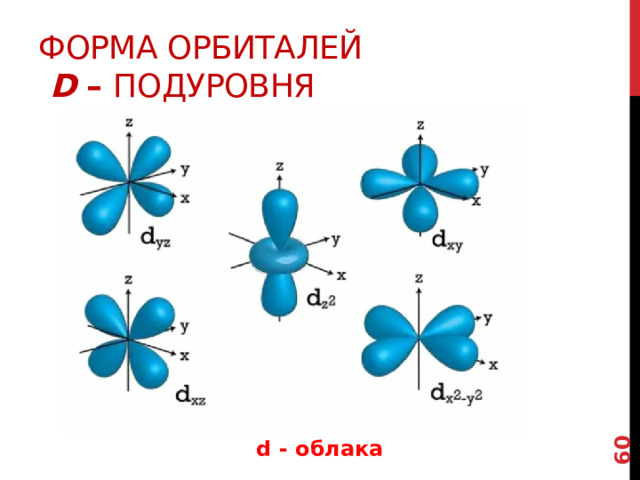
Форма орбиталей d – подуровня
d – подуровень включает 5 орбиталей и т.о. его Форма еще более сложная
d - облака
54
54
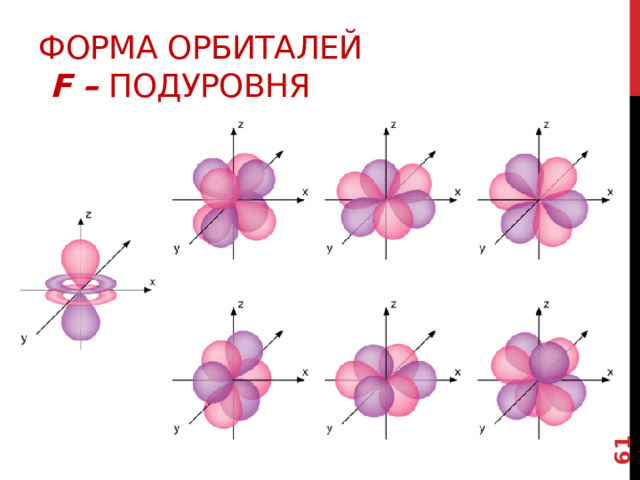
Форма орбиталей f – подуровня
Существует еще f – подуровень , котоорый включает 7 орбиталей.
54
54
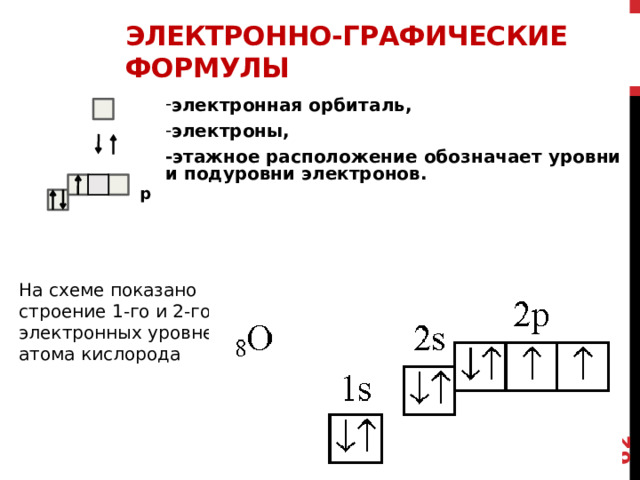
Электронно-графические формулы
- электронная орбиталь,
- электроны,
-этажное расположение обозначает уровни и подуровни электронов.
p
На схеме показано строение 1-го и 2-го электронных уровней атома кислорода
Поскольку возникла необходимость упростить такого рода изображения, стали пользоваться такими электронно – графическими формулами
Квадратиком обозначают орбитали, из которых состоят подуровни
Стрелка…
54

Электронно-графические формулы
Электронно-графические формулы
Подуровень состоит из орбиталей -
Е
n=4 – 4 подуровня (S,р,d,f )
f
n=4
d
p
S
Перед вами Электронно-графические схема
На ней все уровни и подуровни выстроены по энергии
Внизу уровни с наименьшей эн. Вверху с наибольшей
При этом один уровень включает несколько подуровней – с,п,д,ф, близких по энергии
Такого рода изображение намного проще для использования
n=3 – 3 подуровня (S, р, d)
n=2 – 2 подуровня (S, р)
n=1 – 1 подуровень (S)
где n -номер уровня
d
n=3
p
S
n=2
p
S
S
n=1
54
54

54
Квантовые числа
Состояние каждого электрона в атоме обычно описывают с помощью четырех квантовых чисел:
- главного (n),
- орбитального (l),
- магнитного (m) и
- спинового (s).
Первые три характеризуют движение электрона в пространстве, а четвертое - вокруг собственной оси.

54
Квантовые числа
- энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
1. Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра ( номер энергетического уровня );
n = 1, 2, 3, . . .

54
Квантовые числа
2. Орбитальное (побочное) квантовое число l определяет форму атомной орбитали.
Значения от 0 до n-1 (l = 0, 1, 2, 3,..., n-1).
Каждому значению l соответствует орбиталь особой формы.
l = 0 - s-орбиталь,
l = 1 - р-орбиталь, l = 2 - d-орбиталь,
l = 3 - f-орбиталь

54
3. Магнитное квантовое число m
- определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля.
m = 2 l +1
Значения изменяются от + l до - l , включая 0 .
Например, при l = 1 число m принимает
3 значения: +1, 0, -1, поэтому существуют
3 типа р -АО: р x, р y, р z.

54
Квантовые числа
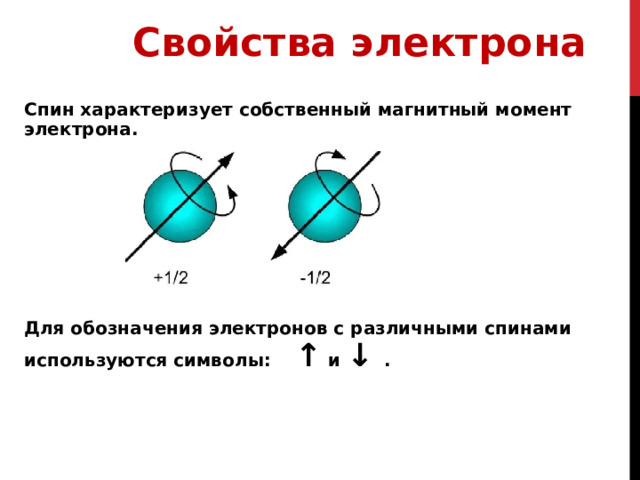
4.Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/ 2.
Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином.
Для обозначения электронов с различными спинами используются символы: ↑ и ↓ .
Свойства электрона
Спин характеризует собственный магнитный момент электрона.
Для обозначения электронов с различными спинами используются символы: ↑ и ↓ .
Спин характеризует собственный магнитный момент электрона.
Или по-другому отражает вращение вокруг собственной оси – по часовой стрелке или против
54

54
Заполнение атомных орбиталей электронами
Принцип Паули .
Правило Хунда.
Принцип устойчивости Клечковского.
При заполнении атомных орбиталей электронами соблюдаются три основные правила.
54

Правила заполнения энергетических уровней
1) Запрет Паули
- На одной АО могут находится не более, чем два электрона, которые должны иметь различные спины.
Разрешено
Запрещено!
В атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел.
54
54
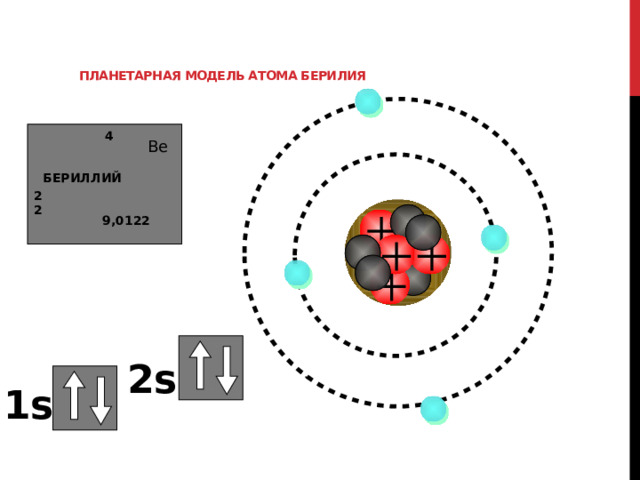
Планетарная модель атома берилия
4
Be
БЕРИЛЛИЙ
2
2
9,0122
Давайте рассмотрим составление электронно-графической формулы для атома берилия
На 1 уровне всего одна S орбиталь и она может вместить максимум 2 электрона. При этом по правилу Паули у них могут быть только противоположные спины.
Обозначаем это так
Для второго уровня остается только 2 электрона, которые можно расположить только единственным образом
2s
1s
72
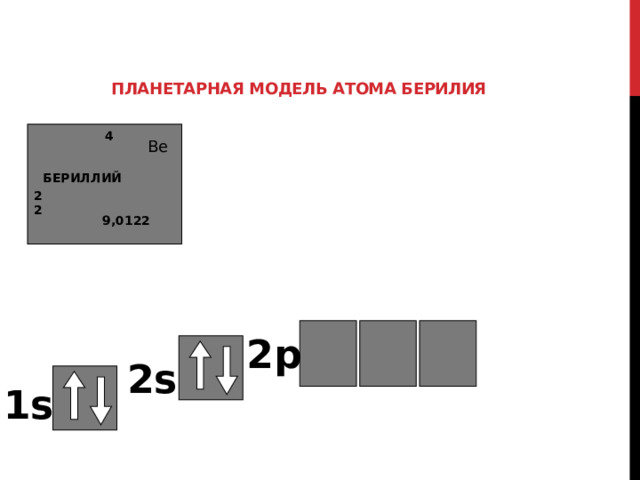
Планетарная модель атома берилия
4
Be
БЕРИЛЛИЙ
2
2
9,0122
Необходимо также помнить о наличии 3-х п – орбиталей на 2 ЭН. УРОВНЕ, но в данном примере элекронов здесь не будет
Однако при заполнении p – подуровня необходимо руководствоваться правилом Хунда
2p
2s
1s
73
73
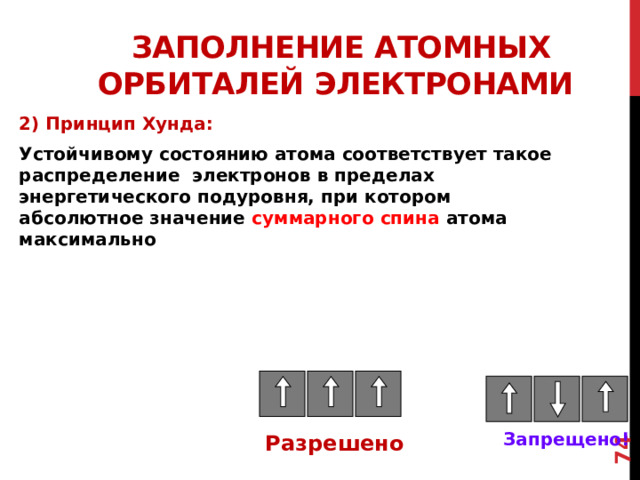
Заполнение атомных орбиталей электронами
2) Принцип Хунда:
Устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально
Запрещено!
Разрешено
73

Правила заполнения энергетических уровней
73
Правило Хунда
Если, например, в трех
p -ячейках атома азота необходимо распределить три электрона, то они будут располагаться каждый в отдельной ячейке, т.е. размещаться на трех разных
p -орбиталях:
в этом случае суммарный спин равен +3/2 , поскольку его проекция равна
m s = +1/2+1/2+1/2 =+3/2 .
Эти же три электрона не могут быть расположены
таким образом,
потому что тогда проекция суммарного спина
m s = +1/2-1/2+1/2 =+1/2 .
Запрещено!
Разрешено

73
Заполнение атомных орбиталей электронами
3) Принцип устойчивости Клечковского.
АО заполняются электронами в порядке повышения энергии их энергетических уровней.
Эмперически выведенный ряд Клечковского
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d
73

73
Принцип устойчивости Клечковского.
В первую очередь заполняются те орбитали, у котор ых min сумма (n+l).
При равных суммах (n+l) заполняются те, у которых n меньше
1 s s p s p s d ...
4 s (4+0=4)
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d

73
Электроная формула
атома
С помощью электронных формул (конфигураций) можно показать распределение электронов по энергетическим уровням и подуровням :
1s 2 2s 2 2p 6 3s 2 3p 6
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d
… Так 20 электронов кальция будут заселять орбитали следующим образом
На любой с – орбитали может находиться только 2 электрона
Так мы заселяем первые 18 электронов. Чтобы расположить последние 2, необходимо обратиться к ряду клечковского . Мы видим, что вначале идет заполнение 4с орбитали, а затем уже 3д. Поэтому здесь мы можем написать ноль, но принято не писать этот подуровень вообще
3d 0
4s 2
73

73
электронная формула
Пример: Углерод, №6 , период II , группа IVA .
С +6 ) )
2 4
Электронная формула: 1s 2 2s 2 2p 2
Схема электронного
строение атома
Схема электронного строение атома углерода мы уже разобрали ,
поэтому посмотрим теперь как распределяются 4 внешних электрона внутри 2 внешнего уровня
73

73
Алгоритм составления электронных формул.
- Записываем знак химического элемента и заряд ядра его атома (№ элемента).
- Определяем количество энергетических уровней (№ периода) и количество электронов на каждом уровне.
- Составляем электронную формулу, учитывая номер уровня, вид орбитали и количество электронов на ней (принцип Клечковского).
73

Алгоритм составления электронных формул.
73
НЕСПАРЕННЫЙ ЭЛЕТРОН
Н + 1
1 S 1
n=1
S
1
Одиночный электрон на незавершенной оболочке
Нe + 2
1 S 2
n=1
S
2
2 спаренных электрона на завершенной оболочке
Поскольку внешние электроны располагаются на S – орбитали- их назыввают S -ЭЛЕМЕНТАМИ
S - элементы
73
2 период
73
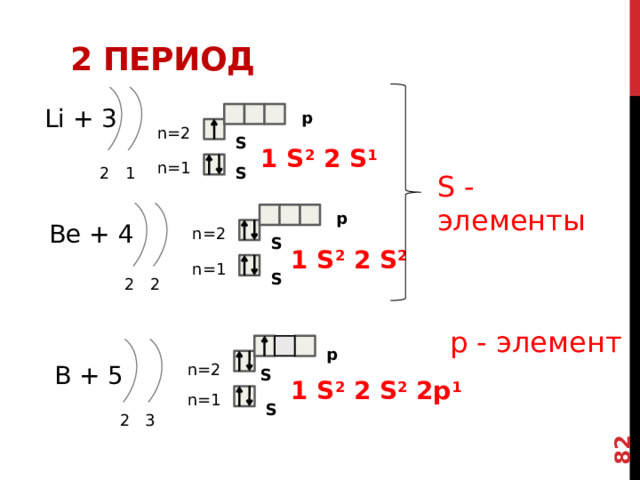
Li + 3
p
n=2
S
1 S 2 2 S 1
n=1
S
2 1
S - элементы
p
Be + 4
n=2
S
1 S 2 2 S 2
n=1
S
2 2
p -элементами называют химические элементы, в атомах которых электрон с наивысшей энергией занимает p -орбиталь.
ИЛИ ПО-ДРУГОМУ, ПОСЛЕДНЕЙ ЗАПОЛНЯЕТСЯ p -орбиталь
р - элемент
p
n=2
B + 5
S
1 S 2 2 S 2 2p 1
n=1
S
2 3
73
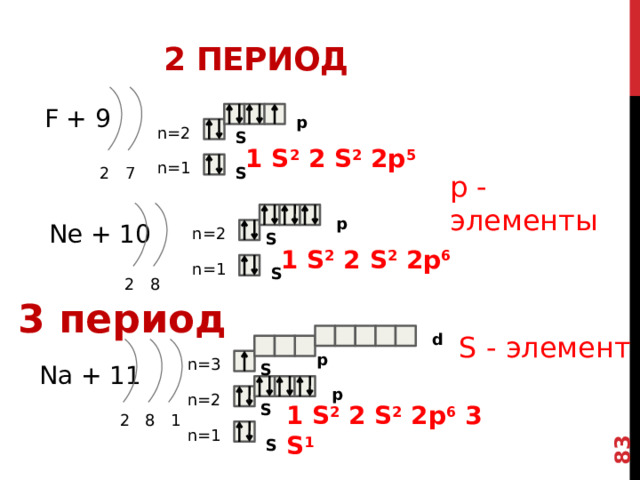
2 период
73
F + 9
p
n=2
S
1 S 2 2 S 2 2p 5
n=1
2 7
S
р - элементы
p
Ne + 10
n=2
S
1 S 2 2 S 2 2p 6
n=1
S
2 8
3 период
ДЛЯ ФТОРА ЗАСЕЛЕНИЕ p -орбиталИ ИДЕТ В СООТВЕТСТВИИ С ПРАВИЛОМ ХУНДА
ТАКИМ ОБРАЗОМ, МЫ ВИДИМ, ЧТО АТОМ НАТРИЯ ИМЕЕТ 1 НЕСПАРЕННЫЙ ЭЛЕКТРОН НА ВНЕШНЕЙ С-ОРБИТАЛИ, ТАК ЖЕ КАК ЛИТИЙ И ВОДОРОД.
S - элемент
d
p
n=3
Na + 11
S
p
n=2
S
1 S 2 2 S 2 2p 6 3 S 1
2 8 1
n=1
S
73

73
ТО МЫ УВИДИМ, ЧТО Строение внешних энергетических уровней периодически повторяется ,
А ПОСКОЛЬКУ ИМЕННО ВНЕШНИЕ ЭЛЕКТРОНЫ ОТВЕЧАЮТ ЗА ХИМИЧЕСКИЕ СВОЙСТВА ХЭ, ТО И СВОЙСТВА БУДУТ ТАКЖЕ ПЕРИОДИЧЕСКИ ПОВТОРЯТЬСЯ.
ТАК Li Na К Rb – ЭТО АКТИВНЫЕ МЕТАЛЛЫ, КОТОРЫЕ ОБЛАДАЮТ ВОССТАНОВИТЕЛЬНЫМИ СВОЙСТВАМИ БЛАГОДАРЯ ВНЕШНЕМУ ЭЛЕКТРОНУ С ВЫСОКОЙ ЭНЕРГИЕЙ И СЛАБО СВЯЗАННОМУ С ЯДРОМ.
73

73
Выводы
- Строение внешних энергетических уровней периодически повторяется , поэтому периодически повторяются и свойства химических элементов.

73
Состояния атомов
Атомы устойчивы лишь в некоторых стационарных состояниях, которым отвечают определенные значения энергии.
Наинизшее из разрешённых энергетических состояний атома называется основным , а все остальные — возбуждёнными .
Возбужденные состояния атомов образуются из основного состояния при переходе одного или нескольких электронов с занятых орбиталей на свободные (или занятые лишь
1 электроном)

Строение атома марганца:
Mn +25 ) ) ) )
2 8 13 2
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 4p 0
d - элемент
4s
3d
2s
2p
3p
1s
3s
основное состояние атома
3d
4p
4s
возбужденное состояние атома
73

73
Значение переходных металлов для организма и жизнедеятельности.
Без переходных металлов наш организм существовать не может.
Железо – это действующее начало гемоглобина.
Цинк участвует в выработке инсулина. Кобальт – центр витамина В-12.
Медь, марганец и молибден, а также некоторые другие металлы входят в состав ферментов.

Ионы
73
Ион – положительно или отрицательно заряженная частица, образованная при отдаче или присоединении атомом или группой атомов одного или нескольких электронов
Катион – (+) заряженная частица, Kat
Анион – (-) заряженная частица, An
ЗДЕСЬ ЖЕ МНЕ БЫ ХОТЕЛОСЬ ПОГОВОРИТЬ ОБ ЭЛЕКТРОННОМ СТРОЕНИИ ИОНОВ
73
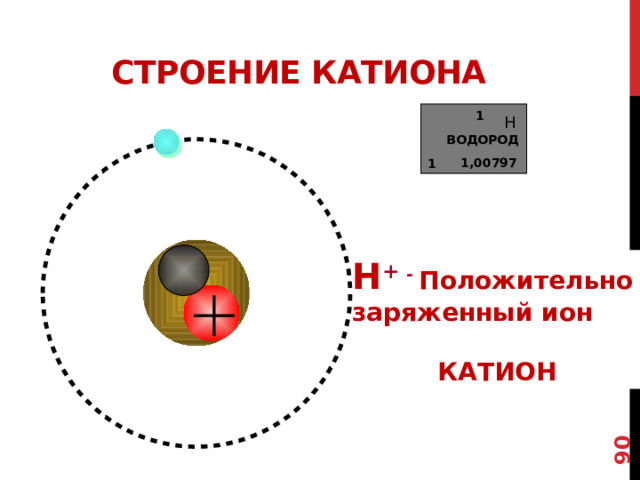
Строение катиона
73
1
Н
ВОДОРОД
1,00797
1
Н + - Положительно
заряженный ион
КАТИОН
В ОСНОВНОМ СОСТОЯНИИ ВОДОРОД ИМЕЕТ 1 ЭЛЕТРОН И 1 ПРОТОН
90
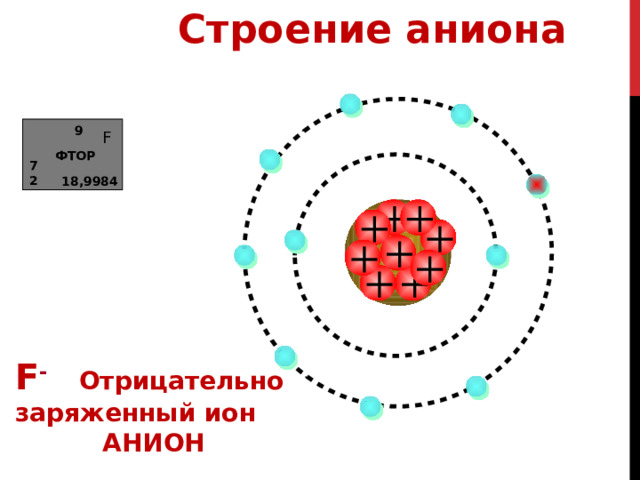
Строение аниона
9
F
ФТОР
7
2
18,9984
АТОМ ФТОРА СТРЕМИТЬСЯ К ЗАВЕРШЕНИЮ СВОЕГО ВНЕШНЕГО ЭНЕРГЕТИЧЕСКОГО СЛОЯ И ТАКИМ ОБРАЗОМ ПРИНИМАЕТ 1 ЭЛЕКТРОН ИЗВНЕ
ПРИ ЭТОМ ОБРАЗУЕТСЯ АНИОН ФТОРА С ЗАРЯДОМ -1
F - Отрицательно
заряженный ион
АНИОН
91

91
ХАРАКТЕРИСТИКИ ЭЛЕМЕНТА
- Положение в ПСХЭ (порядковый номер, относительная атомная масса, период (какой), группа и подгруппа).
- Состав ядра атома, общее число электронов в электронной оболочке, схема строения электронной оболочки.
- Металл, неметалл, переходный металл.
- Сравнение металлических (неметаллических) свойств с соседними по периоду и подгруппе элементами.
- Электроотрицательность, то есть сила притяжения электронов к ядру.



















































































































