|
Для проверки полученных знаний учитель предлагает выполнить: 2) Практическую работу по теме: «Периодическая система и периодический закон. Строение атома».
Практическая работа по теме: «Периодическая система и периодический закон. Строение атома» I вариант Тестовое задание 1. В периодах слева направо происходит…. 1) усиление металлических свойств простых веществ;
2) ослабление металлических свойств простых веществ;
3) уменьшение радиуса атомов;
4) увеличение радиуса атомов;
5) уменьшение количества энергетических уровней;
6) увеличение количества энергетических уровней. 2. Современная формулировка периодического закона гласит: 1) «Свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от величины заряда ядра атома или от порядкового номера элемента»; 2) «Свойства простых тел, а также формы и свойства соединений элементов, находятся в периодической зависимости от величины атомных весов элементов». 3. Количество электронов на внешнем энергетическом уровне у атомов химических элементов совпадает с номером группы, если: 1) это элементы побочной подгруппы; 3) это элементы главной подгруппы; 2) это элементы I-II групп; 4) это элементы III-YIII групп. 4. На внешнем энергетическом уровне атома серы находятся… 1) два s-электрона;
2) два s- и один р-электрон;
3) два s- и два р-электрона;
4) два s- и три р-электрона;
5) два s- и четыре р-электрона.
5. В ряду элементов F - Cl - Br - I при переходе от фтора к йоду происходит:
1) уменьшение металлических свойств; 2) усиление металлических свойств; 3) увеличение количества энергетических уровней; 4) уменьшение количества энергетических уровней; 5) уменьшение радиуса атомов; 6) увеличение радиуса атомов. 6. Название химического элемента, электронная формула атома которого
1s22s22p63s23p64s1 7. Металлами являются элементы: 1) Сo; 2) Al; 3) As; 4) Ru; 5) I. 8. Основная масса атома: 1) равномерно распределена по его объему; 2) заключена в его ядре; 3) заключена в его электронах; 4) находится в пространстве между ядром и электронами.
9. Изотопы отличаются числом … 1) протонов, 2) электронов, 3) нейтронов, 4) энергетических уровней. 10. Порядковый номер элемента, для которого представлено распределение электронов по 3 и 4 энергетическим уровням … 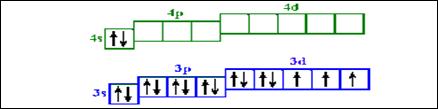
Практическая работа по теме: «Периодическая система и периодический закон. Строение атома» II вариант Тестовое задание 1. Таблица периодической системы химических элементов состоит:
1) из групп и периодов;
2) из подгрупп и периодов; 3) из подгрупп и рядов; 4) из групп и рядов. 2. Главной подгруппой в периодической системе химических элементов является: 1) та подгруппа, которая начинается элементами малых периодов; 2) та подгруппа, которая начинается элементами четных рядов больших периодов; 3) та подгруппа, которая начинается элементами нечетных рядов больших периодов 3. В побочных подгруппах чаще всего встречаются: 1) неметаллы; 2) металлы; 3) амфотерные элементы. 4. Изотопы содержат одинаковое число…. 1) электронов;
2) нейтронов;
3) протонов;
4) протонов и нейтронов.
5. Относительная молекулярная масса серной кислоты, химическая формула которой H2SО4 составляет: 1) 89; 2) 98; 3) 49. 6. Неметаллами являются элементы: 1) Si 2) Са 3) Ag 4) Al 5) N
7. Амфотерными элементами являются: 1)Be 2) Mg 3) Cr 4) Ba 8. Число энергетических уровней в атоме соответствует…
1) номеру группы; 2) номеру периода; 3) валентности атома; 4) числу внешних электронов
9. Порядковый номер элемента, для которого представлено распределение электронов по 3 и 4 энергетическим уровням…
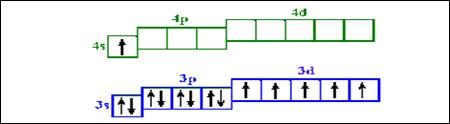 10. В главных подгруппах сверху вниз происходит…. 1) усиление металлических свойств простых веществ;
2) усиление неметаллических свойств простых веществ;
3) уменьшение радиуса атомов;
4) увеличение радиуса атомов;
5) уменьшение количества энергетических уровней;
6) увеличение количества энергетических уровней.
| 







 Вот как он описывает один из них: «Я взял некоторое количество воздуха испорченного дыханием мыши, которая в нем погибла; разделив его на две части, я ввел одну в сосуд, погруженный в воду, в другую же часть его, также заключенную в сосуд с водой, я ввел ветку мяты. Это было сделано в начале августа 1771 года. Через 8-9 дней я нашел, что мышь прекрасно могла жить в той части воздуха, в которой росла ветка мяты, но моментально погибла в другой его части. В течение 7-ми дней пребывания в сосуде с испорченным воздухом побег вырос почти на 3 дюйма на старых ветвях».
Вот как он описывает один из них: «Я взял некоторое количество воздуха испорченного дыханием мыши, которая в нем погибла; разделив его на две части, я ввел одну в сосуд, погруженный в воду, в другую же часть его, также заключенную в сосуд с водой, я ввел ветку мяты. Это было сделано в начале августа 1771 года. Через 8-9 дней я нашел, что мышь прекрасно могла жить в той части воздуха, в которой росла ветка мяты, но моментально погибла в другой его части. В течение 7-ми дней пребывания в сосуде с испорченным воздухом побег вырос почти на 3 дюйма на старых ветвях».



















