
Республиканский медицинский лицей-интернат
ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. ПОВТОРЕНИЕ
Разработано учителем химии
Метейко Е.В.

ПЛАН ТЕМЫ
- Понятие об оксидах
- Понятие о кислотах
- Понятие о солях
- Понятие об основаниях
- Классификация оксидов. Общие свойства
- Классификация кислот. Общие химические свойства кислот
- Химические свойства оснований
- Химические свойства солей

ПОНЯТИЕ ОБ ОКСИДАХ
- Оксиды – это ….. соединения любого химического элемента с ……. .
- Название каждого оксида состоит из двух слов в именительном падеже. Первое слово – название химического элемента, а второе – ….. . Если элемент имеет переменную валентность, ее указывают в круглых скобках после названия элемента:
CuO – купрум (II) оксид меди, CO 2 – карбон (IV) оксид , СаО – кальций оксид.

ВЫБЕРИ ЛИШНЕЕ ВЕЩЕСТВО
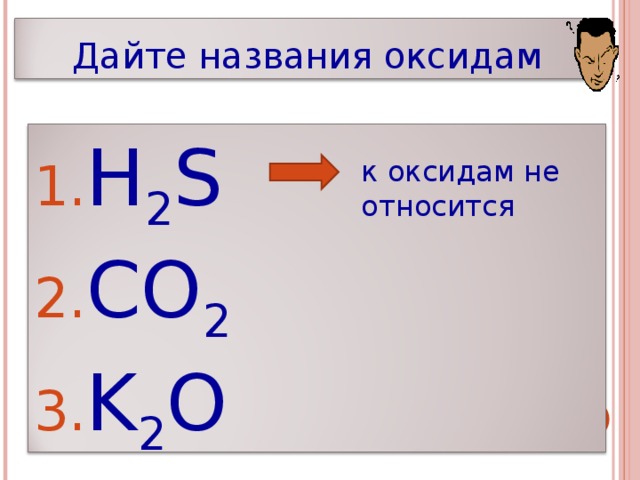
Дайте названия оксидам
к оксидам не относится

ИЗ ПРЕДЛОЖЕННЫХ ВЕЩЕСТВ ВЫПИШИ ОКСИДЫ И НАЗОВИ ИХ
NO 2 CaSO 4 B а (OH) 2 NaCl SO 3 KNO 3 Al 2 O 3 MgO H 2 S

НАЗОВИ ОКСИДЫ

НАЗОВИ ОКСИДЫ (проверь себя)
- NO 2 - нитроген( IV ) оксид
- SO 3 - сульфур( VI ) оксид
- Al 2 O 3 – алюминий оксид
- MgO – магний оксид

ПОНЯТИЕ О КИСЛОТАХ
- Кислоты – это сложные вещества, которые содержат атомы …. , способные замещаться металлом, и ….. остаток.
Валентность кислотного остатка равна количеству атомов …… в кислоте
H Cl І H 3 PO ІІІ
кислотный остаток
4
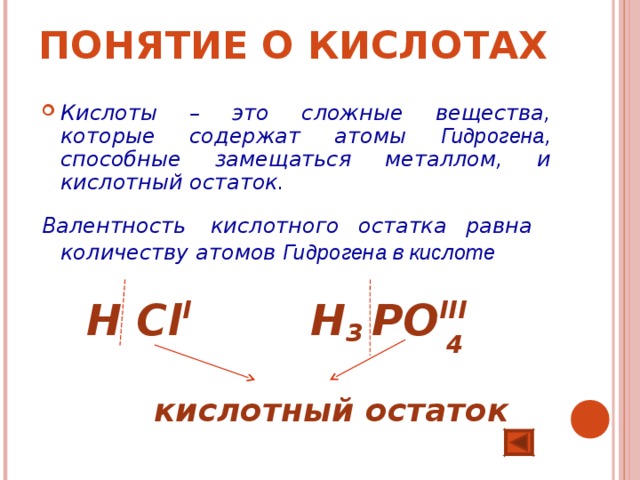
ПОНЯТИЕ О КИСЛОТАХ
- Кислоты – это сложные вещества, которые содержат атомы Гидрогена , способные замещаться металлом, и кислотный остаток.
Валентность кислотного остатка равна количеству атомов Гидрогена в кислоте
H Cl І H 3 PO ІІІ
кислотный остаток
4

ФИЗИЧЕСКИЕ СВОЙСТВА КИСЛОТ
- Неорганические кислоты, в основном – жидкости.
- Кислоты бесцветны, плотность всех кислот больше единицы.
- Кислоты хорошо растворяются в воде (за исключением некоторых, в частности кремниевой).
!!! Правила приготовления растворов кислот: кислоту льют в воду (не наоборот!) небольшими порциями, помешивая стеклянной палочкой .

ПОНЯТИЕ О СОЛЯХ
- Соли – это сложные вещества, образованные атомами металлов и кислотными остатками.
Al(NO 3 ) 3 N aCl CrSO 4
Физические свойства солей
При нормальных условиях соли – твердые вещества.
Это тугоплавкие кристаллические вещества.
По способности растворяться в воде соли делят на растворимые, малорастворимые и нерастворимые.

ПОНЯТИЕ ОБ ОСНОВАНИЯХ
- Основания – это сложные вещества, образованные металлическим элементом и гидроксильными группами.
- Количество гидроксильных групп совпадает с валентностью металла.
KOH, Mg(OH) 2 , Al(OH) 3
Физические свойства оснований
Основания – твердые вещества, преимущественно белого цвета, хотя встречаются и других цветов.
По способности растворяться в воде основания разделяют на растворимые, или щелочи, и нерастворимые.
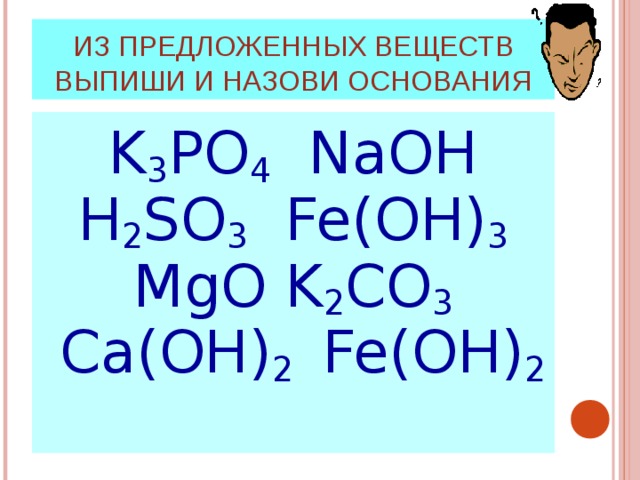
ИЗ ПРЕДЛОЖЕННЫХ ВЕЩЕСТВ ВЫПИШИ И НАЗОВИ ОСНОВАНИЯ
K 3 PO 4 NaOH H 2 SO 3 Fe(OH) 3 MgO K 2 CO 3 Ca(OH) 2 Fe(OH) 2

ИЗ ПРЕДЛОЖЕННЫХ ВЕЩЕСТВ ВЫПИШИ И НАЗОВИ ОСНОВАНИЯ
K 3 PO 4 NaOH H 2 SO 3 Fe(OH) 3 MgO K 2 CO 3 Ca(OH) 2 Fe(OH) 2

ПРОВЕРЬ СЕБЯ
- NaOH – натрий гидроксид
- Fe(OH) 3 – феррум( III) гидроксид Ca(OH) 2 – кальций
гидроксид
- Fe(OH) 2 - феррум (II) гидроксид
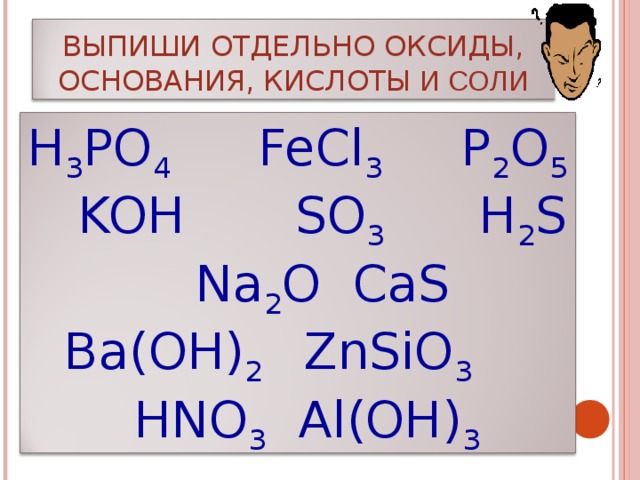
ВЫПИШИ ОТДЕЛЬНО ОКСИДЫ, ОСНОВАНИЯ, КИСЛОТЫ И СОЛИ
H 3 PO 4 FeCl 3 P 2 O 5 KOH SO 3 H 2 S Na 2 O CaS Ba(OH) 2 ZnSiO 3 HNO 3 Al(OH) 3
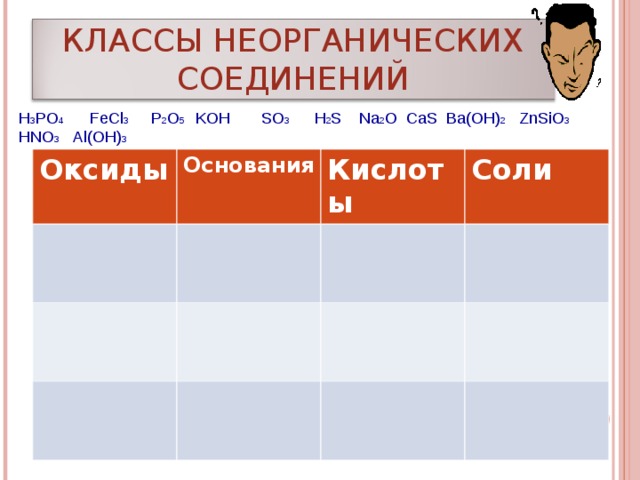
КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
H 3 PO 4 FeCl 3 P 2 O 5 KOH SO 3 H 2 S Na 2 O CaS Ba(OH) 2 ZnSiO 3 HNO 3 Al(OH) 3
Оксиды
Основания
Кислоты
C оли
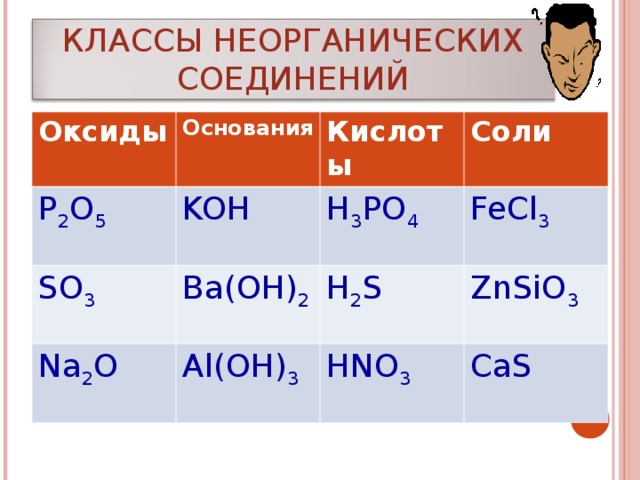
КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Оксиды
Основания
P 2 O 5
KOH
SO 3
Кислоты
H 3 PO 4
C оли
Ba(OH) 2
Na 2 O
Al(OH) 3
FeCl 3
H 2 S
ZnSiO 3
HNO 3
CaS

КЛАССИФИКАЦИЯ ОКСИДОВ. ОБЩИЕ СВОЙСТВА
В зависимости от химических свойств различают:
- основные оксиды (например, оксид натрия Na 2 O, оксид меди(II) CuO): оксиды металлов, степень окисления которых I—II;
- кислотные оксиды (например, оксид серы(VI) SO 3 , оксид азота(IV) NO 2 ): оксиды металлов со степенью окисления V—VII и оксиды неметаллов;
- амфотерные оксиды (например, оксид цинка ZnO, оксид алюминия Al 2 О 3 ): оксиды металлов со степенью окисления III—IV и исключения (ZnO, BeO, SnO, PbO);
- Несолеобразующие оксиды : оксид углерода(II) СО, оксид азота(I) N 2 O, оксид азота(II) NO.

ХИМИЧЕСКИЕ СВОЙСТВА: ОСНОВНЫЕ ОКСИДЫ
1. Основный оксид + кислота = соль + вода
2 . Сильноосновный оксид + вода = щелочь
3. Сильноосновный оксид + кислотный оксид = соль
- CaO + Mn 2 O 7 = Ca(MnO 4 ) 2
- Na 2 O + CO 2 = ….
4. Основный оксид + водород = металл + вода
- CuO + H 2 = … + …
- Примечание: металл менее активный, чем алюминий.

ХИМИЧЕСКИЕ СВОЙСТВА: ОСНОВНЫЕ ОКСИДЫ
1. Основный оксид + кислота = соль + вода
- CuO + H 2 SO 4 = CuSO 4 + H 2 O
2 . Сильноосновный оксид + вода = щелочь
3. Сильноосновный оксид + кислотный оксид = соль
- CaO + Mn 2 O 7 = Ca(MnO 4 ) 2
- Na 2 O + CO 2 = Na 2 CO 3
4. Основный оксид + водород = металл + вода
- CuO + H 2 = Cu + H 2 O
- Примечание: металл менее активный, чем алюминий.

ХИМИЧЕСКИЕ СВОЙСТВА: КИСЛОТНЫЕ ОКСИДЫ
1 . Кислотный оксид + вода = кислота
- SO 3 + H 2 O = …
- Некоторые оксиды, например SiO 2 , с водой не реагируют, поэтому их кислоты получают косвенным путём.
2. Кислотный оксид + основный оксид = соль
3. Кислотный оксид + основание = соль + вода
- SO 2 + 2NaOH = … +…
- Если кислотный оксид является ангидридом многоосновной кислоты, возможно образование кислых или средних солей:
- Ca(OH) 2 + CO 2 = … ↓ + H 2 O
- CaCO 3 + CO 2 + H 2 O = Ca(HCO 3 ) 2
4. Нелетучий оксид + соль1 = соль2 + летучий оксид
- SiO 2 + Na 2 CO 3 = Na 2 SiO 3 + CO 2 ↑

ХИМИЧЕСКИЕ СВОЙСТВА: КИСЛОТНЫЕ ОКСИДЫ
1 . Кислотный оксид + вода = кислота
- SO 3 + H 2 O = H 2 SO 4
- Некоторые оксиды, например SiO 2 , с водой не реагируют, поэтому их кислоты получают косвенным путём.
2. Кислотный оксид + основный оксид = соль
3. Кислотный оксид + основание = соль + вода
- SO 2 + 2NaOH = Na 2 SO 3 + H 2 O
- Если кислотный оксид является ангидридом многоосновной кислоты, возможно образование кислых или средних солей:
- Ca(OH) 2 + CO 2 = CaCO 3 ↓ + H 2 O
- CaCO 3 + CO 2 + H 2 O = Ca(HCO 3 ) 2
4. Нелетучий оксид + соль1 = соль2 + летучий оксид
- SiO 2 + Na 2 CO 3 = Na 2 SiO 3 + CO 2 ↑
![ХИМИЧЕСКИЕ СВОЙСТВА: АМФОТЕРНЫЕ ОКСИДЫ 1. При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства: ZnO + 2HCl = … + H 2 O 2. При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства: ZnO + 2KOH + H 2 O = K 2 [Zn(OH) 4 ] (в водном растворе) ZnO + CaO = CaZnO 2 (при сплавлении)](https://fsd.multiurok.ru/html/2017/10/31/s_59f8cbb4b0880/img24.jpg)
ХИМИЧЕСКИЕ СВОЙСТВА: АМФОТЕРНЫЕ ОКСИДЫ
1. При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства:
2. При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:
- ZnO + 2KOH + H 2 O = K 2 [Zn(OH) 4 ] (в водном растворе)
- ZnO + CaO = CaZnO 2 (при сплавлении)

КЛАССИФИКАЦИЯ КИСЛОТ
- бескислородные
- кислородосодержащие
- По основности — количество атомов водорода
- Одноосновные
- Двухосновные
- Трёхосновные
- Сильные — диссоциируют практически полностью, константы диссоциации больше 1·10−3 (HNO 3 );
- Слабые — константа диссоциации меньше 1·10−3 (H 2 S).
- Устойчивые (H 2 SO 4 );
- Неустойчивые (H 2 CO 3 ).
- Растворимые (H 2 SO 4 );
- Нерастворимые

КЛАССИФИКАЦИЯ КИСЛОТ
- бескислородные (HCl, H 2 S);
- кислородосодержащие (HNO 3 ).
- По основности — количество атомов водорода
- Одноосновные (HNO 3 );
- Двухосновные (H 2 SeO 4 );
- Трёхосновные (H 3 PO 4 ).
- Сильные — диссоциируют практически полностью, константы диссоциации больше 1·10−3 (HNO 3 );
- Слабые — константа диссоциации меньше 1·10−3 (H 2 S).
- Устойчивые (H 2 SO 4 );
- Неустойчивые (H 2 CO 3 ).
- Растворимые (H 2 SO 4 );
- Нерастворимые (H 2 SiO 3 )

ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
- Взаимодействие с оксидами металлов с образованием соли и воды:
2. Взаимодействие с основаниями с образованием соли и воды (реакция нейтрализации):
3. Взаимодействие с солями, если выпадает осадок или выделяется газ:
4. Сильные кислоты вытесняют более слабые из их солей:
5. Металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты (кроме азотной кислоты любой концентрации и концентрированной серной кислоты), если образующаяся соль растворима:
6. С азотной кислотой и концентрированной серной кислотами реакция идёт иначе:
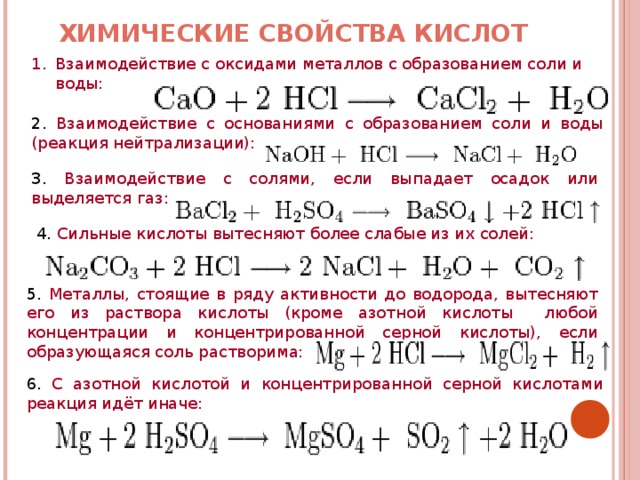
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
- Взаимодействие с оксидами металлов с образованием соли и воды:
2. Взаимодействие с основаниями с образованием соли и воды (реакция нейтрализации):
3. Взаимодействие с солями, если выпадает осадок или выделяется газ:
4. Сильные кислоты вытесняют более слабые из их солей:
5. Металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты (кроме азотной кислоты любой концентрации и концентрированной серной кислоты), если образующаяся соль растворима:
6. С азотной кислотой и концентрированной серной кислотами реакция идёт иначе:

КЛАССИФИКАЦИЯ ОСНОВАНИЙ
- Растворимые в воде основания (щёлочи):
- Практически нерастворимые в воде:
- По количеству гидроксильных групп в молекуле
- Однокислотные
- Двукислотные
- Трехкислотные

КЛАССИФИКАЦИЯ ОСНОВАНИЙ
- Растворимые в воде основания (щёлочи): LiOH, NaOH, KOH, Ca(OH) 2 , Ba(OH) 2 , Sr(OH) 2 , Ra(OH) 2 , CsOH, RbOH, FrOH
- Практически нерастворимые в воде: Mg(OH) 2 , Zn(OH) 2 , Cu(OH) 2 , Al(OH) 3 , Fe(OH) 3 , Be(OH) 2
- По количеству гидроксильных групп в молекуле
- Однокислотные (NaOH),
- Двукислотные (Сu(OH) 2 )
- Трехкислотные (Fe(OH) 3 )

ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ
- 1. Действие на индикаторы:
- лакмус —
- метилоранж —
- фенолфталеин —
- 2. Основание + кислота = Соль + вода . Примечание: реакция не идёт, если и кислота, и щёлочь слабые.
- 3. Щёлочь + кислотный или амфотерный оксид = соль + вода
- 4. Щёлочь + соль = (новое) основание + (новая) соль . Примечание: исходные вещества должны быть в растворе, а хотя бы один из продуктов реакции выпасть в осадок или мало растворяться.
- 5. Слабые основания при нагревании разлагаются :
- Cu(OH) 2 + Q = CuO + H 2 O

ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ
- 1. Действие на индикаторы:
- лакмус — синий,
- метилоранж — жёлтый,
- фенолфталеин — малиновый,
- 2. Основание + кислота = Соль + вода . Примечание: реакция не идёт, если и кислота, и щёлочь слабые.
- NaOH + HCl = NaCl + H 2 O
- 3. Щёлочь + кислотный или амфотерный оксид = соль + вода
- 2NaOH + SiO 2 = Na 2 SiO 3 + H 2 O
- 4. Щёлочь + соль = (новое) основание + (новая) соль . Примечание: исходные вещества должны быть в растворе, а хотя бы один из продуктов реакции выпасть в осадок или мало растворяться.
- Ba(OH) 2 + Na 2 SO 4 = BaSO 4 + 2NaOH
- 5. Слабые основания при нагреве разлагаются :
- Cu(OH) 2 + Q = CuO + H 2 O

ТИПЫ СОЛЕЙ
- Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла. Пример: , . ,
- Кислые соли — атомы водорода в кислоте замещены атомами металла частично. Они получаются при нейтрализации основания избытком кислоты. Пример: .
- Осно́вные соли — гидроксогруппы основания (OH-) частично замещены кислотными остатками. Пример: .
- Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами. Пример: .
- Смешанные соли — в их составе присутствует два различных аниона. Пример: .
- Гидратные соли (кристаллогидраты) — в их состав входят молекулы кристаллизационной воды. Пример: .
- Комплексные соли — в их состав входит комплексный катион или комплексный анион. Пример: .
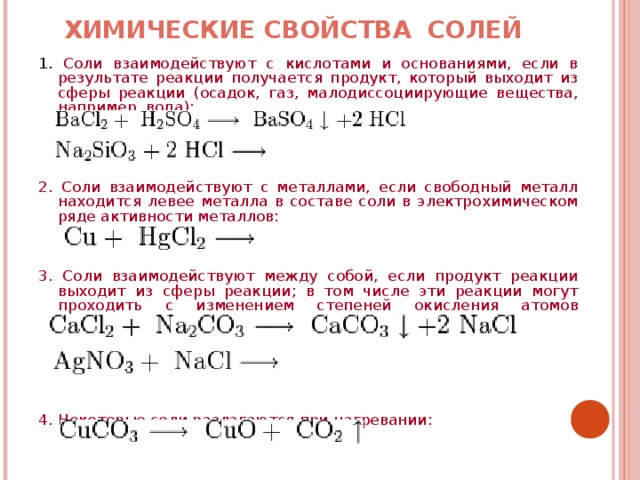
ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
1. Соли взаимодействуют с кислотами и основаниями, если в результате реакции получается продукт, который выходит из сферы реакции (осадок, газ, малодиссоциирующие вещества, например, вода):
2. Соли взаимодействуют с металлами, если свободный металл находится левее металла в составе соли в электрохимическом ряде активности металлов:
3. Соли взаимодействуют между собой, если продукт реакции выходит из сферы реакции; в том числе эти реакции могут проходить с изменением степеней окисления атомов реагентов:
4. Некоторые соли разлагаются при нагревании:

ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
1. Соли взаимодействуют с кислотами и основаниями, если в результате реакции получается продукт, который выходит из сферы реакции (осадок, газ, малодиссоциирующие вещества, например, вода):
2. Соли взаимодействуют с металлами, если свободный металл находится левее металла в составе соли в электрохимическом ряде активности металлов:
3. Соли взаимодействуют между собой, если продукт реакции выходит из сферы реакции; в том числе эти реакции могут проходить с изменением степеней окисления атомов реагентов:
4. Некоторые соли разлагаются при нагревании:
































![ХИМИЧЕСКИЕ СВОЙСТВА: АМФОТЕРНЫЕ ОКСИДЫ 1. При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства: ZnO + 2HCl = … + H 2 O 2. При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства: ZnO + 2KOH + H 2 O = K 2 [Zn(OH) 4 ] (в водном растворе) ZnO + CaO = CaZnO 2 (при сплавлении)](https://fsd.multiurok.ru/html/2017/10/31/s_59f8cbb4b0880/img24.jpg)































