ГОСУДАРСТВЕННОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ЛУГАНСКОЙ НАРОДНОЙ РЕСПУБЛИКИ
«СТАХАНОВСКИЙ УЧЕБНО-ВОСПИТАТЕЛЬНЫЙ КОМПЛЕКС №14»
(ГОУ ЛНР УВК №14 Г.Стаханова)
РАССМОТРЕНО
На заседании методического совета
Протокол от «___»___________2020 №
ЗАДАНИЯ
1(ШКОЛЬНОГО) ЭТАПА
РЕСПУБЛИКАНСКОЙ ОЛИМПИАДЫ
ПО ХИМИИ
8,9 КЛАССЫ
Составил
Щеглова Анастасия Анатольевна
2020г.
1 (школьный) этап
Республиканской олимпиады по химии
2020-2021 учебный год
8 класс
Фамилия__________________________________________________________
Имя______________________________________________________________
Дата______________________________________________________________
Задание 1. Простые вопросы
Вопросы с коротким ответом. Расчеты в лист ответов записывать не обязательно [макс. количество баллов - 20].
Какой объем при нормальных условиях занимают 88 г углекислого газа?
Чему равна относительная плотность аммиака по водороду
Рассчитайте массу кислорода, который можно получить при разложении 100 г 3,4%-ого раствора H2O2
Как известно, золото получают из золотоносного песка, промывая его проточной водой в наклонном желобе. Песок выносится водой, а более тяжелые крупинки золота оседают на дне желоба. Назовите способ разделения смесей, который используется
Укажите число, равное сумме коэффициентов в уравнении разложения хлората калия (бертолетовой соли) при нагревании
Допустим, что единицей измерения относительных атомных масс принята ¼ массы атома 4Не. Что произойдет с массой 1 моль вещества?
Какова молярная масса дихромата аммония (NH4)2Cr2O7
Укажите тип химической реакции: Cl2 + Na2S = 2NaCl + S
Рассчитайте массовую долю кислорода в этаноле C2H5OH
Установите валентность хлора в соединении Cl2O
Задание 2. Маленькие задачи
Вопросы, требующие предварительного решения. Каждый правильный ответ – 4 балла [макс. количество баллов - 20].
В темной-темной комнате, в черном-черном шкафу, на черной-черной полке стояла большая-пребольшая запечатанная бутыль, а в бутыли – смесь двух газов, бесцветного (самое легкое простое вещество) и желто-зеленого. Пришли люди в черной-черной одежде, достали бутыль с полки, поставили на черный-черный стол и... включили свет! Опишите, что было дальше. Ответ подтвердите уравнением химической реакции.
В баллоне с углекислым газом появилась маленькая дырочка и газ начал выходить наружу. Рассчитайте, сколько времени нужно, чтобы весь газ «вылетел», если его начальная масса была 1 кг, а скорость с которой газ покидал баллон равна 1 000 000 000 молекул в секунду.
Хлорное железо, которое используется для травления стали (очищения ее поверхности от продуктов коррозии перед покрытием стальных изделий слоем защитного металла) состоит из атомов железа и хлора и его относительная молекулярная масса 162,5. Определите:
а) химическую формулу этого вещества;
б) валентности хлора и железа в этом соединении;
в) вычислите массовые доли каждого элемента в данном соединении.
4. Напишите уравнения реакций, иллюстрирующие химические свойства кислорода и способы его получения, которые соответствуют приведенным схемам:
Простое вещество + простое вещество =
Простое вещество = простое вещество
Сложное вещество = простое вещество + сложное вещество
Сложное вещество = простое вещество + сложное вещество + сложное вещество
5. Оксиды относятся к наиболее распространенным веществам на нашей планете. Им принадлежит первенство во всех оболочках Земли: атмосфере (углекислый газ, вода и др.); литосфере (кремнезем); гидросфере (вода). Составьте формулу оксида азота, если известно, что массовая доля азота в нем 63,64%. Укажите валентность азота в этом оксиде.
Задание 3. Внимательно рассмотрите рисунок и выполните задания [макс. количество баллов - 10].
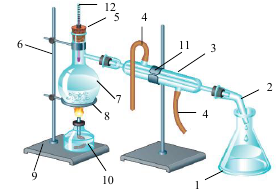
а) назовите химическое оборудование и химическую посуду, использованную в данной установке;
б) назовите процесс, который можно осуществить при помощи данного прибора;
в) укажите природу данного процесса (химический или физический);
г) приведите два примера смесей веществ, которые можно разделить при помощи данной установки.
Ответ
8 класс
Задание 1. [макс. количество баллов - 20].
44,8л
8,5
1,6 г
отстаивание
7
не изменится
252
Реакция замещения
0,348 или 34,8%
I
Задание 2. [макс. количество баллов - 20].
1. Ответ:
1)Газы, вступившие в реакцию: водород Н2 и хлор Сl2 2б
2)Взаимодействие водорода и хлора при ярком освещении происходит со взрывом реакционной смеси. 1б
3)Уравнение реакции образования хлороводорода: Н2+ Сl2 = 2НСl 1б
2. Решение:
N (CO2) =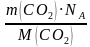 =
= 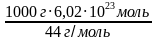 = 136, 818 ∙ 1023 молекул 2б
= 136, 818 ∙ 1023 молекул 2б
Определим время выхода газа
t= 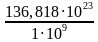 = 1,368 ∙ 1016 секунд = 2,28 ∙ 1014 минут = 3,8 ∙1012 часов = 1,583 ∙ 1011 суток = 4,336 ∙ 108 лет = 4,336 ∙ 106веков… 2б
= 1,368 ∙ 1016 секунд = 2,28 ∙ 1014 минут = 3,8 ∙1012 часов = 1,583 ∙ 1011 суток = 4,336 ∙ 108 лет = 4,336 ∙ 106веков… 2б
3. Решение:
Выведение химической формулы вещества:Ar (Fe)= 56, Ar(Cl)= 35,5
Пусть число атомов хлора равно х, тогда 56+3x = 162, 5; x=3; формула - FeCl3
Валентность Fe – III, Cl – I.
w (Fe) = 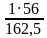 = 0,345 или 34,5%
= 0,345 или 34,5%
w(Cl) = 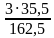 = 0,655 или 65, 5%
= 0,655 или 65, 5%
Вариант решения:
2H2+ O2 = 2H2O 1б
3O2= 2O3 1б
2KNO3= O2 + 2KNO2 1б
2KMnO4= O2 + K2MnO4 + MnO2 1б
Решение:
w(О)=100–63,64=36,36% 1б
Выведение формулы оксида NxOy
X:Y= 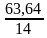 :
: 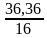 = 4,546: 2,2725 = 2:1 2б
= 4,546: 2,2725 = 2:1 2б
ФормулаN2O, валентность N – I 1б
Задание 3. [макс. количество баллов - 10].
а) 1 – колба плоскодонная; 2 – аллонж; 3 – холодильник с водяным охлаждением (Либиха); 4 – резиновые трубки для притока и оттока воды; 5 – резиновая пробка; 6 – стержень штатива; 7 – круглодонная колба; 8 – кольцо для штатива; 9 – подставка штатива; 10 – спиртовка; 11 – лапка держателя для штатива; 12 – термометр. 6б
б) дистилляция (перегонка) 1б
в) физический процесс 1б
г) дистилляция воды; разделение смеси спирта и воды 2б
1 (школьный) этап
Республиканской олимпиады по химии
2020-2021 учебный год
9 класс
Фамилия_____________________________________________________
Имя_________________________________________________________
Дата_________________________________________________________
Задание 1. Простые вопросы
Вопросы с коротким ответом. Расчеты в лист ответов записывать не обязательно [макс. количество баллов - 20].
Укажите сумму коэффициентов в уравнении реакции, протекающей по схеме: Cl2 + Br2 + KOH → KCl + KBrO3 + H2O
Укажите, какие кристаллические решетки в бинарном соединении кремния и углерода карборунде (очень твердый и прочный материал, который используют для шлифования и огранки драгоценных камней)
Напишите электронную формулу атома химического элемента, химическая формула высшего оксида которого ЕО2
Назовите автора теории электролитической диссоциации
Рассчитайте массу кислорода, какую можно получить из 100 г 3,4 % раствора перекиси водорода
Назовите формулу вещества, выступающего в качестве окислителя в реакции: CuS + O2 = Cu + SO2
Укажите соотношения масс растворенного вещества и растворителя в 25% - ном растворе
Элемент Е образует высший оксид состава Е2О5. Укажите формулу соответствующей кислоты
На разложение оксида ртути (II), которое происходит по термохимическому уравнению 2HgO = 2Hg + O2; ΔH0 = + 167 кДж, потратили 33, 4 кДж теплоты. Рассчитайте массу металла, полученного в этой реакции
Укажите оксид азота, в котором содержится 36,84% азота.
Задание 2. Маленькие задачи
Вопросы, требующие предварительного решения. Каждый правильный ответ – 4 балла [макс. количество баллов - 20].
1. Доводилось ли Вам читать на упаковках продуктов питания срок их годности? Наверняка! Там стоит дата изготовления и срок хранения при определенной температуре. Но не всегда удается хранить продукты при рекомендованной температуре. Итак, есть торт с кремом, срок хранения которого 3 суток при температуре + 20C. Определите, как долго этот торт можно хранить при температуре+220C, если температурный коэффициент реакции, по которой торт становится непригодным для употребления, равен 3.
2.Оксид одновалентного металла массой 1,55 г полностью прореагировал с серной кислотой, при этом образовалось 3,55 г соли. Определите неизвестный металл и установите молекулярную формулу соли, о которой идет речь в задаче. Запишите структурную формулу соли.
3. Закончите уравнение химической реакции, расставьте коэффициенты любым способом, укажите окислитель и восстановитель
K2CrO4 + Zn + H2SO4 (разб.) = K2SO4+ ZnSO4 + Cr2(SO4)3 + …
4. Дайте ответы на предложенные задания:
А. Определите химический элемент и заряд частицы, которая образован: а) ядром с зарядом + 6 и шестью электронами; б) ядром с зарядом + 9 и десятью электронами; в) ядром с зарядом + 12 и десятью электронами.
Б. Определите заряд иона, образовавшегося: а) в результате потери атомом четырех электронов; б) в результате присоединения атомом трех электронов; в) в результате потери ионом с зарядом +1 трех электронов; г) в результате присоединения ионом с зарядом +1 трех электронов; д) в результате потери ионом с зарядом – 2 четырех электронов.
Ответы
9 класс
Задание 1. [макс. количество баллов - 20].
1. 36
2. атомные
3. 1s22s22p63s23p4
4. Сванте Август Аррениус
5. 1,6 г
6. O2
7. 1:3
8. Н3ЕО4
9. 80,4 г
10. N2O3
Задание 2.
[макс. количество баллов - 20].
1. Решение:
По уравнению Вант-Гоффа:
V2 = V1∙ 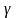 (t2-t1) / 10, где
(t2-t1) / 10, где
V1 – скорость реакции (рекомендованная); V2 – скорость реакции в новых условиях хранения; Y – температурный коэффициент; t1 – температура хранения (рекомендованная, написанная на упаковке); t2 – температура хранения в новых условиях хранения. 1б
Т.е. : t1 = + 20C; t2 = +220C; температурный коэффициент γ = 3
V2 / V1 = 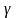 (22 - 2) / 10 = 32 = 9 раз. 2б
(22 - 2) / 10 = 32 = 9 раз. 2б
Значит, если хранить торт при температуре +220C вместо + 20C, то он может храниться в 9 раз меньше времени, чем указано на упаковке:
3 суток = 72 часа, тогда 72/9 = 8 часов. 1б
2. Решение:
Уравнение реакции: Me2O + H2SO4 = Me2SO4 + H2O 1б
Пусть Ar(Ме) = х, тогда 2б
Мr(Me2O) = 2х + 16 г/моль, Мr(Me2SO4) = 2х + 96
1,55(2х + 96) = 3,55(2х + 16)
3,1х + 148,8 = 7,1х + 56,8
3,1х – 7,1х = 56,8 – 148,8
– 4х = – 92
х = 23 – химический элемент натрий (Na)
Молекулярная формула соли – Na2SO4 (сульфат натрия) 1б
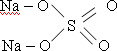 Структурная формула: 1б
Структурная формула: 1б
3. Решение:
2 K2CrO4 + 3 Zn + 8 H2SO4 (разб.) = 2 K2SO4+ 3 ZnSO4 + Cr2(SO4)3 + 8 H2O 1б
2 CrO42- + 3 Zn + 16 H+ = 3 Zn2+ + 2 Cr3+ + 8 H2O 2б
CrO42- (или K2CrO4, или Cr+6 ) – окислитель, Zn – восстановитель. 1б
4. Решение: (каждый правильный ответ 0,5 балла).
А. а) (С0); б) (F-1); в) (Mg+2).
Б. а) положительный; б) отрицательный; в) положительный; г) отрицательный; д) положительный.








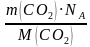 =
= 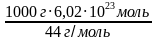 = 136, 818 ∙ 1023 молекул 2б
= 136, 818 ∙ 1023 молекул 2б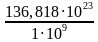 = 1,368 ∙ 1016 секунд = 2,28 ∙ 1014 минут = 3,8 ∙1012 часов = 1,583 ∙ 1011 суток = 4,336 ∙ 108 лет = 4,336 ∙ 106веков… 2б
= 1,368 ∙ 1016 секунд = 2,28 ∙ 1014 минут = 3,8 ∙1012 часов = 1,583 ∙ 1011 суток = 4,336 ∙ 108 лет = 4,336 ∙ 106веков… 2б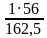 = 0,345 или 34,5%
= 0,345 или 34,5%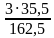 = 0,655 или 65, 5%
= 0,655 или 65, 5%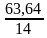 :
: 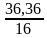 = 4,546: 2,2725 = 2:1 2б
= 4,546: 2,2725 = 2:1 2б (t2-t1) / 10, где
(t2-t1) / 10, где Структурная формула: 1б
Структурная формула: 1б 
















