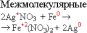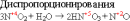ОКИСЛИТЕЛЬНО- ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
ОГЛАВЛЕНИЕ
Глоссарий
Степень окисления Классификация химических реакций
Основные положения теории ОВР Важнейшие окислители и восстановители
Электронные уравнения Электронно-ионные уравнения
Окислительно-восстановительные реакции с участием органических веществ Классификация ОВР
Удивительный мир ОВР Значение ОВР
Окислительно-восстановительные реакции в материалах ЕГЭ
ГЛОССАРИЙ
Электроотрицательность – это способность атомов в молекуле притягивать к себе электроны. (Имеются в виду электроны, которые участвуют в образовании химической связи.)
Степень окисления – это условный заряд атома в соединении, вычисленный исходя из предположения, что соединение состоит только из ионов.
Окислительно-восстановительные реакции – это реакции, при которых происходит переход электронов от одних атомов, молекул или ионов к другим. Реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Окисление - процесс отдачи электронов атомом, молекулой или ионом. Степень окисления при этом повышается.
Восстановление - процесс взятия (присоединения) электронов атомом, молекулой или ионом.
Степень окисления при этом понижается.
Восстановителями называются атомы, молекулы или ионы, отдающие электроны. Во время реакции они окисляются.
Окислителями называются атомы, молекулы или ионы, присоединяющие электроны. Во время реакции они восстанавливаются.
Электронные уравнения - уравнения, в которых указывается переход электронов.
Электронно- ионные уравнения - уравнения, в которых указывается переход электронов между ионами



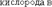
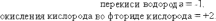
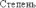
СТЕПЕНЬ ОКИСЛЕНИЯ
Степень окисления – это условный заряд атома в соединении, вычисленный исходя из предположения, что соединение состоит только из ионов.


КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
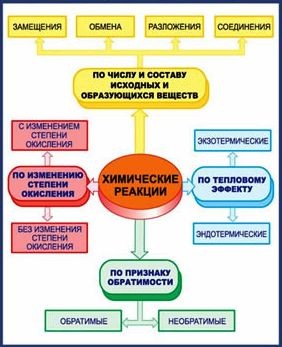
По изменению степени окисления все химические реакции можно разделить на два типа.
К первому из них относятся реакции, протекающие без изменения степени окисления атомов, входящих в состав реагирующих веществ.
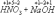
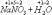 =
=
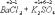
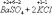 =
=
степень окисления каждого из атомов до и после реакции осталась без изменения.
Ко второму типу относятся реакции, идущие с изменением степени окисления атомов реагирующих веществ.
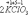
 =
=
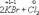
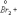
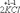 =
=
Здесь в первой реакции атомы хлора и кислорода, а во второй - атомы брома и хлора изменяют степень окисления.
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕОРИИ ОВР
Окислением называется процесс отдачи электронов атомом, молекулой или ионом.
Al - 3e- = Al3+ Fe2+ - e- = Fe3+ H2 - 2e- = 2H+ 2Cl- - 2e- = Cl2
При окислении степень окисления повышается.
Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом.
S + 2е- = S2- Сl2 + 2е- = 2Сl- Fe3+ + e- = Fe2+
При восстановлении степень окисления понижается.
Атомы, молекулы или ионы, отдающие электроны называются восстановителями.
Во время реакции они окисляются.
Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями.
Во время реакции они восстанавливаются.
Так как атомы, молекулы и ионы входят в состав определенных веществ,
то и эти вещества соответственно называются восстановителями или окислителями.
Окисление всегда сопровождается восстановлением, и наоборот, восстановление всегда связано с окислением, что можно выразить уравнениями:


 Восстановитель – е- Окислитель Окислитель + е- Восстановитель
Восстановитель – е- Окислитель Окислитель + е- Восстановитель
Поэтому окислительно-восстановительные реакции представляют собой единство двух противоположных процессов - окисления и восстановления.
Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем.
При этом, независимо от того, переходят ли электроны с одного
атома на другой полностью или же лишь частично оттягиваются к одному из атомов, условно говорят только об отдаче и присоединении электронов.
ВАЖНЕЙШИЕ ОКИСЛИТЕЛИ И ВОССТАНОВИТЕЛИ
Продукты окислительно-восстановительных реакций устанавливаются опытным путём.

Элементы, имеющие высшую степень окисления, могут быть только окислителями. Элементы, имеющие низшую степень окисления, могут быть только восстановителями. Элементы, находящиеся в промежуточной степени окисления, могут и окисляться, и восстанавливаться, то есть проявляют окислительно-восстановительную двойственность.
Как определить способность атома принимать или отдавать электроны
Поможет периодическая система Д.И.Менделеева.
| Атом, находящийся в максимально возможной степени окисления может быть только окислителем | Атом, находящийся в промежуточной степени окисления может быть и окислителем и восстановителем | Атом, находящийся в минимально возможной степени окисления может быть только восстановителем |
| Максимальная СО элемента |
| Минимальная СО: |
| равна номеру группы, в которой | Для неметаллов |
| находится элемент. | № группы минус 8 |
| Исключение: He, О, F, Ne, Ar | Для металлов – 0 (они не |
| (они не способны отдавать | способны принимать электроны) |
| электроны, для них | Исключения: Ge, Sn, Sb, Bi |
| максимальная СО равна 0) | (металлы главных подгрупп 4 и 5 |
|
| групп), они проявляют |
|
| отрицательные СО в |
|
| соединениях с водородом |
Типичные окислители: металлы, соединения неметаллов в низшей степени окисления Типичные восстановители: галогены, О2, N2, вещества, содержащие элемент в высшей СО
Определим функции атомов в ОВР для сульфита натрия Na2SO3
| элемент | Степень окисления элемента | То есть | вывод |
| максимальная | минимальная | в нашем веществе |
| Натрий (Ме) | +1 | 0 | +1 | максимальная | Только окислитель |
| Сера (неМе) | +6 | -2 | +4 | промежуточная | Окислитель и восстановитель |
| Кислород | 0 | -2 | -2 | минимальная | Только восстановитель |
АЛГОРИТМ СОСТАВЛЕНИЯ УРАВНЕНИЙ ОВР МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА
Метод электронного баланса подходит для уравнивания всех видов окислительно- восстановительных реакций
Способ основан на двух положениях:
Количество атомов в левой и правой части уравнения должны быть равны (закон сохранения массы)
Число отдаваемых электронов должно быть равно числу принимаемых электронов (закон сохранения заряда)
Электронные уравнения должны быть сбалансированы по атомам (для этого используются коэффициенты) и зарядам (вычитаем или прибавляем необходимое число электронов, помня, что электрон имеет заряд равный -1).
ЗАПОМНИТЕ!!!
Простые вещества записываются в виде молекул:
Уравниваем по атомам H
0 → 2H
+ 2 Cl
- → Cl
0 2 2
2
Уравниваем по зарядам H
0 - 2 е → 2H
+ 0 - 2 х (-1) = 2 (+1)
2
2 Cl- - 2 е → Cl 0 2х (-1) – 2 (-1) = 0
| Действие | Пример |
| 1.Составляем схему реакции |
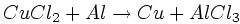
|
| 2.определяем СО всех химических элементов в левой и правой частях уравнения |

|
| 4.Составляем баланс | Al0 – 3 e → Al +3 3 2 окисление, восстановитель
Сu+2 + 2e → Cu0 2 3 восстановление, окислитель |
| 5.расставляем коэффициенты |
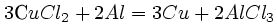
|
Правила составления электронного баланса
Правило 1
Если степень окисления изменяют два элемента, баланс составляется в той части уравнения, где больше веществ.
Исключение: если степень окисления изменяют три элемента, то баланс составляется в левой части уравнения
2 в-ва 1 в-во Al + Сl2 –– AlCl3
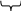
баланс
2 в-ва 3 в-ва
 HNO3 + Fe –– Fe(NO3)3 + NO2 + H2O
HNO3 + Fe –– Fe(NO3)3 + NO2 + H2O
Баланс
Правило 2
Если число веществ в правой и левой частях уравнения одинаково, то баланс составляем в той части, где есть простое вещество:
2 в-ва 2 в-ва простое
 H 2S + O2 –– SO2 + H2 O
H 2S + O2 –– SO2 + H2 O
баланс
простое
 KClO3 + S –– KCl + SO2
KClO3 + S –– KCl + SO2
баланс простое
 W + KNO3 + KOH –– K 2WO4 + KNO2 + H 2O
W + KNO3 + KOH –– K 2WO4 + KNO2 + H 2O
баланс
* (исключение из Правила 2 составляют реакции диспропорционирования)
Правило 3
При одинаковом числе веществ и наличии простых веществ в обеих частях уравнения, баланс составляем в той части, где находится простое вещество молекулярного строения Эх (O2, H2, Cl2, Br2 ,O3, P4, S8 и т.д.)
простое простое молекул. строения немол. строения

СuO + H2 = Cu + H 2O
баланс
простое простое немолекул. строения молекул. строения

NO + C = N2 + CO
баланс
*При равном числе веществ и наличии простых веществ молекулярного строения в обеих частях уравнения, баланс предпочтительно составлять в той части уравнения, где находится более сильный окислитель. Поскольку в подавляющем большинстве таких случаев баланс получается в любой части уравнения, в обычных классах это положение можно в качестве правила не давать, а упоминать его только в специализированных классах.
Правило 4
Реакции диспропорционирования – ОВР, в которых степень окисления изменяет один элемент. В реакциях диспропорционирования, баланс составляется в той части уравнения, где этот элемент встречается в составе нескольких веществ
Сера в составе сера в составе
двух веществ одного вещества
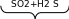 = S + H2 O
= S + H2 O
Баланс
Правило 5
Если степень окисления изменяют три элемента, баланс составляется слева.
 Fe+2S2-1 + O20 –– Fe2+3 O3 + S+4O2-2
Fe+2S2-1 + O20 –– Fe2+3 O3 + S+4O2-2
Баланс

N -3H4Cl+7O4 + P0 –– H3 P+5O 4 + Cl20 + N20 + H2O
Баланс

Fe+2S2-1 + HN+5O3 –– S0 + Fe+3(NO3)3 + N+4O2 + H2O
Баланс
ЭЛЕКТРОННО-ИОННЫЕ УРАВНЕНИЯ
Электронно-ионные уравнения, или полуреакции, применяются для уравнивания окислительно-восстановительных реакций, протекающих в растворах. Например, если расписать реакцию окисления сульфита калия перманганатом калия в кислой среде в ионном виде, то получим:

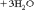
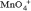
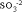 Как видно, в результате реакции происходит изменение ионов и . Первый ион теряет атомы кислорода, а второй приобретает. Этот перенос атомов кислорода происходит или с ионами водорода, или с гидроксид-ионами, или с молекулами воды.
Как видно, в результате реакции происходит изменение ионов и . Первый ион теряет атомы кислорода, а второй приобретает. Этот перенос атомов кислорода происходит или с ионами водорода, или с гидроксид-ионами, или с молекулами воды.
При этом нужно знать, что:
1)избыток атомов кислорода связывается
в кислой среде с ионами водорода, образуя молекулы воды
в нейтральной и щелочной среде с молекулами воды, образуя гидроксид-ионы 2)источником атомов кислорода являются
в кислой и нейтральной среде молекулы воды, которые переходят в ионы водорода
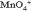 в щелочной среде гидроксид-ионы, которые переходят в молекулы воды Для данной реакции:
в щелочной среде гидроксид-ионы, которые переходят в молекулы воды Для данной реакции:
теряет атомы кислорода в кислой среде, следовательно составляем полуреакцию и уравниваем её по количеству атомов:
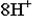
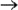


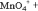
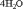
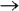



Теперь нужно уравнять по зарядам, используя нужное количество электронов. Так как в левой части заряд +7, а в правой части заряд +2, то надо прибавить 5 электронов к левой части:
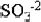
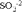
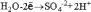 Получили электронно-ионное уравнение восстановления пермангарат-ионов. Также составим электронно-ионное уравнение окисления сульфит-ионов :
Получили электронно-ионное уравнение восстановления пермангарат-ионов. Также составим электронно-ионное уравнение окисления сульфит-ионов :

Ионы, не участвующие в окислительно-восстановительных процессах, называются ионами-"наблюдателями".
В данной реакции ионами-"наблюдателями" являются ионы калия и сульфат-ионы, входящие в состав серной кислоты.
В электронно-ионных уравнениях частицы, не распадающиеся на ионы, записываются полностью.
ВЛИЯНИЕ СРЕДЫ НА ХАРАКТЕР РЕАКЦИЙ.
4
Реакции окисления - восстановления могут протекать в различных средах: в кислой, нейтральной и щелочной. В зависимости от среды может изменяться характер протекания реакции между одними и теми же веществами. Среда влияет на изменение степеней окисления. Рассмотрим пример влияния среды на восстановление перманганат- иона MnO
-:
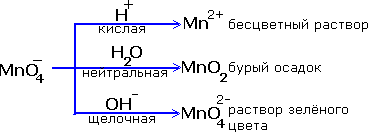
Обычно для создания в растворе кислой среды используют серную кислоту. Для создания щелочной среды применяются растворы гидроксидов калия или натрия. Рассмотрим примеры протекания реакции между сульфитом натрия Na2SO4 (восстановитель) c перманганатом калия KMnO4(окислитель).
Реакция в кислой среде
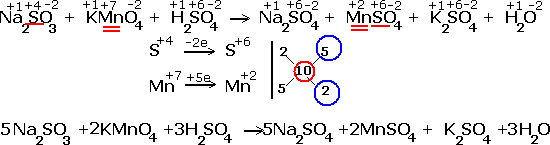
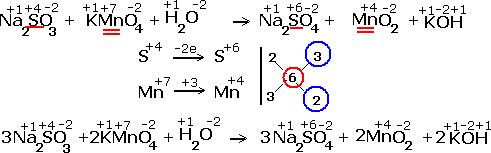 Реакция в нейтральной среде
Реакция в нейтральной среде
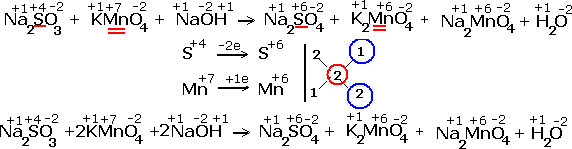
Реакция в щелочной среде
Окислительно-восстановительные реакции с участием органических веществ
В ОВР органических веществ с неорганическими органические вещества чаще всего являются восстановителями. Так, при сгорании органического вещества в избытке кислорода всегда образуется углекислый газ и вода. Сложнее протекают реакции при использовании менее активных окислителей. В этом параграфе рассмотрены только
реакции представителей важнейших классов органических веществ с некоторыми неорганическими окислителями.
Алкены. При мягком окислении алкены превращаются в гликоли (двухатомные спирты). Атомы-восстановители в этих реакциях – атомы углерода, связанные двойной связью.
Реакция с раствором перманганата калия протекает в нейтральной или слабо щелочной среде следующим образом:
C2H4 + 2KMnO4 + 2H2O → CH2OH–CH2OH + 2MnO2 + 2KOH (охлаждение)
В более жестких условиях окисление приводит к разрыву углеродной цепи по двойной связи и образованию двух кислот (в сильно щелочной среде – двух солей) или кислоты и диоксида углерода (в сильно щелочной среде – соли и карбоната):
5CH3CH=CHCH2CH3 + 8KMnO4 + 12H2SO4 →5CH3COOH + 5C2H5COOH + 8MnSO4 + 4K2SO4 + 17H2O (нагревание)
5CH3CH=CH2 + 10KMnO4 + 15H2SO4 →5CH3COOH + 5CO2 + 10MnSO4 + 5K2SO4 + 20H2O (нагревание)
CH3CH=CHCH2CH3 + 6KMnO4 + 10KOH→CH3COOK + C2H5COOK + 6H2O + 6K2MnO4 (нагревание)
CH3CH=CH2 + 10KMnO4 + 13KOH →CH3COOK + K2CO3 + 8H2O + 10K2MnO4 (нагревание)
Дихромат калия в сернокислотной среде окисляет алкены аналогично реакциям 1 и 2.
Алкины. Алкины начинают окисляются в несколько более жестких условиях, чем алкены, поэтому они обычно окисляются с разрывом углеродной цепи по тройной связи. Как и в случае алканов, атомы-восстановители здесь – атомы углерода, связанные в данном случае тройной связью. В результате реакций образуются кислоты и диоксид углерода. Окисление может быть проведено перманганатом или дихроматом калия в кислотной среде, например:
5CH3C CH + 8KMnO4 + 12H2SO4 →5CH3COOH + 5CO2 + 8MnSO4 + 4K2SO4 + 12H2O
(нагревание)
Иногда удается выделить промежуточные продукты окисления. В зависимости от положения тройной связи в молекуле это или дикетоны (R1–CO–CO–R2), или альдокетоны (R–CO–CHO).
Ацетилен может быть окислен перманганатом калия в слабощелочной среде до оксалата калия:
3C2H2 + 8KMnO4 = 3K2C2O4 +2H2O + 8MnO2 + 2KOH
В кислотной среде окисление идет до углекислого газа:
C2H2 + 2KMnO4 +3H2SO4 =2CO2 + 2MnSO4 + 4H2O + K2SO4
Гомологи бензола. Гомологи бензола могут быть окислены раствором перманганата калия в нейтральной среде до бензоата калия:
C6H5CH3 +2KMnO4 = C6H5COOK + 2MnO2 + KOH + H2O (при кипячении)
C6H5CH2CH3 + 4KMnO4 = C6H5COOK + K2CO3 + 2H2O + 4MnO2 + KOH (при нагревании)
Окисление этих веществ дихроматом или перманганатом калия в кислотной среде приводит к образованию бензойной кислоты.
Спирты. Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных – кетоны.
Образующиеся при окислении спиртов альдегиды легко окисляются до кислот, поэтому альдегиды из первичных спиртов получают окислением дихроматом калия в кислотной среде при температуре кипения альдегида. Испаряясь, альдегиды не успевают окислиться.
3C2H5OH + K2Cr2O7 + 4H2SO4 = 3CH3CHO + K2SO4 + Cr2(SO4)3 + 7H2O (нагревание)
С избытком окислителя (KMnO4, K2Cr2O7) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные – до кетонов. Третичные спирты в этих условиях не окисляются, а метиловый спирт окисляется до углекислого газа. Все реакции идут при нагревании.
Двухатомный спирт, этиленгликоль HOCH2–CH2OH, при нагревании в кислотной среде с раствором KMnO4 или K2Cr2O7 легко окисляется до углекислого газа и воды, но иногда удается выделить и промежуточные продукты (HOCH2–COOH, HOOC–COOH и др.).
Альдегиды. Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: KMnO4, K2Cr2O7. Все реакции идут при нагревании:
3CH3CHO + 2KMnO4 = CH3COOH + 2CH3COOK + 2MnO2 + H2O
3CH3CHO + K2Cr2O7 + 4H2SO4 = 3CH3COOH + Cr2(SO4)3 + 7H2O
КЛАССИФИКАЦИЯ ОВР
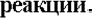
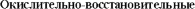



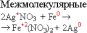
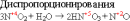

К межмолекулярным относятся реакции, у которых окислитель и восстановитель находятся в разных веществах.
К внутримолекулярным относятся реакции, которые протекают с изменением степени окисления атомов в одной и той же молекуле.
К реакциям диспропорционирования, или дисмутации (самоокисления- самовосстановления), относятся реакции, сопровождающиеся одновременным увеличением и уменьшением степени окисления атомов одного и того же элемента. Эти реакции характерны для веществ, содержащих атомы с промежуточной степенью окисления


Поговорим о спичках
Привычные всем нам фосфорные спички появились в середине XIX века.
Вначале сразу несколько изобретателей – английский химик Джеймс Уолкер, венгерский химик Шандор Ириньи, французский химик Шарль Сориа и немецкий учитель Ян Каммерер – независимо друг от друга предложили наносить на осиновую палочку и затем высушивать смесь белого фосфора, бертолетовой соли и клея. Такие спички воспламенялись при легком трении о любую твердую поверхность, но по той же самой причине были очень опасны, становясь источником многих пожаров. Кроме того, белый фосфор – сильный яд, и спичками, беря их в рот, часто отравлялись маленькие дети.
Спичечные головки также были излюбленным ядом самоубийц.
Спички, которые мы с вами сейчас используем, по названию страны, где впервые было организовано из промышленное производство, получили название «шведских». Рудольф Беттгер в 1848 году разделил горючий состав спичек на две части: головку спички и намазку боков коробка (поэтому шведские спички нельзя зажечь трением о любую поверхность). Он же исключил из состава белый фосфор, заменив его красным.
С тех пор главной составляющей частью головки является бертолетова соль KClO3, а в намазку боков коробка входит красный фосфор. Оба они смешиваются с молотым стеклом и клеем. Это самые важные из более, чем двадцати веществ, которые используются в составе.
При трении головки о намазку коробка мельчайшие частички красного фосфора, взаимодействуя с KClO3, воспламеняются на воздухе и поджигают состав головки спички – таким образом, огонь зарождается в намазке коробка.
Смесь красного фосфора и бертолетовой соли легко вспыхивает при трении –
составьте электронный баланс этой реакции
P + KClO3 → KCl + P2O5
0 +1 +5 -2 +1 -1 +5 -2
6P + 5KClO3 → 5KCl + 3P2O5
0 +5
6 P – 5ē → P (окисление), восстановитель
+5 -1
5 Cl + 6ē → Cl (восстановление), окислитель
Реставрация старых картин
В свое время художники писали картины, используя в качестве белой краски свинцовые белила. Со временем под действием содержащихся в воздухе следов сероводорода картины темнели, т.к. свинцовые белила превращались в темный (черный) сульфид свинца. Реставраторы, промывая старые картины пероксидом водорода, сульфид переводят в белый сульфат свинца, и потемневшие картины обновляются – становятся вновь яркими. Напишите уравнение этого процесса.
+2 -2 +1 -1 +2 +6 -2 +1 -2
PbS + 4H2O2 → PbSO4 + 4H2O
-2 +6
1 S – 8ē → S (окисление), восстановитель
-1 -2
8 O + 1ē → O (восстановление), окислитель
Чем надут теннисный мяч?
Знаете ли вы, что теннисные мячи не надувают, а вводят в них специальные вещества –
«вздуватели». Это такие вещества, которые при нагревании разлагаются с образованием газообразных продуктов. В теннисные мячи (заготовки в виде полусфер изготовлены предварительно и намазаны клеем) кладут таблетки, содержащие смесь нитрита натрия и хлорида аммония. Склеенные половинки мяча помещают в формы и нагревают. Запишите уравнение этой реакции, составьте электронный баланс.
+1 +3 -2 -3 +1 -1 +1 -1 +1 -2 0
NaNO2 + NH4Cl → NaCl + 2H2O + N2
|
1 | +3 N + 3ē → | 0 N (восстановление), окислитель |
| 1 | -3 N – 3ē → | 0 N (окисление), восстановитель |
Выделившийся азот создает в мяче повышенное давление.
«Сатанинские огни»
Мальчишки забрались ночью на старое кладбище посмотреть на привидение, о котором давно говорили в деревне. Когда их глаза привыкли к темноте, они увидели, как вспыхнул и погас огонек на одной могиле, затем на другой, на третьей… Мальчики застыли в ужасе…
Появление блуждающих огней на старых кладбищах и болотах вызвано воспламенением на воздухе выделяющегося газа – фосфина PH3. Газ этот образуется при разложении органических соединений, содержащих фосфор. На воздухе фосфин воспламеняется. Составьте электронный баланс этой реакции.
-3 +1 0 +5 -2 +1 -2
2PH3 + 4O2 → P2O5 + 3H2O
-3 +5
2 P – 8ē → P (окисление), восстановитель
0 -2
8 O + 2ē → O (восстановление), окислитель
Оксид фосфора P2O5 при взаимодействии с влагой воздуха образует мельчайшие капельки фосфорной кислоты, дающие неясные, размытые контуры привидения.
ЗНАЧЕНИЕ ОВР
Окислительно-восстановительные реакции чрезвычайно распространены.
Окислительно-восстановительные процессы сопровождают круговороты веществ в природе, их можно наблюдать при выплавке металлов, с их помощью получают щелочи, кислоты и многие другие ценные продукты.
| Горение

| ОВР, сопровождающаяся выделением тепла и света |
| Коррозия

| разрушение твердых тел, вызванное химическими и электрохимическими процессами, развивающимися на поверхности тела при его взаимодействии с внешней средой (corrosio – разъедание). Термин «коррозия» применим к металлам, бетону, некоторым пластмассам и другим материалам. Огромный ущерб приносит коррозия металлов. Распространенный и наиболее знакомый всем нам вид коррозии - ржавление железа. Коррозия – окислительно-восстановительная реакция, протекающая на поверхности металла под воздействием внешней среды. В результате коррозии металлы переходят в устойчивые соединения - оксиды или соли, в виде которых они находятся в природе. |
| Взрыв

| процесс быстрого превращения веществ из твердого (жидкого) состояния в газообразное, т. е. мгновенное выделение энергии. При этом происходит реакция соединения кислорода с горючими элементами (водородом, углеродом, серой и др.), сопровождающаяся выделением в короткое время большого количества энергии. Различают взрывы двух типов.
взрывы, обусловленные высвобождением химической или ядерной энергии вещества – взрывы химических взрывчатых веществ, смесей газов, пыли и паров, а также ядерные и термоядерные взрывы. при взрывах второго типа выделяется энергия, полученная веществом от внешнего источника – мощный электрический разряд в среде (в природе – молния во время грозы, извержение вулкана); испарение |
| 
| металлического проводника под действие тока большой силы Взрыв - химическая реакция горения, протекающая с большой скоростью |
| Электролиз

| окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через раствор или расплав электролитов. Для осуществления электролиза к отрицательному полюсу внешнего источника постоянного тока присоединяют катод, а к положительному полюсу — анод, после чего погружают их в электролизер с раствором или расплавом электролита. Электроды, как правило, бывают металлические, но применяются и неметаллические, например графитовые (проводящие ток). На поверхности электрода, подключенного к отрицательному полюсу источника постоянного тока (катоде), ионы, молекулы или атомы присоединяют электроны, т. е. протекает реакция электрохимического восстановления. На положительном электроде (аноде) происходит отдача электронов, т. е. реакция окисления. Сущность электролиза состоит в том, что на катоде происходит процесс восстановления, а на аноде — процесс окисления. В результате электролиза на электродах (катоде и аноде) выделяются соответствующие продукты восстановления и окисления. |
| Гниение

| сложный биохимический процесс с образованием углекислого газа, воды и азота. В результате дезаминирования выделяется газообразный аммиак, образуются насыщенные и ненасыщенные кислоты жирного и ароматического ряда, кето- и оксикислоты; при декарбоксилировании — амины, многие из которых очень ядовиты.. При гниении без доступа воздуха преобладают восстановительные процессы и накапливаются многие указанные продукты; при свободном доступе воздуха гниение проходит до конца, и весь углерод органических соединений выделяется в виде углекислого газа. Гнилостные бактерии вызывают порчу продуктов питания. Для предохранения их от гниения применяют стерилизацию, засолку, копчение, замораживание |
| Брожение

| особый химический процесс, вызываемый ферментами. При процессе брожения сложная частица органического вещества распадается на более простые. Брожение, которое возникает в содержащих сахар жидкостях и носит название алкогольного, спиртового или винного, было раньше других замечено и изучено с наибольшей тщательностью. Еще в древности люди заметили, что в течение известного промежутка времени с соком совершается удивительная метаморфоза. Он теряет свой сладковатый вкус и приобретает способность опьянять; в тоже время выделяются пузырьки газа, приводящие жидкость, как бы в слабое кипение C6H12O6 - 2C2H5OH + 2CO2 |
| Фотосинтез | Образование клетками автотрофных организмов органических веществ из неорганических при участии и за счет энергии солнечного света. |
| 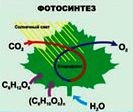
| У растений и цианобактерий донором электронов является вода и в процессе фотосинтеза выделяется кислород. Световая энергия, которую фотосинтез преобразует в химическую потенциальную энергию органических веществ и использует на выделение свободного кислорода, – это единственно важный первичный источник энергии для всего живого. 6CO2 + 6H2O - C6H12O6 + 6O2 |
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
Упражнение: определите для следующих ОВР в какой части уравнения нужно составлять баланс.
2
Cl
20 + Br
20 + KOH –– KCl
-1 + KBr
+5O
3 + H
2O Cr
2+3O
3 + Br
0 + NaOH –– Na
2Cr
+6O
4 + NaBr
-1 + H
2O Ca(Cl
+1O)
2 + Na
2S
-2 + H
2O –– CaCl
2-1+ S
0 + NaOH
Упражнение: перед вами несколько ОВР, в которых степень окисления изменяют два элемента. Определите, в какой части уравнения составляется баланс.
H2S + HNO3 –– S + NO2 + H2O As + HNO3 –– As2O3 + NO + H2O
FeCl2 + HNO3 –– Fe(NO3)3 + NO + HCl + H2O CuO + NH3 –– Cu + N2 + H2O
Fe + KNO2 –– KFeO2 + N2
Упражнение: определите для следующих ОВР в какой части уравнения нужно составлять баланс.
H2S+4O3 + H2S-2 –– S0 + H2O I20 + H2O –– HI+5O3 + HI-1
Cl20 + KOH –– KCl- 1+ KCl+5O3 + H2O Cl+4O2 + H2O –– HCl+5O3 + HCl-1
Упражнение: определите степень окисления элементов, и сделайте вывод о том в какой части уравнения составлять баланс:
а) Cu + H2SO4(конц) –– CuSO4 + SO2 + H2O б) SO2 + H2O + HNO3 –– NO + H2SO4
в) FeS + O2 –– Fe2O3 + SO2
г) Fe(OH)2 + O3 + H2O ––Fe(OH)3
д) Fe(OH)2 + NO2 –– Fe(NO3)3 + NO + H2O
Упражнение: Определите сколько элементов (два или три) изменяют степень окисления, сделайте вывод в какой части уравнения составить баланс.
а) As2+3S3-2 + H+1N+5O3-2 –– H3+1As+5O4-2 + N+4O2-2 + H2+1S+6O4-2 б) K+1I-1 + H2+1S+6O4-2(конц) –– I20 + S0 + K2+1S+6O4-2 + H2+1O-2 в) Cu2+1S-2 + O20 –– Cu+2O-2 + S+4O2-2
г) Na+1H+1S+4O3-2 + Cl20 + H2+1O-2 –– Na+1H+1S+6O4-2 + H+1Cl-1
Задание: Составьте электронный баланс
K2CO3 + O2 + Cr2O3 –– CO2 + K2CrO4
HNO3 + CuS –– NO2 + CuSO4 + H2O
H2S + KMnO4 –– S + MnO2 + KOH + H2O HCl + K2Cr2O7 –– Cl2 + CrCl3 + H2O +KCl H2SO4 + KI–– I2 + H2S + H2O + K2SO4
KMnO4 +H2O + SO2–– MnSO4 + H2SO4 + K2SO4


Степень окисления фосфора в соединении, имеющем формулу H4P2O7: 1) +7;
2) +3;
3) +5;
4) -3.
Степень окисления серы уменьшается в ряду веществ: 1)SO2- Na2SO3- Na2S;
SO2- Na2S2O3- KHS;
S- SO3- BaSO4;
H2SO4- SOCl2- H2SO3.
Соединение, содержащее Mn+7 в кислотной среде восстанавливается до: 1) Mn+4;
2) Mn+6;
3) Mn+2;
4) Mn0.
Уравнение реакции диспропорционирования: 1)2H2S+SO2=3S+2H2O;
2)NH4NO3=N2+2H20;
3)2KNO3=KNO2+O2;
4)6KOH+3S=2K2S+K2SO4+3H2O.
В превращении, схема которого HClO3+H2SO3=HCl+H2SO4 число электронов, отданных одной молекулой восстановителя равно:
1)3;
2)2;
3)5;
4)6.
В окислительно-восстановительной реакции, схема которой NH3+O2=NO+H2O сумма всех коэффициентов равна:
1)9;
2)11;
3)16;
4)19.
В окислительно-восстановительной реакции, схема которой KI+NaNO2+H2SO4 →I2+NO+K2SO4+Na2SO4+H2O сумма коэффициентов перед формулами продуктов реакции равна:
1)7 ;
2)9 ;
3)11 ;
4)14.
Коэффициент перед формулой продукта окисления в реакции, схема которой Fe3O4+HNO3=Fe(NO3)3+NO+H2O, равен:
1)1;
2)3;
3)8;
4)9.
В уравнении окислительно-восстановительной реакции Cu+HNO3(разб.) → Cu(NO3)2+NO+H2O коэффициент перед окислителем: 1)8;
2)10;
3)6;
4)4
Хлор является и окислителем и восстановителем в реакции, уравнение которой:
2FeCl2+Cl2=2FeCl3;
Fe+2HCl=FeCl2+H2;
2KOH+Cl2=KCl+KClO3+H2O;
MnO2+4HCl=Cl2+MnCl2+2H2O .
Реакция, уравнение которой 4NH3+5O2=4NO+6H2O соответствует схеме превращения азота:
1)N+3- N+2;
2)N-3- N-2;
3)N+3- N-3;
4)N-3 - N+2.
Окислительно-восстановительной является реакция, уравнение которой: 1)CaCO3+SiO2=CaSiO3+CO2;
2)BaSO4=BaO+SO2; 3)CuCl2+Fe=FeCl2+Cu ; 4)CuSO4+2KOH=Cu(OH)2+K2SO4.
Какие из указанных ниже соединений могут проявлять только окислительные свойства?
CrSO4
K2CrO4
NaCrO2 .


| 1. | Степень окисления фосфора в соединении, имеющем формулу H4P2O7: 1) +7 |
|
| 2) +3 |
|
| 3) +5 |
|
| 4) -3 |
|
| При определении степеней окисления необходимо учитывать правило, гласящее, |
|
| что сумма отрицательных степеней равняется числу положительных, суммарный |
|
| заряд равен нулю. |
|
| У кислорода степень окисления -2, у водорода +1. По правилу 4·(+1)+7·(-2)+2Х=0. |
|
| Х=+5. H4+1P2+5O7-2 |
| 2. | Степень окисления серы уменьшается в ряду веществ:
SO2 - Na2SO3 - Na2S SO2 - Na2S2O3 - KHS S - SO3 - BaSO4 H2SO4 - SOCl2 - H2SO3 |
| 3. | Соединение, содержащее Mn+7 в кислотной среде восстанавливается до: Mn+4 Mn+6 Mn+2 Mn0
Запомните эти данные!
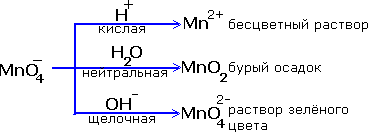
|
| 4. | Уравнение реакции диспропорционирования : |
|
|
| 1)2H2S+SO2=3S+2H2O |
|
|
| 2)NH4NO3=N2+2H20 |
|
|
| 3)2KNO3=KNO2+O2 |
|
|
| 4)6KOH+3S=2K2S+K2SO4+3H2O | К |
|
| реакциям диспропорционирования, при которых один химический элемент |
|
|
| одновременно отдаёт и присоединяет электроны, т.е. является одновременно и |
|
|
| окислителем, и восстановителем.. |
|
|
| 6KOH+3S0=2K2S-2+K2S+6O4+3H2O |
|
| 5. | В превращении, схема которого HClO3 + H2SO3 = HCl + H2SO4 число электронов, отданных одной молекулой восстановителя равно: 1)3 2)2 3)5 |
|
| 4)6 Проставим степени окисления :HCl+5O3+ H2S+4O3 = HCl-1 + H2S+6O4 . Восстановитель в химической реакции отдаёт электроны, значит степень окисления увеличивается. Восстановителем является H2SO3. Сера отдаёт 2 электрона. |
| 6. | В окислительно-восстановительной реакции, схема которой |
|
| NH3 + O2 = NO + H2O сумма всех коэффициентов равна: |
|
| 1)9 |
|
| 2)11 |
|
| 3)16 |
|
| 4)19 |
|
| Расставим коэффициенты, используя метод электронного баланса |
|
| 4NH3+5O2=4NO+6H2O |
| 7. | В окислительно-восстановительной реакции, схема которой KI+NaNO2+H2SO4- |
|
| I2+NO+K2SO4+Na2SO4+H2O сумма коэффициентов перед формулами продуктов |
|
| реакции равна: |
|
| 1)7 |
|
| 2)9 |
|
| 3)11 |
|
| 4)14 |
|
| Расставим коэффициенты, используя метод электронного баланса |
|
| 2 KI+2NaNO2+2H2SO4-I2+2NO+K2SO4+Na2SO4+2H2O |
| 8. | Коэффициент перед формулой продукта окисления в реакции, схема которой |
|
| Fe3O4+HNO3=Fe(NO3)3+NO+H2O, равен: |
|
| 1)1 |
|
| 2)3 |
|
| 3)8 |
|
| 4)9 |
|
| Расставим коэффициенты 3 Fe3O4+28HNO3=9Fe(NO3)3+NO+14H2O. |
|
| Имейте в виду, что Fe3O4можно представить в виде Fe2O3·FeO. |
|
| Окислилось железо +2 до +3. Следовательно, продуктом окисления является |
|
| Fe(NO3)3. |
| 9. | В уравнении окислительно-восстановительной реакции |
|
| Cu+HNO3(разб.)-Cu(NO3)2+NO+H2O коэффициент перед окислителем: |
|
| 1)8 |
|
| 2)10 |
|
| 3)6 |
|
| 4)4 |
|
| 3Cu+8HNO3(разб.)-3Cu(NO3)2+2NO+4H2O. Окислитель азотная кислота. |
| 10. | Хлор является и окислителем и восстановителем в реакции, уравнение которой: 2FeCl2+Cl2=2FeCl3 Fe+2HCl=FeCl2+H2 2KOH+Cl2=KCl+KClO3+H2O MnO2+4HCl=Cl2+MnCl2+2H2O |
| 11. | Реакция, уравнение которой 4NH3+5O2=4NO+6H2O соответствует схеме превращения азота |
|
| 1)N+3- N+2 |
|
| 2)N-3- N-2 |
|
| 3)N+3- N-3 |
|
| 4)N-3 - N+2 |
| 12. | Окислительно-восстановительной является реакция, уравнение которой: 1)CaCO3+SiO2=CaSiO3+CO2; BaSO4=BaO+SO2; CuCl2+Fe=FeCl2+Cu ; CuSO4+2KOH=Cu(OH)2+K2SO4. |
| 13. | Какие из указанных ниже соединений могут проявлять только окислительные свойства? CrSO4 K2CrO4 NaCrO2 Из предложенных соединений только окислительными свойствами обладает K2CrO4 , так как Сr в данном соединении проявляет высшую степень окисления + 6 и, следовательно, может только принимать электроны. В соединениях CrSO4 ; NaCrO2 хром проявляет промежуточные степени окисления +2 и +3 соответственно и может выполнять как функцию окислителя, так и функцию восстановителя. |
ЭТИ КНИГИ ПОМОГУТ ТЕБЕ УСПЕШНО ПОДГОТОВИТЬСЯ К ЭКЗАМЕНУ
Энциклопедический словарь юного химика под редакцией Прокофьева М. А. М: «Педагогика» 1987.
Большая энциклопедия Кирилла и Мефодия www.KM.ru
Журин А.А. Окислительно-восстановительные реакции аквариум, 1998
Крючкова Н.М. Неорганическая химия, М: «Медицина» 1972.
Лидин Р.А. Справочник школьника. М: «АСТ-ПРЕСС» 2001.
Солдатова Т.М. Химия. 8-11 классы. Тренинги и тесты с ответами по теме "Окислительно-восстановительные реакции"










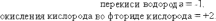
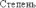 СТЕПЕНЬ ОКИСЛЕНИЯ
СТЕПЕНЬ ОКИСЛЕНИЯ 

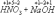
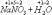 =
=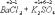
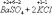 =
=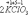
 =
=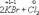
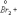
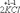 =
=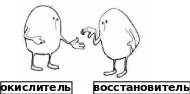

 HNO3 + Fe –– Fe(NO3)3 + NO2 + H2O
HNO3 + Fe –– Fe(NO3)3 + NO2 + H2O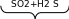 = S + H2 O
= S + H2 O
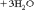
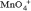
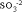 Как видно, в результате реакции происходит изменение ионов и . Первый ион теряет атомы кислорода, а второй приобретает. Этот перенос атомов кислорода происходит или с ионами водорода, или с гидроксид-ионами, или с молекулами воды.
Как видно, в результате реакции происходит изменение ионов и . Первый ион теряет атомы кислорода, а второй приобретает. Этот перенос атомов кислорода происходит или с ионами водорода, или с гидроксид-ионами, или с молекулами воды.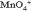 в щелочной среде гидроксид-ионы, которые переходят в молекулы воды Для данной реакции:
в щелочной среде гидроксид-ионы, которые переходят в молекулы воды Для данной реакции: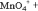
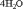


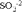
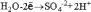 Получили электронно-ионное уравнение восстановления пермангарат-ионов. Также составим электронно-ионное уравнение окисления сульфит-ионов :
Получили электронно-ионное уравнение восстановления пермангарат-ионов. Также составим электронно-ионное уравнение окисления сульфит-ионов :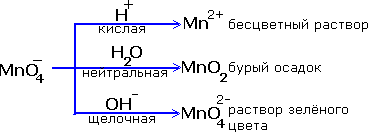
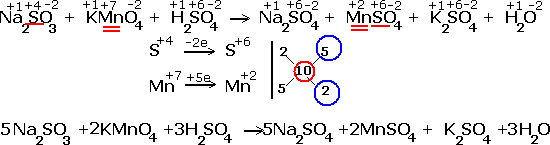
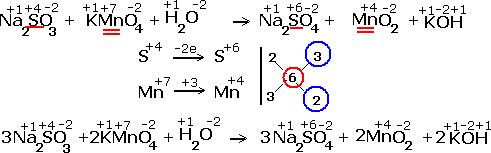 Реакция в нейтральной среде
Реакция в нейтральной среде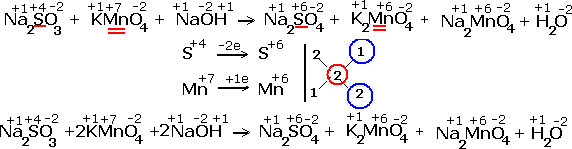 Реакция в щелочной среде
Реакция в щелочной среде