Просмотр содержимого документа
«"Окислительно-восстановительные реакции"»

Окислительно- восстановительные реакции

Интеллектуальная разминка
Установите соответствие между названием соли и средой ее водного раствора
НАЗВАНИЕ СОЛИ СРЕДА РАСТВОРА
А)хлорид золота ( III) 1) нейтральная
Б) сульфат железа ( II) 2) кислая
В) фосфат цезия 3) щелочная
Г) ацетат калия
ОБОСНУЙТЕ СВОЙ ВЫБОР
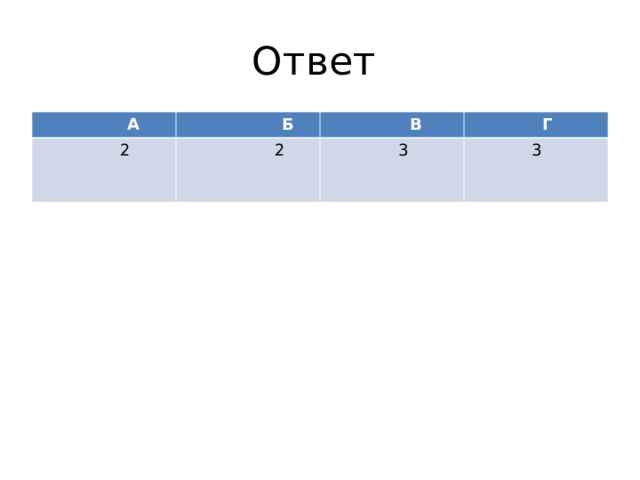
Ответ
А
Б
2
2
В
Г
3
3

Лабораторная работа
« Различные случаи гидролиза солей»
Оборудование и реактивы:
2) Раствор карбоната калия,
3) Раствор сульфат алюминия,
4) Раствор хлорида натрия
5) Универсальная индикаторная бумага

Ход работы
В три пробирки прилейте по 1- 2 мл растворов: в первую - карбоната калия, во вторую - сульфата алюминия, в третью – хлорида натрия.
Испытайте действие растворов на универсальную индикаторную бумагу.
Что наблюдаете ?
Объясните результаты наблюдений и запишите уравнения реакций в молекулярном и ионном виде.
Тема урока
Окислительно – восстановительные реакции
(ОВР)

Определение ОВР
- Окислительно-восстановительными называют реакции, протекающие с изменением степеней окисления элементов, образующих вещества, участвующие в реакции.

Определение степени окисления (с.о.)
- Степенью окисления называют условный заряд атомов химического элемента, приобретенный в результате отдачи или принятия электронов

Правила определения с.о.
- 1) с.о. кислорода почти всегда равна -2
( исключения: фторид кислорода, пероксиды);
- 2) с. О. водорода почти всегда равна +1 (исключения: гидриды);
- 3) с.о. металлов всегда положительная, ее максимальное значение почти всегда равно номеру группы;
- 4) с.о. свободных атомов и атомов в простых веществах всегда равна 0;
- 5) суммарная с.о. атомов всех элементов в соединении равна 0.

Почему ОВР так называются ?
Элементы или вещества, отдающие электроны, называют восстановителями. В ходе реакции они окисляются.
Элементы или вещества, принимающие электроны, называют окислителями. В ходе реакции они восстанавливаются.

Примеры ОВР
- В неорганической химии к ОВР относятся все реакции замещения, соединения, разложения, в которых участвует хотя бы одно простое вещество.
2) В органической химии к ОВР относятся реакции горения , восстановление альдегидов в спирты, окисление спиртов в кислоты

Сильные восстановители
- Металлы,
- водород,
- оксид углерода ( II) ,
- углерод,
- сероводород,
- аммиак

Сильные окислители
- Фтор,
- Кислород,
- Озон,
- Галогены,
- Азотная кислота,
- Серная кислота,
- Перманганат калия

Закрепление
- Дайте характеристику реакции оксида железа ( III) с алюминием по всем классификационным признакам,
2) Рассмотрите взаимодействие метана с хлором с позиции окисления-восстановления
3) Охарактеризуйте окислительно-восстановительные свойства кислорода в реакциях с простыми и сложными веществами. Запишите уравнения реакций и рассмотрите их в свете ОВР







































