ОГЭ-2018.Тренажёр.
Задания - тренажер, для повторения и обобщения знаний по химии. Задания составлены на основе открытого банка заданий ФИПИ.
Вариант 1
|
При выполнении заданий 1–15 в поле ответа запишите одну цифру, которая соответствует номеру правильного ответа.
|
1. Химический элемент, в атомах которого по слоям 2,8,6, образует высший оксид:
1. SеО3 ; 2. SО3; 3. N2О3: 4. Р 2О3
2. В главных подгруппахпериодической системы с увеличением заряда ядер атома химических элементов:
1. Усиливаются неметаллические свойства;
2. Уменьшаются металлические свойства;
3.Изменяется валентность в водородных соединениях;
4.Остается постоянной высшая валентность.
3. Химическая связь в кристалле хлорида натрия:
1. Ковалентная неполярная, 2. Ковалентная полярная, 3. Металлическая
4. Ионная
4. Степень окисления -4, а валентность IV атом углерода имеет в соединении:
1. СО2; 2. СН4; 3 Н2СО3; 4. ССl4
5. В перечне веществ, формулы которых:
А. НNО3 Б NН3 В СО2 Г Nа2СО3 Д СаО, Е Р 2О5 к оксидам относятся:
1. АВД ; 2.ВДЕ; 3. БГД; 4. АГЕ
6. Горение сероводорода 2 Н2S +3О2 →2Н2О + 2SО2 является реакцией:
1. окислительно – восстановительной, некаталитической, экзотермической;
2. окислительно – восстановительной, каталитической, эндотермической;
3. замещения, некаталитической, эндотермической;
4. обмена, некаталитической, экзотермической
7. К сильным электролитам не относятся:
1.НВr; 2. НСl; 3. Н2S; 4. Н2SО4
8 Сокращенному ионному уравнению соответствует Zn2+ +2OH- →Zn(OH)2 левая часть схемы уравнения химической реакции:
1. ZnSО4 +KOH; 2. Zn(NO3)2 + Cu(OH)2 ; 3.Zn О +KOH ; 4. ZnS + Ca(OH)2
9 Возможно химическое взаимодействие между следующими веществами:
1. Al + Ne ; 2.Cu+ Н2; 3. Zn +P; 4. Fe + Н2
10. Оксид железа(III) не взаимодействует
1. с соляной кислотой; 2. водой; 3.гидроксидом натрия; 4. водородом
11. С гидроксидом бария реагирует каждое из двух веществ:
1. НСl + КСl; 2. Н2SО4+ К3РО4 ; 3. Н2SО4 +NаОН; 4. NаСl + К2SО4
12. С нитратом меди (II) может взаимодействовать:
1. Оксид углерода(IV); 2. Гидроксид кальция; 3. Гидроксид железа (II);
4. Соляная кислота
13. Верны ли следующие утверждения
А В лаборатории нельзя знакомиться с запахом веществ;
Б Серную кислоту следует растворить в горячей воде.
1. верно только А;
2. верно только Б;
3. верны оба суждения;
4. оба суждения неверны
14. В уравнении окислительно – восстановительной реакции
Н NО3 →Н2О + NО2 + О2 коэффициент перед формулой восстановителя равен
1. 1; 2.2; 3. 3; 4. 4
15. На какой диаграмме распределение массовых долей элементов соответствует количественному составу фтороводорода


 а
а
|
При выполнении заданий 16, 17 из предложенного перечня ответов выберите два правильных и запишите в таблицу цифры, под которыми они указаны.
|
16 .В ряду химических элементов N – P – As
1. Уменьшается электроотрицательность;
2.Увеличивается сила образуемых кислородсодержащих кислот;
3.Уменьшаютсямисвойства соединений Н3Э;
4. Уменьшается радиус атом;
5. Увеличивается значение высшей степени окисления.
17. метан реагирует:
1. с 1 водородом;
2. хлором;
3. водой;
4 кислородом;
5. оксидом натрия
|
При выполнении заданий 18, 19 к каждому элементу первого о столбца подберите соответствующий элемент из второго столбца. Запишите выбранные цифры под соответствующими буквами. Цифры в ответе могут повторяться.
|
18. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества
|
Вещества
А КI(р-р) и К3РО4(р-р)
Б Fe(NО3) 3(р-р) и Fe2 (SО4)3(р-р)
В NаСl(р-р) и CaI2(р-р)
|
Реактив
1 СН3СООН (р-р)
2 NаОН(р-р)
3 АgNО3(р-р)
4 ВаСl2(р-р)
|
|
19. Установите соответствие между двумя веществами и реагентами, с которыми это вещество может реагировать
|
Вещества
А серная кислота
Б оксид бериллия
В бромид меди(II)
|
Реагент
1 НСl, SО3
2 Fe(ОН) 2 NН3(р-р)
3 NаОН(р-р) SiО2
4С а(OH)2(р-р) и Сl2(р-р)
|
Часть 2
22. Используя метод электронного баланса, составьте уравнения реакции
S+НNО2 → Н2SО4 + NO + Н2О
Определите окислитель и восстановитель
21. Прирастворении 10 г технического цинка в избытке соляной кислоты выделилось3,1 л (н. у..) водорода. Определите массовую долю примесей в этом образце цинка.
22. Даны вещества: Мg НСl(раз.), Fe, Аl, КОН, Cu SО4
Используя воду и необходимые вещества только из списка, получите в две стадии гидроксид магния. Опишите признаки проводимых реакций. Для реакции обмена напишите сокращенные уравнения реакций.
Вариант 3
|
При выполнении заданий 1–15 в поле ответа запишите одну цифру, которая соответствует номеру правильного ответа.
|
 На приведенном рисунке изображена модель атома
На приведенном рисунке изображена модель атома
1. бора, 2. алюминия, 3. азота, 4.берилия
2. Порядковый номер химического элемента в периодической системе Д.И. Менделеева соответствует:
1. Числу электронов в атоме,
2. Значению высшей валентности по кислороду,
3. Числу электронов, не достающих до завершения внешнего электронного слоя,
4. Число электронных слоев в атоме
3. Ионной связью образованно каждое из двух веществ:
1. хлорид барияи нитрид лития,
2. фосфин и аммиак,
3. Оксид углерод(II) и оксид бария,
4. Оксид углерода (IV) и оксид фосфора (V)
4. Азот проявляет одинаковую степень окисления в каждом из двух веществ, формулы которых
1. N2О5 и LiNО3 ; 2. Li3N и NО2; 3. NО2 и H NО2;, 4. NH 3 и H NО2
5. К кислотным оксидам относит каждое из двух веществ:
1.СО2 и СаО; 2. SО2 и СО; 3. SО2 и Р2О5 ; 4. Аl 2О3 и Р2О5
6. Выпадение осадка голубого цвета является признаком реакции между веществами:
1. гидроксидом натрия и соляной кислотой,
2. Карбонатом калия и хлоридом кальция,
3. Сульфатом аммония и хлоридом бария,
4. Нитратом меди(II) и гидроксидом бария
7. Хлорид – анионы образуются при электролтитческой диссоциации:
1. КСlО4; 2. КСlО3; 3. СН3Сl; 4.КСl
8. Взаимодействие соляной кислоты и едкого натра отвечает краткое ионное уравнение
1. НСl + ОН-→ Н2 О + Сl –
2. Н+ + ОН-→ Н2 О
3. Н+ + Nа ОН→ Н2О + Nа+
4. Н ++Сl- + ОН-→ Н2 О + Сl –
9. Алюминий образует сульфат алюминия при взаимодействие с:
1. серой; 2. серной кислотой; 3. сернистой кислотой; 4. сероводородом
10. Оксид железа (II) взаимодействует с раствором:
1. аммиака, 2. бромоводородом, 3. карбонатом калия, 4. хлоридом натрия
11. С серебром и оксидом меди (II) будет реагировать:
1. соляна кислота;
2. фосфорная кислота;
3. азотная кислота;
4. угольная кислота
12. Хлорид железа (II) в водном растворе может реагировать с
1. К2S; 2. СО2; 3. SiО2 ; 4. CuО
13. Верны ли следующие суждения
А. При попадании раствора щелочи на кожу рук его надо смыть водой, а затем обработать раствором борной кислоты.
Б. При попадании раствора щелочи на кожу рук его надо смыть раствором соды
1. верно только А,
2. верно только Б,
3. верны оба суждения,
4. оба суждения неверны
14. В уравнении окислительно – восстановительной реакции
МnО +Al→Al2О3 +Mn коэффициент перед формулой восстановителя равен 1. 1; 2.2; 3. 3; 4. 4
15. Массовая доля азота в нитрате алюминия равна
1. 14,% 2. 19,7 % 3. 6,6% 4. 21,3%
|
При выполнении заданий 16, 17 из предложенного перечня ответов выберите два правильных и запишите в таблицу цифры, под которыми они указаны.
|
16. Общими для фосфора и серы является
1. наличие трех валентных электронных слоев в их атомах;
2. значение их электроотрицательности меньше, чем у хлора;
3. образование ими водородных соединений с общей формулой ЭН2;
4. образование ими простых веществ в виде двухатомных молекул;
5. одинаковые значение степени окисления в кислородных соединениях.
17. С уксусной кислотой взаимодействует вещество формула, которого
1. Н2SiО3; 2. Nа2СО3; 3. Нg; 4. Cu(OH)2; 5. ВаSО4
|
При выполнении заданий 18, 19 к каждому элементу первого столбца подберите соответствующий элемент из второго столбца. Запишите выбранные цифры под соответствующими буквами. Цифры в ответе могут повторяться
|
18. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества
|
Вещества
А AlCl3(р-р) и BaCl2(р-р)
Б CuCl2(р-р) и CuSО4(р-р)
В Al(OH)3(р-р) и Ca3 (PO4)2 (р-р)
|
Реактив
1 АgNО3(р-р)
2 фенолфталеин
3. KСl
4. NаОН(р-р)
|
|
19. Установите соответствие между двумя веществами и реагентами, с которыми это вещество может реагировать
|
Вещества
А оксид углерода (IV)
Б гидроксид калия
В сульфат меди(II)
|
Реагент
1 Fe2 (SО4) 3 (р-р) Н2SiО3
2 Mg NаОН(р-р)
3. CaSО4 Н2О
4. Fe Ba Сl2(р-р)
|
Часть 2
22. Используя метод электронного баланса, составьте уравнения реакции
PbS+НNО3 → PbSО4 + NO + Н2О Определите окислитель и восстановитель
21. Определите массу осадка, который выпадет при взаимодействии избытка карбоната калия с 17,4 г раствора нитрата бария с массовой долей последнего 15%
22. Даны вещества: Zn, НСl(раз.), Fe, Аl, К3 PО4 ,NaOH, CaCО3
Используя воду и необходимые вещества только из списка, получите в две стадии ортофосфат кальция. Опишите признаки проводимых реакций. Для первой реакции напишите сокращенные уравнения реакций.
Просмотр содержимого документа
«ОГЭ-2018.Тренажёр.»
ОГЭ-2018.Тренажёр. [email protected]
Задания - тренажер, для повторения и обобщения знаний по химии. Задания составлены на основе открытого банка заданий ФИПИ.
Вариант 1
| При выполнении заданий 1–15 в поле ответа запишите одну цифру, которая соответствует номеру правильного ответа. |
1. Химический элемент, в атомах которого по слоям 2,8,6, образует высший оксид:
1. SеО3 ; 2. SО3; 3. N2О3: 4. Р 2О3
2. В главных подгруппахпериодической системы с увеличением заряда ядер атома химических элементов:
1. Усиливаются неметаллические свойства;
2. Уменьшаются металлические свойства;
3.Изменяется валентность в водородных соединениях;
4.Остается постоянной высшая валентность.
3. Химическая связь в кристалле хлорида натрия:
1. Ковалентная неполярная, 2. Ковалентная полярная, 3. Металлическая
4. Ионная
4. Степень окисления -4, а валентность IV атом углерода имеет в соединении:
1. СО2; 2. СН4; 3 Н2СО3; 4. ССl4
5. В перечне веществ, формулы которых:
А. НNО3 Б NН3 В СО2 Г Nа2СО3 Д СаО, Е Р 2О5 к оксидам относятся:
1. АВД ; 2.ВДЕ; 3. БГД; 4. АГЕ
6. Горение сероводорода 2 Н2S +3О2 →2Н2О + 2SО2 является реакцией:
1. окислительно – восстановительной, некаталитической, экзотермической;
2. окислительно – восстановительной, каталитической, эндотермической;
3. замещения, некаталитической, эндотермической;
4. обмена, некаталитической, экзотермической
7. К сильным электролитам не относятся:
1.НВr; 2. НСl; 3. Н2S; 4. Н2SО4
8 Сокращенному ионному уравнению соответствует Zn2+ +2OH- →Zn(OH)2 левая часть схемы уравнения химической реакции:
1. ZnSО4 +KOH; 2. Zn(NO3)2 + Cu(OH)2 ; 3.Zn О +KOH ; 4. ZnS + Ca(OH)2
9 Возможно химическое взаимодействие между следующими веществами:
1. Al + Ne ; 2.Cu+ Н2; 3. Zn +P; 4. Fe + Н2
10. Оксид железа(III) не взаимодействует
1. с соляной кислотой; 2. водой; 3.гидроксидом натрия; 4. водородом
11. С гидроксидом бария реагирует каждое из двух веществ:
1. НСl + КСl; 2. Н2SО4+ К3РО4 ; 3. Н2SО4 +NаОН; 4. NаСl + К2SО4
12. С нитратом меди (II) может взаимодействовать:
1. Оксид углерода(IV); 2. Гидроксид кальция; 3. Гидроксид железа (II);
4. Соляная кислота
13. Верны ли следующие утверждения
А В лаборатории нельзя знакомиться с запахом веществ;
Б Серную кислоту следует растворить в горячей воде.
1. верно только А;
2. верно только Б;
3. верны оба суждения;
4. оба суждения неверны
14. В уравнении окислительно – восстановительной реакции
Н NО3 →Н2О + NО2 + О2 коэффициент перед формулой восстановителя равен
1. 1; 2.2; 3. 3; 4. 4
15. На какой диаграмме распределение массовых долей элементов соответствует количественному составу фтороводорода
![]()
![]()
![]() а
а![]()
| При выполнении заданий 16, 17 из предложенного перечня ответов выберите два правильных и запишите в таблицу цифры, под которыми они указаны. |
16 .В ряду химических элементов N – P – As
1. Уменьшается электроотрицательность;
2.Увеличивается сила образуемых кислородсодержащих кислот;
3.Уменьшаютсямисвойства соединений Н3Э;
4. Уменьшается радиус атом;
5. Увеличивается значение высшей степени окисления.
17. метан реагирует:
1. с 1 водородом;
2. хлором;
3. водой;
4 кислородом;
5. оксидом натрия
| При выполнении заданий 18, 19 к каждому элементу первого о столбца подберите соответствующий элемент из второго столбца. Запишите выбранные цифры под соответствующими буквами. Цифры в ответе могут повторяться. |
18. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества
| Вещества А КI(р-р) и К3РО4(р-р) Б Fe(NО3) 3(р-р) и Fe2 (SО4)3(р-р) В NаСl(р-р) и CaI2(р-р) | Реактив 1 СН3СООН (р-р) 2 NаОН(р-р) 3 АgNО3(р-р) 4 ВаСl2(р-р) |
|
19. Установите соответствие между двумя веществами и реагентами, с которыми это вещество может реагировать
| Вещества А серная кислота Б оксид бериллия В бромид меди(II) | Реагент 1 НСl, SО3 2 Fe(ОН) 2 NН3(р-р) 3 NаОН(р-р) SiО2 4С а(OH)2(р-р) и Сl2(р-р) |
Часть 2
22. Используя метод электронного баланса, составьте уравнения реакции
S+НNО2 → Н2SО4 + NO + Н2О
Определите окислитель и восстановитель
21. Прирастворении 10 г технического цинка в избытке соляной кислоты выделилось3,1 л (н. у..) водорода. Определите массовую долю примесей в этом образце цинка.
22. Даны вещества: Мg НСl(раз.), Fe, Аl, КОН, Cu SО4
Используя воду и необходимые вещества только из списка, получите в две стадии гидроксид магния. Опишите признаки проводимых реакций. Для реакции обмена напишите сокращенные уравнения реакций.
Вариант 3
| При выполнении заданий 1–15 в поле ответа запишите одну цифру, которая соответствует номеру правильного ответа. |
На приведенном рисунке изображена модель атома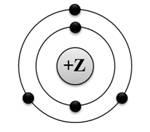
1. бора, 2. алюминия, 3. азота, 4.берилия
2. Порядковый номер химического элемента в периодической системе Д.И. Менделеева соответствует:
1. Числу электронов в атоме,
2. Значению высшей валентности по кислороду,
3. Числу электронов, не достающих до завершения внешнего электронного слоя,
4. Число электронных слоев в атоме
3. Ионной связью образованно каждое из двух веществ:
1. хлорид барияи нитрид лития,
2. фосфин и аммиак,
3. Оксид углерод(II) и оксид бария,
4. Оксид углерода (IV) и оксид фосфора (V)
4. Азот проявляет одинаковую степень окисления в каждом из двух веществ, формулы которых
1. N2О5 и LiNО3 ; 2. Li3N и NО2; 3. NО2 и H NО2;, 4. NH 3 и H NО2
5. К кислотным оксидам относит каждое из двух веществ:
1.СО2 и СаО; 2. SО2 и СО; 3. SО2 и Р2О5 ; 4. Аl 2О3 и Р2О5
6. Выпадение осадка голубого цвета является признаком реакции между веществами:
1. гидроксидом натрия и соляной кислотой,
2. Карбонатом калия и хлоридом кальция,
3. Сульфатом аммония и хлоридом бария,
4. Нитратом меди(II) и гидроксидом бария
7. Хлорид – анионы образуются при электролтитческой диссоциации:
1. КСlО4; 2. КСlО3; 3. СН3Сl; 4.КСl
8. Взаимодействие соляной кислоты и едкого натра отвечает краткое ионное уравнение
1. НСl + ОН-→ Н2 О + Сl –
2. Н+ + ОН-→ Н2 О
3. Н+ + Nа ОН→ Н2О + Nа+
4. Н ++Сl- + ОН-→ Н2 О + Сl –
9. Алюминий образует сульфат алюминия при взаимодействие с:
1. серой; 2. серной кислотой; 3. сернистой кислотой; 4. сероводородом
10. Оксид железа (II) взаимодействует с раствором:
1. аммиака, 2. бромоводородом, 3. карбонатом калия, 4. хлоридом натрия
11. С серебром и оксидом меди (II) будет реагировать:
1. соляна кислота;
2. фосфорная кислота;
3. азотная кислота;
4. угольная кислота
12. Хлорид железа (II) в водном растворе может реагировать с
1. К2S; 2. СО2; 3. SiО2 ; 4. CuО
13. Верны ли следующие суждения
А. При попадании раствора щелочи на кожу рук его надо смыть водой, а затем обработать раствором борной кислоты.
Б. При попадании раствора щелочи на кожу рук его надо смыть раствором соды
1. верно только А,
2. верно только Б,
3. верны оба суждения,
4. оба суждения неверны
14. В уравнении окислительно – восстановительной реакции
МnО +Al→Al2О3 +Mn коэффициент перед формулой восстановителя равен 1. 1; 2.2; 3. 3; 4. 4
15. Массовая доля азота в нитрате алюминия равна
1. 14,% 2. 19,7 % 3. 6,6% 4. 21,3%
| При выполнении заданий 16, 17 из предложенного перечня ответов выберите два правильных и запишите в таблицу цифры, под которыми они указаны. |
16. Общими для фосфора и серы является
1. наличие трех валентных электронных слоев в их атомах;
2. значение их электроотрицательности меньше, чем у хлора;
3. образование ими водородных соединений с общей формулой ЭН2;
4. образование ими простых веществ в виде двухатомных молекул;
5. одинаковые значение степени окисления в кислородных соединениях.
17. С уксусной кислотой взаимодействует вещество формула, которого
1. Н2SiО3; 2. Nа2СО3; 3. Нg; 4. Cu(OH)2; 5. ВаSО4
| При выполнении заданий 18, 19 к каждому элементу первого столбца подберите соответствующий элемент из второго столбца. Запишите выбранные цифры под соответствующими буквами. Цифры в ответе могут повторяться |
18. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества
| Вещества А AlCl3(р-р) и BaCl2(р-р) Б CuCl2(р-р) и CuSО4(р-р)
В Al(OH)3(р-р) и Ca3 (PO4)2 (р-р) | Реактив 1 АgNО3(р-р) 2 фенолфталеин 3. KСl 4. NаОН(р-р) |
|
19. Установите соответствие между двумя веществами и реагентами, с которыми это вещество может реагировать
| Вещества А оксид углерода (IV) Б гидроксид калия В сульфат меди(II) | Реагент 1 Fe2 (SО4) 3 (р-р) Н2SiО3 2 Mg NаОН(р-р) 3. CaSО4 Н2О 4. Fe Ba Сl2(р-р) |
Часть 2
22. Используя метод электронного баланса, составьте уравнения реакции
PbS+НNО3 → PbSО4 + NO + Н2О Определите окислитель и восстановитель
21. Определите массу осадка, который выпадет при взаимодействии избытка карбоната калия с 17,4 г раствора нитрата бария с массовой долей последнего 15%
22. Даны вещества: Zn, НСl(раз.), Fe, Аl, К3 PО4 ,NaOH, CaCО3
Используя воду и необходимые вещества только из списка, получите в две стадии ортофосфат кальция. Опишите признаки проводимых реакций. Для первой реакции напишите сокращенные уравнения реакций.








 а
а
 На приведенном рисунке изображена модель атома
На приведенном рисунке изображена модель атома

















