Обучающе-контролирующая программа "Периодический закон и периодическая система элементов Д. И. Менделеева" . Работа создана на основе программы 4 из книги Й. Нентвига, М. Кройдера и К. Моргенштерна «Химический тренажер» т.2, М.: «Мир», 1986 г. Состоит из 100 слайдов - 100 рубрик, проходя которые по назначенному программой пути, можно самостоятельно изучить эти темы. Подходит для учеников 9 и 11 классов, в том числе и для подготовки к ОГЭ и ЕГЭ
Просмотр содержимого документа
«Обучающе-контролирующая программа "Периодический закон и периодическая система элементов Д. И. Менделеева"»
Обучающе-контролирующая программа «Периодическая система элементов»
Ефимова Л.В.

Рубрика 1
Завершите следующее предложение:
Периодическая таблица элементов состоит из … периодов … групп.
Проверьте ответ в рубрике 13
13

Рубрика 2
- В 6 периоде появляется дополнительный ряд из 14 элементов – лантаноиды (f-элементы), которые помещаются между переходными d-элементами.
- Лантаноиды имеют порядковые №№ …
- Проверьте ответ в рубрике 4

Рубрика 3
- Сr и Cu имеют только по 1е во внешней оболочке. Все остальные переходные элементы, указанные в рубрике 15, имеют по 2 таких е.
- Химические свойства элементов пере-ходного ряда определяются не только числом е на внешнем уровне, но также числом е в частично заполненном предпоследнем уровне (d-подуровне).
- К какому семейству относятся переходные элементы?
К металлам
К неметаллам

Рубрика 4
- Лантаноиды: NN 58-71
- Они имеют: 2е в первой оболочке, 8е (вплоть до Gd) во второй, 18 е в третьей. В четвертой оболочке происходит заполнение с 18 е у лантана до 32е.
- Продолжайте чтение с рубрики 14.
14

Рубрика 5
- Ваш ответ показывает, что вы еще недостаточно хорошо знаете строение атомов. Прежде чем изучать дальше данную программу, вам следует повторить строение атома.
- Вернитесь к рубрике 13.

Рубрика 6
- K, Ca, Sc, Ti, Va, Cr, Mn, Fe, Co, Ni, Cu, Zn, Ga, Ge, As, Se, Br, Kr.
- 10 переходных элементов, от Sc до Zn, могут быть распределены в соответствии с их химическими свойствами по 8 группам точно так же, как и типические элементы.
- Чтобы отличить их друг от друга, их помещают соответственно в побочные (В) и главные (А) подгруппы.
- Какие элементы 4 периода принадлежат к IVB, VA, VIB, VIIIB подгруппам?
- Проверьте ответ в рубрике 18.
18

Рубрика 7
- Неправильно. Прочтите еще раз материал, начиная с рубрики 17.

Рубрика 8
- Правильно. Максимальное число внешних е равно 8
- Завершите следующие предложения:
На внешнем уровне
- Щелочные металлы имеют … е
- Щелочноземельные металлы - … е
- Галогены имеют … е
- Благородные газы - … е
- Проверьте ответ в рубрике 20.
20

Рубрика 9
- IB – Cu, IIB – Zn, IIIA – Ga, IVA – Ge.
- Ознакомьтесь с длиннопериодной формой периодической системы элементов Д.И. Менделеева.
- Запишите элементы 4, 5 и 6 периодов, которые принадлежат к главной и побочной подгруппам I группы соответственно.
- Проверьте ответ в рубрике 33.
33

Рубрика 10
- Периодическая система химических элементов была создана в 1869 г. великим русским химиком Дмитрием Ивановичем Менделеевым.
Конец программы.

Рубрика 11
- Неправильно: указанное вами число слишком мало.
- Обратите внимание на то, сколько групп существует в периодической системе. Элементы 1-й группы имеют 1 внешний электрон, 2-й – 2, 3-й – 3. Следовательно, элементы 8-й группы должны иметь максимальное число внешних электронов.
- Вернитесь к рубрике 17.
1

Рубрика 12
- Неправильно. Прочтите еще раз материал, начиная с рубрики 17.

Рубрика 13
- Периодическая система элементов состоит из 7 периодов и 8 групп.
- Найдите элементы C, S, K.
В каких по порядку электронных оболочках находятся внешние электроны у этих элементов? Найдите ответ в таблице:
С
S
В 1-й
K
Во 2-й
Во 2-й
К рубрике
Во 2-й
Во 2-й
В 3-й
В 4-й
В 3-й
В 3-й
В 4-й
В 6-й
В 1-й
28
5
32
22

Рубрика 14
- Лантаноиды – это элементы с порядковыми номерами от 58 до 71. Подобно лантану, все они имеют 2е на внешнем, 6-м уровне (Р-оболочке).
- В следующей под ней 5-й (О) оболочке у них имеется 8е или 9е. Главное различие между ними состоит в том, что заселенность в их ряду 4 (N) уровня, который является 3-м снаружи, увеличивается от 18 до 32.
- Поэтому химические свойства всех лантаноидов очень близки к свойствам лантана.
- Аналогично в 7 периоде за актинием следует ряд актиноидов. Выпишите их порядковые номера.
- Ответ проверьте в рубрике 86.
86

Рубрика 15
- В ряду переходных элементов с №№ от 21 до 30 каждый новый е поступает на d-подуровень предпоследнего уровня (на М-оболочку).
- Но в заполнении d-подуровня происходит два скачка, когда он приобретает дополнительный электрон за счет N-оболочки (4 уровня). У двух элементов имеется только по 1е на внешнем уровне. Эти элементы - … .
- Проверьте ответ в рубрике 3.
3

Рубрика 16

Рубрика 17
- Число электронов во внешней электронной оболочке атома определяет номер группы, в которой находится элемент.
- Какое максимальное число внешних электронов возможно для атома любого элемента?
Максимальное число внешних е
Переход к рубрике
4
8
16
18
32
11
8
34
29
21

Рубрика 18
- IVB – Ti, VA – As, VIB – Cr, VIIIB – Fe, Co, Ni.
- Какие элементы 4-го периода принадлежат к побочной подгруппе I, побочной подгруппе II, главной подгруппе III, главной подгруппе IV?
- Проверьте ответ в рубрике 9.
9

Рубрика 19
- Элементы с 1е или 2е на внешнем уровне принадлежат к IА и IIА группам.
- Еще раз внимательно посмотрите на периодическую систему элементов и попытайтесь определить, металлами или неметаллами являются элементы из I и II групп.
- Проверьте ответ в рубрике 26.
26

Рубрика 20
- Ответ: На внешнем уровне щелочные металлы имеют 1е, щелочноземельные – 2, галогены – 7е, благородные газы – 8е.
- Как называются главные подгруппы групп 4, 5 и 6? Главная подгруппа третьей группы – подгруппа бора.
- IV A, V A, VI A группы называются ?
- Проверьте ответ в рубрике 30.
30

Рубрика 21
- Неправильно. Вы уже должны знать, что один внешний е означает принадлежность к группе 1, два – к группе 2, три – к группе 3 и т.д. И наоборот: элементы 1-й группы имеют один внешний е, 2-й – два, 3-й – три и т.д.
17

Рубрика 22
- Правильно! Теперь убедитесь, что углерод находится во 2-м периоде, сера – в 3-м, калий – в 4-м.
- Укажите соответствующие буквы, которыми обозначаются электронные оболочки (слои), или энергетические уровни:
№ 1 - ? № 2 -? № 3 - ? № 4 - ? № 5 - ? № 6 – Р-оболочка; № 7 – Q-оболочка.
Проверьте ответ в рубрике 37.
37

Рубрика 23
- Правильно. Период, к которому принадлежит элемент, определяется номером внешнего энергетического уровня.
- А чем определяется, к какой группе принадлежит данный типический элемент?
Найдите ответ в таблице:
Числом е на внешнем энергетическом уровне
Номером внешнего энергетического уровня
Числом протонов
39
12
7

Рубрика 24

Рубрика 25
- Элементы, у которых внешние электроны находятся на Р-оболочке, принадлежат к 6-му периоду.
- Завершите предложение: период, к которому принадлежит элемент, определяется номером внешнего уровня (оболочки), в которой находятся внешние … .
- Переходите к рубрике 17.
17

Рубрика 26
- Правильно. Все элементы с 1е или 2е во внешней оболочке являются металлами.
- Зная это, можно заключить, что все переходные элементы являются металлами.
- В 4 периоде 10 переходных элементов помещаются между Ca и Ga.
- Перепишите в тетрадь весь 4 период и переходите к рубрике 6.
6
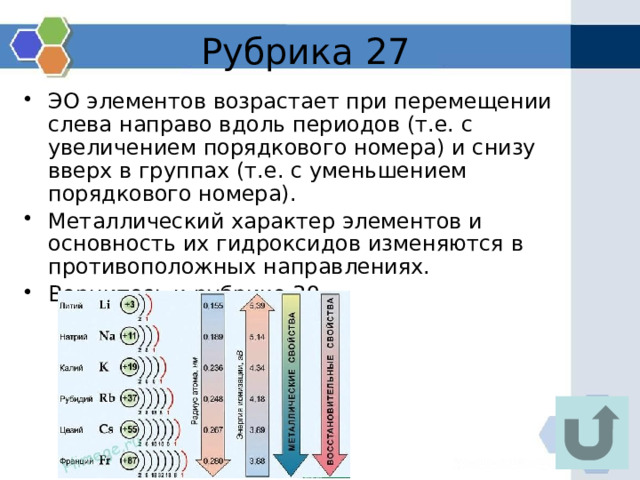
Рубрика 27
- ЭО элементов возрастает при перемещении слева направо вдоль периодов (т.е. с увеличением порядкового номера) и снизу вверх в группах (т.е. с уменьшением порядкового номера).
- Металлический характер элементов и основность их гидроксидов изменяются в противоположных направлениях.
- Вернитесь к рубрике 39.

Рубрика 28
- Неправильно. Ваш ответ показывает, что вы еще недостаточно хорошо знаете строение атомов. Прежде чем изучать дальше данную программу, вам следует повторить строение атома.

Рубрика 29
- Неправильно. Вы уже должны знать, что один внешний е означает принадлежность к группе 1, два – к группе 2, три – к группе 3 и т.д. Число 32 имеет совсем другой смысл: это максимальное число е в N-оболочке (2*4*4)
17

Рубрика 30
- Ответ: IVА группа – подгруппа углерода, VА – подгруппа азота, VIА – подгруппа кислорода.
- Правило: элемент никогда не может иметь больше 8 внешних электронов.
- Закончите предложения: Элемент № 9 называется … . Он имеет … е на К-оболочке, а также … е на L-болочке.
- Проверьте ответ в рубрике 40.
40

Рубрика 31
- Повторите материал, начиная с рубрики 39.

Рубрика 32
- Неправильно. Ваш ответ показывает, что вы еще недостаточно хорошо знаете строение атомов. Прежде чем изучать дальше данную программу, вам следует повторить строение атома.

Рубрика 33
- IA: K, Rb, Cs; IB: Cu, Ag, Au.
- Сопоставление этих подгрупп показывает, насколько значительно различие между типическими и переходными элементами. Хотя все последние являются металлами, их химические свойства значительно отличаются от свойств непереходных металлов. Сравните щелочные металлы главной подгруппы и благородные побочной.
- Ниже приведены 4 набора элементов 5-го периода. Выберите тот, который содержит элементы побочных подгрупп I, II, III, IV.
Rb Sr
Ag Cd
Rb Sr
Ag Cd
In Sn
Y Zr
Y Zr
In Sn

Рубрика 34
- Неправильно. Вы уже должны знать, что один внешний е означает принадлежность к группе 1, два – к группе 2, три – к группе 3 и т.д. И наоборот: элементы 1-й группы имеют один внешний е, 2-й – два, 3-й – три и т.д.
17

Рубрика 35
- На М(3) уровне могло бы еще поместиться 10е. Его полная емкость равна 18е.
- Заполнение 3-го уровня до полных 18е происходит у переходных элементов с № от 21 до 30.
- Главные подгруппы образованы типическими элементами, у которых застраивается внешний уровень(s- и р-подуровни).
- Побочные подгруппы образованы переходными элементами, у которых застраивается предпоследний уровень (d-подуровень).
- Завершите: каждый типический элемент имеет на 1е больше, чем предыдущий, в … электронной оболочке. Каждый переходный имеет на 1е больше, чем предыдущий, в … электронной оболочке.
- Проверьте ответ в рубрике 48.
48

Рубрика 36

Рубрика 37
- Проверьте ответ: №1 – K; №2 – L;
№ 3 – M; №4 – N; №5 – O-оболочки.
- Завершите следующее предложение: Если внешние электроны элемента находятся в Р-оболочке, то этот элемент принадлежит к … периоду.
- Проверьте ответ в рубрике 25
25

Рубрика 38
- Неправильно. Прочтите еще раз материал, начиная с рубрики 35.

Рубрика 39
- Правильно. Номер группы типического элемента определяется числом электронов во внешней оболочке.
- При перемещении слева направо в пределах каждого периода происходит уменьшение металлических свойств элементов и возрастание неметаллических свойств. Металлы 2-го периода: Li, Be.
Неметаллы: B, C, N, O, F, Ne.
- Перечислите металлические элементы 3-го периода. Ответ в рубрике 49.
49

Рубрика 40
- Ответ: Элемент № 9 – фтор. Он име-ет 2е на К-оболочке (первом энерге-тическом уровне) и 7е на L-оболочке (втором энергетическом уровне).
- Запишите распределение электронов по уровням для элемента № 18: Элемент № 18 называется … . Он имеет на 1-м энергетическом уровне … е, на 2-м - … е, на 3-м - … е.
- Проверьте себя в рубрике 50.
50

Рубрика 41
- Вы еще недостаточно хорошо ориентируетесь в периодической системе элементов Д.И. Менделеева.
- Прочтите еще раз материал, начиная с рубрики 95.

Рубрика 42
- Проработайте еще раз внимательно материал, начиная с рубрики 39.

Рубрика 43

Рубрика 44
- Н 2 О вода, Н 2 S сероводород. Кислотность заметно возрастает: вода нейтральное соединение, раствор H 2 S – слабая кислота.
- H 2 Se и H 2 Te еще более сильные кислоты, чем H 2 S.
- Кислотность гидридов повышается слева направо в периодах и сверху вниз в группах.
- Какая из кислот самая сильная?
Н 2 S
HCl
HBr

Рубрика 45
- Совершенно верно.
- Правило: как только заселенность уровня достигает 8 электронов, начинается заполнение следующей оболочки.
- Поэтому не полностью заполненная М(3) оболочка у калия становится внутренней.
- Сколько электронов могло бы еще поместиться на М(3-ем) уровне?
- Проверьте ответ в рубрике 35.
35

Рубрика 46
- Нет, сурьма Sb не является наиболее ярко выраженным металлом среди элементов V группы, хотя она имеет металлический блеск. Металлический характер элементов возрастает сверху вниз.
- Какой элемент находится в самом низу V группы?
в рубрике 68.
68

Рубрика 47
- Неправильно. Прочтите еще раз материал, начиная с рубрики 35.

Рубрика 48
- Ответ: каждый типический элемент имеет на 1е больше, чем предыдущий, во внешней электронной оболочке. Каждый переходный имеет на 1е больше, чем предыдущий, в предпоследней электронной оболочке.
- В 4 периоде переходными являются элементы с № от 21 до 30.
- Какие номера у переходных элементов 5-го и 6-го периодов?
- Проверьте ответ в рубрике 57.
57

Рубрика 49
- Металлы в 3-м периоде: Na, Mg, Al. Si находится на границе раздела между металлами и неметаллами.
- Правило: металлический характер элементов возрастает при перемещении сверху вниз в пределах каждой группы.
- Перечислите все металлы IVA группы .
- Проверьте ответ в рубрике 59.
59
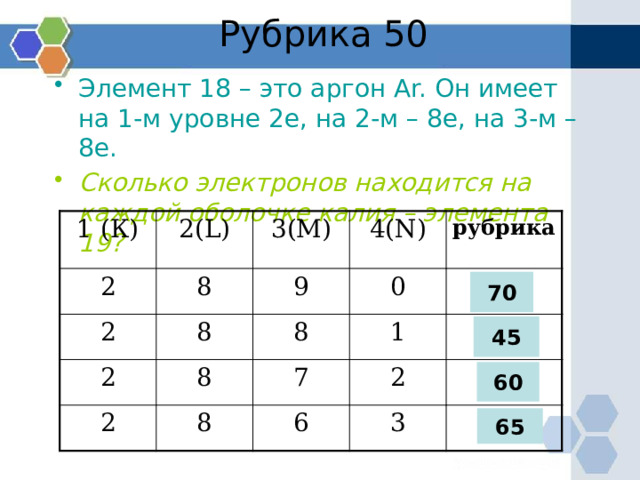
Рубрика 50
- Элемент 18 – это аргон Ar. Он имеет на 1-м уровне 2е, на 2-м – 8е, на 3-м – 8е.
- Сколько электронов находится на каждой оболочке калия – элемента 19?
1 (К)
2
2(L)
2
3(M)
8
2
4(N)
9
8
2
8
8
0
рубрика
1
7
8
2
6
3
70
45
60
65

Рубрика 51
- Теперь об элементах побочных подгрупп. Между элементами Ca и Ga в 4-м периоде пропущено 10 элементов.
- Распределение е:
- у Са(№ 20): 2,8,8,2;
- у Ga (№ 31): 2,8,18,3.
- Какая электронная оболочка заполняется у переходных элементов с №№ от 21 до 30? Ответ проверьте в рубрике 15.
15

Рубрика 52
- Вы еще недостаточно хорошо ориентируетесь в периодической системе элементов Д.И. Менделеева.
- Прочтите еще раз материал, начиная с рубрики 95.

Рубрика 53
- Al(OH) 3 – амфотерный гидроксид.
- Si(OH) 4 вообще не является основанием. Когда это вещество теряет молекулу воды, получается кремниевая кислота H 2 SiO 3 .
- Способность элементов 3-го периода образовывать кислородсодержащие кислоты возрастает в таком порядке: H 3 PO 4 – средней силы, H 2 SO 4 –сильная, HClO 4 – очень сильная.
- Итак, как изменяются свойства элементов и их соединений слева направо в периодах и снизу вверх в группах?
Металлический ха-
Возрастает
рактер элементов
ЭО элементов
Убывает
Основность
Возрастает
рубрика
Убывает
гидроксидов
Возрастает
Убывает
Возрастает
Убывает
Убывает
Убывает
Убывает
Возрастает
27
74
64
42

Рубрика 54
- Это HF, HCl, HBr, HI.
- Эти газы при растворении в воде образуют кислоты, которые имеют неодинаковую силу. HCl – сильная, а HI – еще более сильная кислота.
- Правило: кислотность соединений водорода с элементами одной группы возрастает при переходе сверху вниз.
- Запишите формулы и названия водородных соединений первых двух элементов VI группы. Ответ в № 44
44

Рубрика 55

Рубрика 56

Рубрика 57
- Переходными в 5-м периоде являются элементы № 39 - № 48, в 6-м - № 57 - № 80.
- В чем заключается принципиальное различие между типическими и переходными элементами? Найдите верный ответ:
Главная разница
В атомных массах
рубрика
В числе нейтронов
В положении валентных е на электронных оболочках
Классификация условна
47
73
67
38

Рубрика 58
- Большинство элементов, образующих катионы, имеют на внешнем уровне 1, 2 или 3 электрона. Они превращаются в положительно заряженные ионы, отдавая свои валентные электроны.
- Образующиеся ионы имеют во внешней электронной оболочке 8е (октет), или конфигурацию благородного газа.
- Являются ли элементы первых трех групп преимущественно:
металлами
неметаллами
31
81

Рубрика 59
- В IVА группе к металлам относятся Pb и Sn. Германий Ge тоже рассматривается как металл, хотя по некоторым химическим свойствам его следует отнести скорее к неметаллам.
- Эта группа начинается неметаллом C , при переходе к Si и Ge металлический характер элементов постепенно увеличивается, и группа завершается металлами Sn и Pb.
- Учитывая это, ответьте, какой элемент VA группы должен иметь наиболее ярко выраженный металлический характер :
Bi
68
As
Sb
75
46
68

Рубрика 60
- Неправильно. Заполнение N (4) оболочки не может начаться, пока на М(3) оболочке еще нет восьми электронов.

Рубрика 61
- За разъяснениями обратитесь в рубрику 87.
87
![Рубрика 62 Al(OH) 3 + 3HCl = AlCl 3 + 3H 2 O Здесь он реагирует как основание. В реакции с сильным основанием он ведет себя как кислота: Al(OH) 3 + NaOH = Na[Al(OH) 4 ] гидроксид алюминия растворяется в гидроксиде натрия. Каков кислотно-основный характер Al(OH) 3 ? Запишите термин, обозначающий двойственность свойств. Проверьте ответ в № 53. 53](https://fsd.multiurok.ru/html/2024/03/28/s_6605cd3ddd9e7/img62.jpg)
Рубрика 62
- Al(OH) 3 + 3HCl = AlCl 3 + 3H 2 O
Здесь он реагирует как основание.
- В реакции с сильным основанием он ведет себя как кислота:
Al(OH) 3 + NaOH = Na[Al(OH) 4 ]
гидроксид алюминия растворяется в гидроксиде натрия.
- Каков кислотно-основный характер Al(OH) 3 ? Запишите термин, обозначающий двойственность свойств.
- Проверьте ответ в № 53.
53

Рубрика 63
- Слева от О в периодической системе находятся азот и углерод. Они образуют аммиак и метан, которые не диссоциируют с образованием протонов.
- Ниже указаны 4 пары соединений водорода. Найдите среди них такую пару, в которой первое соединение - кислота, а второе – гидрид.
NH 3
HF
HBr
HI
NaH
CH 4
CaH 2
SiH 4

Рубрика 64
При увеличении порядкового номера элементов в периодах и уменьшении его в группах происходят:
- Ослабление металлических свойств элементов и усиление неметаллических;
- Возрастание ЭО элементов;
- Уменьшение основности гидроксидов элементов и возрастание кислотности кислородсодержащих кислот.
- Является ли Са(ОН) 2 более сильным основанием, чем Ва(ОН) 2 ?
да
нет

Рубрика 65
- Неправильно. Заполнение N (4) оболочки не может начаться, пока на М(3) оболочке еще нет восьми электронов.

Рубрика 66
- За разъяснениями обратитесь в рубрику 87.
87

Рубрика 67
- Какими признаками определяется период, к которому принадлежит какой-либо типический элемент?
Ответ
Числом е на внешнем энергетическом уровне
Рубрика
Числом протонов
Номером внешнего уровня
55
43
23

Рубрика 68
- Правильно. Висмут является послед-
ним элементом в группе V. Он имеет наиболее ярко выраженный металлический характер .
- Ионы бывают двух видов: катионы, или положительно заряженные ионы, и анионы, или отрицательно заряженные ионы.
- Какие элементы легче образуют катионы:
Металлы
Неметаллы
Не знаю
81
88
58

Рубрика 69
- Из всех элементов Cs легче всего образует катион. Иными словами, цезий легче всего отдает электрон и поэтому является наиболее электроположительным элементом.
- Наоборот, элементы, которые легко присоединяют электроны, являются электроотрицательными. Электроотрицательность (ЭО) возрастает при перемещении снизу вверх в группах и слева направо в периодах.
- Какой элемент самый электроотрицательный?
(не учитывать 8 группу и 7 период).
- Ответ проверьте в рубрике 79.
79

Рубрика 70
На 3(M) уровне не может оказаться 9е, если 4(N) уровень не занят. Как только на М-оболочке окажется 8е, у следующего элемента начинается заполнение N-оболочки.

Рубрика 71
- Это пентаоксид диазота, или оксид азота (V) N 2 O 5 .
- Высшие валентности, равные номеру груп-пы, могут достигаться в соединениях эле-ментов, но существует много кислородных соединений, в которых элементы проявляют более низкие валентности.
- Укажите, какие валентности проявляют элементы в следующих оксидах: NO, NO 2 , SO 3 , SO 2 , Cl 2 O 7 , Cl 2 O, ClO 2 .
- Проверьте ответ в рубрике 95.
95

Рубрика 72
- Это гидроксид цезия CsOH.
- Первые четыре гидроксида элементов 3-го периода таковы: NaOH, Mg(OH) 2 , Al(OH) 3 , Si(OH) 4 .
- Выберите из них наиболее сильное основание … и наиболее слабое основание … .
- Проверьте ответ в рубрике 82.
82

Рубрика 73
- Неправильно. Прочтите еще раз материал, начиная с рубрики 35.

Рубрика 74
- Металлический характер элементов уменьшается слева направо вдоль периодов (т.е. с увеличением порядкового номера) и к верхней части группы (т.е. с уменьшением порядкового номера).
- В этих же направлениях уменьшается основность гидроксидов, но не ЭО элементов.
- Вернитесь к рубрике 39.

Рубрика 75
- Нет, мышьяк Аs не является наиболее ярко выраженным металлом среди элементов V группы, хотя она имеет металлический блеск. Металлический характер элементов возрастает сверху вниз.
- Посмотрите, какой элемент находится в самом низу V группы
59

Рубрика 76
- За разъяснениями обратитесь в рубрику 94.
94

Рубрика 77
- LiH гидрид лития, BeH 2 гидрид бериллия, BH 3 гидрид бора (боран), CH 4 метан, NH 3 аммиак, H 2 O вода, HF фтороводород.
- Боран не удалось изолировать; он существует только в виде димеров диборана В 2 Н 6 ,
- Кислотность соединений водорода возрастает с увеличением порядкового номера связанного с водородом элемента в периоде.
- Какие из указанных выше соединений диссоциируют с образованием протонов?
- Ответ проверьте в рубрике 91.
91

Рубрика 78
- У водорода, как и у щелочных металлов, 1е на внешнем уровне. Как и галогенам, ему не хватает 1е для завершения внешнего уровня до конфигурации благородных газов.
- Итак, вы познакомились с некоторыми правилами и периодическими закономерностями расположения элементов в периодической системе и убедились в том, что последовательность расположения в ней элементов определяется электронным строением их атомов.
- Это позволит вам осознать огромное значение открытия периодического закона и создания периодической таблицы Д, И. Менделеевым.
- Периодическая таблица была создана … в 1869 г. Ответ в рубрике 10.
10

Рубрика 79
- Наиболее электроотрицательным элементом является F (находится в верхнем правом углу таблицы, где сосредоточены неметаллы, кроме элементов побочных подгрупп). Он очень легко присоединяет е.
- Наиболее электроположительный элемент – Cs (находится в левом нижнем углу таблицы, где сосредоточены металлы.).
- Граница проходит вдоль B, Si, As, Te и At, которые относят к неметаллам.
- Пограничное положение занимают так называемые переходные элементы.
- Найдите эту границу и перечислите примыкающие к ней со стороны металлов переходные элементы.
90
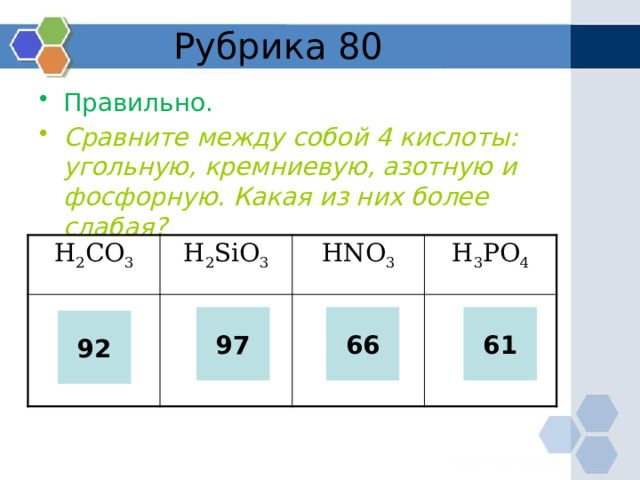
Рубрика 80
- Сравните между собой 4 кислоты: угольную, кремниевую, азотную и фосфорную. Какая из них более слабая?
H 2 CO 3
H 2 SiO 3
HNO 3
H 3 PO 4
97
66
61
92
Рубрика 81
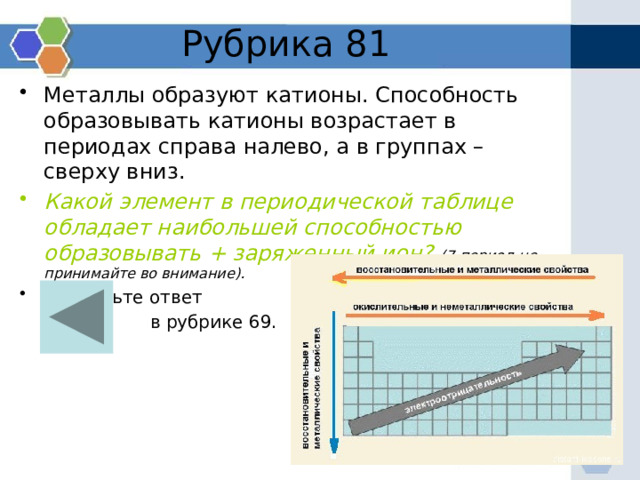
- Металлы образуют катионы. Способность образовывать катионы возрастает в периодах справа налево, а в группах – сверху вниз.
- Какой элемент в периодической таблице обладает наибольшей способностью образовывать + заряженный ион? (7 период не принимайте во внимание).
в рубрике 69.
69

Рубрика 82
- Наиболее сильное основание NaOH, а наиболее слабое – Si(OH) 4 .
- NaOH – сильное основание, он образует соли при взаимодействии с кислотами. Mg(OH) 2 – более слабое основание. Al(OH) 3 – амфотерный гидроксид: с кислотами он реагирует как основание. А с основаниями – как кислота.
- Запишите уравнение реакции взаимодей-ствия гидроксида алюминия с соляной кислотой. Ответ в рубрике 62.
62

Рубрика 83
- За разъяснениями обратитесь в рубрику 94.
94

Рубрика 84
- Оксиды элементов 3-го периода: Na 2 O, MgO, Al 2 O 3 , SiO 2 , P 2 O 5 , Cl 2 O 7 . Ar – благородный газ, оксида не образует.
- Валентность по отношению к кислороду у элементов любого периода растет с ростом порядкового номера.
- Высшая валентность по кислороду равна номеру группы.
- Каким должен быть высший оксид азота? Проверьте ответ в № 71.

Рубрика 85

Рубрика 86
- К актиноидам относятся элементы с порядковыми номерами 90 – 103.
- Для переходных элементов также существуют определенные закономерности свойств в зависимости от расположения по подгруппам, хотя проявляются они не всегда так четко.
- Переходные элементы, как и типические, проявляют свои высшие валентности в соединениях с кислородом; их высшая валентность совпадает с № группы за счет валентных d-электронов.
- Укажите высшие валентности Cr и Mn.
93

Рубрика 87
- Гидроксиды металлов – основания. Гидроксиды неметаллов (или их дегидратированные формы) являются кислотами, сила которых возрастает при переходе к неметаллам верхней правой части таблицы.
- Кислотность кислот возрастает в периодах слева направо, в группах – снизу вверх.
- Тот из элементов, который располагается ниже и левее других, должен образовывать более слабую кислоту. Этот элемент:
N
P
С
Si

Рубрика 88
- Неправильно. Неметаллы образуют анионы.
- Переходите к чтению рубрики 58.

Рубрика 89
- Основность гидроксидов элементов одной группы возрастает при увеличении порядкового номера элементов. Са № 20 расположен выше Ва № 56. значит, гидроксид кальция - более слабое основание по сравнению с гидроксидом бария.
- Проработайте еще раз материал, начиная с рубрики 72.

Рубрика 90
- Ответ: Be, Al, Ge, Sb, Po.
- У каждого из них сосед со следующим порядковым номером является неметаллом.
- Основность гидроксидов различных элементов изменяется так же, как и ЭО: возрастает в периодах справа налево и в группах сверху вниз.
- Гидроксид какого металла должен быть самым сильным основанием? Ответ
72

Рубрика 91
- При растворении в воде с отрывом протона диссоциирует HF и вода (очень слабо).
- В LiH водород находится в анионной форме – в виде гидрид-иона Н - .
- Элементы других периодов также могут образовывать с Н либо гидриды, либо кислоты.
- Какие кислоты образуются первыми четырьмя элементами VII группы в соединении с водородом?
- Ответ проверьте в рубрике 54.
54

Рубрика 92
- За разъяснениями обратитесь в рубрику 87
87

Рубрика 93
- Сr имеет высшую валентность 6, а Mn – 7 .
- Поскольку VIIIA группа содержит только благородные газы, которые не вступают в обычные химические реакции, иногда ее называют нулевой группой.
- Элемент Н также обладает исключительными свойствами. Хотя его помещают в IA группу, он не является щелочным металлом. (Н) помещают также в подгруппу галогенов, хотя он таковым не является.
- Почему водород занимает в периодической системе двойственное положение?
78

Рубрика 94
- Кислотность соединений Н с разными элементами возрастает при перемещении к правой части периодов и нижней части групп. Чтобы правильно ответить на вопрос, сравните положения серы, хлора и брома в таблице Менделеева.
- Какой из них ближе всего к правому нижнему углу таблицы?
Cl
S
Br

Рубрика 95
- Это соответственно: 2, 4, 6, 4, 7, 1, 4.
- Рассмотрим теперь валентности по отношению к Н. Она увеличивается в каждом периоде от 1-й до 4-й группы, затем уменьшается с ростом № группы.
- Начиная с 4 группы, сумма валентностей по О и по Н равна 8.
- Запишите формулы водородных соединений элементов 2-го периода и дайте им названия.
- Проверьте себя в рубрике 77.
№ группы
1
Валентность по Н
2
1
3
2
4
3
5
4
6
3
7
2
1
77

Рубрика 96

Рубрика 97
Правильно
Подведем итог сказанному.
- Почти все неметаллы образуют кислородсодержащие кислоты.
- Высшие валентности элементов достигаются в их соединениях с О.
- Высшая валентность элемента равна № группы, к которой он принадлежит.
- Запишите формулы и названия оксидов элементов 3-го периода.
- Проверьте ответ в рубрике 84.
84


Литература
- Работа создана на основе программы 4 из книги Й. Нентвига, М. Кройдера и К. Моргенштерна «Химический тренажер» т.2
М.: «Мир», 1986 г.



































































![Рубрика 62 Al(OH) 3 + 3HCl = AlCl 3 + 3H 2 O Здесь он реагирует как основание. В реакции с сильным основанием он ведет себя как кислота: Al(OH) 3 + NaOH = Na[Al(OH) 4 ] гидроксид алюминия растворяется в гидроксиде натрия. Каков кислотно-основный характер Al(OH) 3 ? Запишите термин, обозначающий двойственность свойств. Проверьте ответ в № 53. 53](https://fsd.multiurok.ru/html/2024/03/28/s_6605cd3ddd9e7/img62.jpg)























































