Органикалык эмес химия
Адабияттар
Н.А. Глинка «Общая химия» Ленинград «Химия» 1987.
Н.С. Ахметов Неорганическая химия Москва «Высшая школа» 1975
И.А. Зубович «Неорганическая химия» Москва «Высшая школа» 1989
К. Рысмендиев «Жалпы химиянын теориялык негиздери » Фрунзе «Мектеп »
В.В. Фролов Химия Москва «Высшая школа» 1979
Л.А. Никалаев Общая неорганическая химия Москва «Прос-я » 1975
Г.Н. Лучинский Курс химии Изд. «Высшая школа» 1967
Лабораториялык сабактар \ч\н
Л.В. Бабич
С.А. Балезин Практикум по неорганической химии М. «Прос-е» 1991
Г.Е. Левант Практикум по общей химии Изд. «Высшая школа» 1963
Г.А. Райцын
10. В.И. Семишин Практикум по общей химии Изд. «Высшая школа» 1954
Кириш съз
Материя жана анын кыймылы
Химиянын предмети
Химиянын мааниси
Химия – бизди курчап турган д\йнън\ анда болуп жаткан кубулуштарды \йрът\\ табигый илимдердин катарына кирет. Б\тк\л жаратылыш д\йнъ адамдын аё сезиминен сырткары жана къз карандысыз жашайт. Д\йнъ материалдуу, бардык курчап турган нерселер, кыймылдагы материянын бир т\р\. Материя ар дайым, тынымсыз кыймылда ъзгър\\дъ жана ън\г\\дъ гана жашай алат. Башкача айтканда кыймыл тынымсыз ъзгър\\ материяга б\т бойдон жана анын ар бир майда бъл\кчъс\нъ тиешел\\.
Материянын формалары ар т\рд\\, алар дайыма бири-бирине ът\п турат. Материянын кыймылынын т\рд\\ формалары, т\рд\\ илимдер: Физика, биология жана башка тарабынан \йрът\лът. Ал эми табяттын жалпы ън\г\\ закондору материялистик диалектика тарабынан \йрът\лът.
Берилген шартта белгил\\ физикалык каситеттерге ээ болгон материянын ар бир жекече т\р\ зат деп аталат. М: Суу, темир, к\к\рт, акиташ, кычкылтек жана башка заттар болуп эсептелет.
Ач- сары т\стъг\, сууда эрибей турган тыгыздыгы 2, 07 г/см3 эр\\ температурасы 112,80С болгон криссталдар- булар к\к\рткъ м\нъзд\\ болгон физикалык каситеттер. Заттардын каситетерин аныктоо \ч\н алар таза т\р\ндъ болушу шарт. Бирок таза заттар табиятта ътъ сейрек кездешет. Адатта бизди аралашмалар курчап турат. Мисалы: табияттагы биз таза деп эсептеген суда да ар дайым эриген абалда газдар жана туздар болот. Аба къптъгъгн газдардын аралашмасы. Заттар дайыма кыймылда болушат. Мисалы: муздан коргошундун ээр\\с\, темирдин зат басуусу, отундун к\й\ш\, органикалык заттардын чириши жана башка. Мында бир заттан экинчи бир зат пайда болбосо (муздун коргошундун ээр\\с\) жана башка физикалык кубулуш, ал эми бир заттан кубулуштун негизинде башка зат пайда болсо (отундун к\й\ш\, темирдин зат басуусу) химиялык кубулуш деп аталат. Физикалык кубулуштарды физика, ал эми химиялык кубулуштарды химия илими окутат. Демек химия – заттар, алардын составы, т\з\л\ш\, касиеттери, заттардын бири-бирине айлануулары жана булл айланууларды коштоп ж\р\\ч\ кубулуштар жън\ндъг\ илим.
Химиядагы негизиг т\ш\н\ктър жана закондор.
Химиядагы негизиг т\ш\н\ктъргъ атом малекула, химиялык элемент, химиялык молекула, химиялык реакция, химиялык теёдеме, зат салыштырма атомдук масса, салыштырма молекулалык масса, моль, молярдык масса кирет.
Бул т\ш\н\ктърд\н калыптанышы атом - молекулалык окуунун калыптанышына жана ън\г\ш\нъ жараша болгон. Мунун негизин орустун окумуштуусу М.В. Ломоносов т\згън, ал эми англиялык окумуштуу Дж. Дальтон аны ън\кт\ргън.
Азыркы учурда химиялык негизги т\ш\н\ктъргъ тъмъндъг\дъй аныктамалар берилет.
Молекула-заттын химиялык касиеттерин алып ж\ргън эё майда бъл\кчъс\.
Атом-оё зарятталган ядродон жана аны айланып ж\р\\ч\ терс заряддалган электрондордон турган, элементтин химиялык каситеттерин алып ж\ргън эё кичине электронитталдуу бъл\кчъ
Молекула бир атомдон (инертт\\ газдардын молекуласы) бир нече атомдон (Cl2,H2O,CH4,C2H6) же ътъ къп атомдон (белок, нуклеин кислоталарынын молекулалары, турушу м\мк\н.
Химиялык элемент-ядролордун заряддары бирдей болгон атомдордун белгил\\ бир т\р\.
Химиялык формула-заттын составын химиялык белгилерин жана индекстердин жардамында шарттуу т\рдъ жазуу. Мисалы: H2O, An, Al2O3
:Химиялык белги- химиялык элементтин шарттуу т\рдъ белгилениши. Na, H, O. Cl, P, N
Химиялык белги элементтн латынча аталышын баш тасмгасынан же баш тамгасы менен кийинки тамгалардын биринен т\з\лът. O. OS AL, Hg, He жана башка
Химиялык реакция – Химиялык кубулуштар б.с. бир заттын экинчи затка айлануусу жаёы молекулалар пайда болот, бирок атомдор б\т\н бойдон сакталат. Химиялык реакциялар ар т\рд\\ белгилери боюнча классификацияланат.
I. Жылуулук бъл\п чыгаруу же же сиёирип алуу касиети боюнча 2ге бъл\нът.
Жылуулукту бъл\п чыгаруу менен ж\ргън реакциялар экзотермикалык реакция деп аталат.
Н2+ Сl2= 2HCl ΔH=184,6 кДж
Айлана чъйръдън жылуулукту сиёирип алуу менен ж\ргън реакциялар эндотермикалык деп аталат. N2+O2 =2NO ΔH=180,8 кДж
II. Алгачкы жана алынган заттардын санынын ъзгър\\ белгиси боюнча кошулуу, ажыроо, с\р\п чыгаруу жана орун алмашуу реакциялары болуп бъл\нът.
2 же андан ашык заттар кошулуп бир жаёы затты пайда кылуу менен ж\ргън реакциялар кошулуу реакциясы деп аталат.
HCl+NH3=NH4Cl 2 Mg+O2=2MgO
Бир затттан бир нече жаёы заттарды пайда кылуу менен ж\ргън реакциялар ажыроо реакциясы деп аталат.
2KMn O4 K2MnO4 +MnO2+O2
2H2O 2H2O2
2KClO3 2KCl +3O2
Жънъкъй заттын атомдору татаал заттын атомдорунун бирин с\р\п чыгаруу менен татаал заттын ортосундагы реакциясы деп аталат.
Pb(NO3)2+Zn Zn (NO3)2+Pb
2NaBz +Cl2=2NaCl + Bz2
Эки татаал заттын ортосундагы составдык бъл\ктър\налмаштыруунун натыйжасында жаёы заттарды пайда кылуу менен ж\ргън реакция орун алмашуу реакциялары деп аталат.
Al2O+3H2SO4=Al2(SO4)3+3H2O
CaCl2+2AgNO=Ca (NO3)2+2AgCl
Химиядагы негизги закондор
Буларга заттардын массасынын сакталуу закону, заттардын составынын туруктуулук закону, авогадро закону, кълъм\н\ катыш закону, эселик катыш закону, эквивалент закону кирет.
Массанын сакталуу закону
Реакцияга кирген заттардын массасы реакцияларда пайда болгон заттардын массасына барабар. Бул закон орустун улуу окумуштуусу М.В. Ломоносов тарабынан 1748-жылы ачылып 1756-жылы эксперименттик жол менен далилденген. Кийинчээрек 1789-жылы массасынын сакталуу закону франсуз химиги Антуан Лавуазе тарабынан ачылган жана андан ары ън\кт\р\лгън. Башкача айтканда заттардын жалпы массасы гана сакталбастан ар бир элементтин массасы да ъзгър\\с\з калаарын далилдеген.
Заттардын составынын туруктуулук закону
Ар кандай заттын составы алынган шартына жана жолуна карабай дайыма туруктуу болот. Бирок кийинчээрек изилдеп караганда, бул зокон толугу менен молекуланын т\з\л\штъг\ гана заттарга тикел\\ экендигин аныкташкан. Тагыраак айтканда молекулалык т\з\л\штъг\ заттар (органикалык заттар азыраак сандагы органикалык эмес заттар) туруктуу составына ээ, ошондой эле молекулалык эмес т\з\л\штъг\ заттар (къпч\л\к органикалык эмес заттар) туруктуу составына ээ эмес алардын составы ъзгър\п турушу м\мк\н. Ошондуктан молекулалык т\з\л\штъг\ заттар дальтониддер, ал эми ъзгър\лмъ составдагы заттар бердолиттер деп аталат.
Эселик катыш закону: къптъгън бирикмелер бири-бири менен кошулганда ушул элементтердин массаларынын катышы ар т\рд\\ болгон бир нече заттарды пайда кылышы м\мк\н. Мисалы: към\ртек кычкылтек менен эки т\рд\\ бирикмени пайда кылат. Алардын бири към\ртектин (II) оксиди же ис газы массасы боюнча 42,88% към\ртектен жана 57,12% кычкылтектен турат. Ал эми 2чи бирикмеси към\ртектин (III) кош кычкылы (оксиди) же към\р кычкыл газы анда массасы 27, 29% към\ртектен жана 72, 71% кычкылтектен турат. Эгерде ушул эки заттагы към\ртектин массасынын бирдей санына тура келген кычкылтектин массасынын (бирдей санына) санын аныктасак, ал \ч\н оксиддердин кычкылтектин \л\ш\н кърсъткън сандарды към\ртектин \л\ш\н кърсъткън сандарга бълсък, анда към\ртектин кош кычкылдагы към\ртектин массасынын 1 бирдигине тура кел\\ч\ кычкылтектин саны, към\ртектин (II) оксидиндегиге караганда туура эки эсе къп экенин кър\\гъ болот.
|
Бирикме |
Массалык \л\ш\ % | Към\рткетин массасынын бирдигине тура келген кычкылтектин массасынын бирдигинин саны |
| Към\ртектин II оксиди СО | 42,88 | 57,12 | 1,33 |
| Към\ртектин IV оксиди СО2 | 27,29 | 72,71 | 2,66 |
Мына ушуга окшогон бирикмелерди \йрън\п англиялык окумуштуу Дж. Дальтон 1803-жылы эселик катыш законун ачкан. Эгерде эки элемент бири-бири менен бир нече бирикме пайда кылса, анда бул элементтердин биринин массаларынын экинчи элементтин массаларына болгон катышы б\т\н сан т\р\ндъ болот.
Француз окумуштуусу Гей-Аюсаак реакцияга кирген жана реакциянын негизинде пайда болгон газдардын кълъмдър\н изилдеп кълъмд\к катыш законун ачкан. Реакцияга кирген газдардын кълъмдър\ бири – бири менен жана реакциянын негизинде пайда болгон газдар менен анча чоё эмес б\т\н сандар т\р\ндъ катышта болот.
Мисалы: 2 кълъм суутек 1 кълъм кычкылтек менен аракеттенишип 2 кълъм суу буусун пайда кылат.
1811-жылы италия физиги Авогадро химиялык реакция учурдагы газдардын кълъмдър\н\ жънъкъй катышта болоорун т\ш\нд\р\\ч\ законун ачкан. Ал закон тъмъдъг\дъй айтылат. Бирдей шарттарда (басымда жана температурада) ар кандай газдын бирдей кълъм\ндъ бирдей сандагы молекулалар болот. Аны NА тамгасы менен белгилейбиз да ал NA = 6,02· 1023 атомдук бирикмеге барабар. Авогадронун законунан маанил\\ натыйжа келип чыгат. Бирдей шартта ар кандай газдын 1 молу бирдей кълъмд\\ ээлейт. Эгерде 1л газдын массасы белгил\\ болсо, анын кълъм\н эсептеп чыгууга болот. Мисалы: Нормалдуу шартта, башкача айтканда 2730 К (00) температурада жана 101,3 кПа басымда 1л суутектин массасы 0,09г га барабар, ал эми анын мольядык массасы 1,008 ·2=2,016г /моль барабар. Анда 1 моль суутектин ээлеген кълъм\ тъмънк\гъ барабар.
Ошондой эле шартта 1 л кычкылтектин массасы 1, 429 г, молярдык массасы 32г/моль. Анда анын кълъм\
Демек, нармалдуу шартта ар кандай газдын 1 молу 22,4л кълъмд\ ээлейт. Бул кълъм газдын молярдык кълъм\ деп аталат.
Газдын молярдык кълъм\ - газдын кълъм\н\н анын санына болгон катышына барабар.

Эквивалент
Элементтин эквиваленти деп суутектин атомунун 1 молу менен кошулууга же ушул эле сандагы суутекти с\р\п чыгарууга жъндъмд\\ болгон элементтердин саны аталат. Мисалы HCl, H2S, NH3,CH4 бирикмелерде хлордун, к\к\ртт\н, азоттун жана към\ртек эквиваленттери 1 моль, ½ моль, 3/1 моль 4/1 моль го барабар
Эквивалент закону - Заттар бири – бири менен кошулганда алар эквиваленттерине прапорциялаш т\рдъ кошулат.
Азыркы учурда адамдын турмушунда ъзгъчъ ънд\р\ш тармагында химия чоё роль ойнойт. Химиялык продукцияны пайдаланбаган ънд\р\шт\н бир да тармагы жок. Жаратылыш бизге эё алгачкы сырьелерду, жыгачты, руданы, нефти, абаны жана башка гана бере алат. Ошол сырьелерду кайра иштет\\ аркылуу айыл чарбасына, ънд\р\шкъ, \й-тиричилигине керект\\ заттар. Мисалы: жер семирткичтер, металлдар, пластмассалар, боектор, дары-дармектер, самындар, соода жана башка алынат. Сырьелерду иштет\\ \ч\н заттардын айланууларынын жалпы закон ченемд\\л\ктър\н бил\\ керек. Ошондой эле мындай билимди бизге, химия илими гана берет. Демек жыйынтыктап айтканда химия илими да башка табигый илимдер сыяктуу эле адамдын практикалык талабынан, муктаждыгынан келип чыгат.
Химиялык байланыш
Химиялык байланыш жън\ндъ жалпы т\ш\н\к
Коваленттик байланыш (уюлдуу жана уюлсуз коваленттик байланыштар)
Иондук байланыш
Металлдык байланыш
Суутектик байланыш
Бонордук – акцептордук байланыш
Къпч\л\к элементтердин атомдору бири - бири менен же башка элементтердин атомдору менен ъз ара биригип, химиялык байланышты пайда кылып, салыштырмалуу туруктуу болуп калышат. Натыйжада молекулалар же же иондордон турган криссталдык торчолор пайда болот.
Химиялык байланыш пайда болгон мезгилде системанын жыйынтыктоосу эриткичте тъмънк\ жана сырткы дэёгээли инертт\\ газдын электрондук конфигурациясындай болуп ъзгър\ш керек. Бул \ч\н адамдар сырткы электрондорун беришет. (Мисалы: металлдар же толуктап кошуп алышат) (Мисалы: Металл металл эмеатер), жана ортого топтошот. Химиялык байланышты т\з\\гъ сырткы валенттик электрондор катышат.
Химиялык байланышты пайда кылган эки атомдук терс электрл\\л\г\нъ жараша химиялык байланыштар иондун, коваленттин, суутектин, металлдын жана донор-акцентордук болуп бъл\н\шът.
Коваленттик байланыш деп эки атомдун жупташпаган воленттик электрондорунун жупташуусунун эсебинен пайда болгон химиялык байланыштын т\р\ коваленттик байланыг деп аталат.
Мында пайда болгон жуп электрон эки атомго бирдей тиешел\\ болот. Бирок байланышты пайда кылган атомдордун терс электрл\\л\ктър\нъ жараша коваленттик байланыштар уюлдуу жана уюлсуз болуп бъл\н\шът.
Терс электрл\\л\ктър\ бирдей болгон эки атомдун ортосундагы химиялык байланыш уюлсуз коваленттик байланыш деп аталат. Бул учурда пайда болгон жуп электрондор эки атомго бирдей тиешел\\ болуп, бирдей аралыкта жайгашат. Мисалы: 
Терс электрл\\л\ктър\ ътъ айырмаланбаган эки атомдун ортосунда пайда болгон химиялык байланыш уюлдук коваленттик байланыш деп аталат. Мындай жалпы электрондук жуп атомдорун бирин къздъй жылышкан болот, себеби терс электрл\\л\г\ жогору болгон атом жалпы электрондук жупту ъз\нъ къб\ръък тартат. Органикалык эмес учма заттардын молекулалары HCl, H2O, H2S, NH3 жана башкалар буларга мисал боло алат.
Мисалы: HCl молекуласынын т\з\л\ш\н
 схемасы аркылуу кърсът\лгън. Мында электрондук жуп хлордун атомуна жылышкан болот, анткени хлордун атомунун салыштырма терс электрл\\л\г\ (2, 83 суутектин атомунун терс электрл\\л\г\нън 2,1 эсе чоёураак.
схемасы аркылуу кърсът\лгън. Мында электрондук жуп хлордун атомуна жылышкан болот, анткени хлордун атомунун салыштырма терс электрл\\л\г\ (2, 83 суутектин атомунун терс электрл\\л\г\нън 2,1 эсе чоёураак.
Коваленттик байланыш-байланыштын узундугу энергиясы, каныгуусу жана багытталуусу аркылуу м\нъздълът.
Байланыштын узундугу- бул ядролордун ортосундагы аралык химиялык байланыш канчалык кыска болсо ошончолук бекемирээк келет. Бирок байланыштын бекемдигини чеги болуп анын энергиясы эсептелет.
Байланыштын энергиясы- ошол байланышты \з\\ \ч\н зарыл болгон энергия аныкталат. Демейде ал 1 моль затка тиешел\\ болгон кл Дж менен ченелет.
Тажрыйбалык маалыматтар боюнча H2,Cl2 жана N2 молекулаларындагы байланыштардын узундугу 0, 074 :0, 198 жана 0, 109 нанометр, ал эми байланыштын энергиясы 436, 242 жана 946 Дж моль.
Байланыштын каныгуусу - деп атомдун бардык валенттик электрондорун байланышты т\з\\гъ толук жумшалуусун айтабыз. Мисалы: H2, CH4 молекулаларында бардык атомдун арбиталдар жупташкан электрондор менен толтурулган, ошондуктан алардагы байланыштар каныккан деп эсептелет. Коваленттик байланыш каныккандан кийин жаёы байланыш пайда болбойт.
Байланыштын багытталуусу - молекуланын мейкиндиктеги структурасына жараша болот. Ал эми молеклванын мейкиндиктеги структурасы борбордун атомдук воленттик арбиталдарынын жайгашуусуна жана ъз ара хиприддешт\\с\нън келип чыккан формулаларына жараша болот.
Иондук байланыш
Иондордун ортосундагы электростатикалдык тартылуу к\чтър\ аркылуу ишке ашкан химиялык байланыш иондук байланыш деп аталат. Иондук байланышты терс электрл\\л\ктър\ боюнча кескин айырмаланган элементтердин атомдору пайда кылат: М: деп I жана II группалардын негизги жана кошумча подгруппаларынын металлдары VI жана VII группалардын негизги подгруппаларынын металл эместери менен иондук байланыштарды т\зът. М: Na,Cl менен иондук байланышты пайда кылат, бирок__- молекуласы буу абалында гана болот. Катуу абалда иондук торчо т\р\ндъ болот. Иондук байланышты жалпы электрондук жуптун терс электрл\\л\г\ жогору болгон атомду къздъй чегине чейин жылыш менен т\ш\нд\р\\гъ болот. Мисалы:
 жана андан ары
жана андан ары 
Суутектик байланыш
Бир молекуладагы суутектин атому менен экинчи молекуланын терс электрл\\л\г\ к\чт\\ элементинин ( ) ортосунда пайда болгон суутектик байланыш деп аталат. Микро молеклаларда мисалы: белоктордо, нуклеин кислоталарында, углеводдордо жана башка суутектик байланыш бар молекланын ар башка бъл\ктър\н\н ортосунда пайда болот. Себеи мындай элементтердин суутектин жалпы жупташкан электрондор терс электрл\\л\г\ к\чт\\ атомду къздъй жылышат да суутектин атому ошондой эле зарятталып калат. Ошентин оё зарятталган суутектин атому менен экинчи молекланын терс электрл\\л\г\ жогору жана жалпы электрондук жупту ъз\нъ тартып алып терс зарятталган атомунун ортосунда начар электростатикалык тартылуу башкача айтканда суутектик байланыш болот.

Суутектик байланыштар жашоо процессинин химиясында манил\\ роль ойнойт.
Металлдык байланыш
Металлдардын криссталдын торчолорундагы эркин электрондор менен металлдардын кичинекей оё иондорунун ортосунда пайда болгон байланыш металлдык байланыш деп аталат. Ал эми эркин электрондор менен иондор металлдардн сырткы электорндук катмарындагы электрорндордун (1,2,3) торчосунун арасына чыгып кетишинен пайда болгон.
Металдук байланыш коваленттик байланышка окшоп жалпы электрондорго ээ. Бирок андан айырмаланып мында электрондор бир жерге бир орбитага бекитилген эмес эркин болушат. Ошондуктан металлдар чоюлчаак, ийилчээк, серпилгич келишет.
Me+ e- Me+ e- Me+ e- Me+
Me+ e- Me+ e- Me+ e- Me+
Me+ e- Me+ e- Me+ e- Me+
Донордук - акцептордук байланыш
Донордук - акцептордук байланыш деп-бир атомдун бъл\нбъгън жупташкан электрондору менен экинчи атомдун бош атомдук орбиталдарынын ортосундагы химиялык байланышты айтабыз. Химиялык байланыш \ч\н бъл\нбъгън, жупташкан электорндорду берген атомду донор деп, ал эми бош атомдук орбиталы бар атомду акцептор деп айтабыз. М: NH3 +H+=NH4+
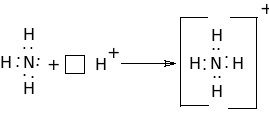
Кээде бул донордук-акцептордук байланыш коваленттик байланыштын ъзгъчъ механизм менен пайда болгон т\р\ катары карашат.
5





























