Просмотр содержимого документа
«Образование химической связи, за счет неспаренных электронов»

ХИМИЧЕСКАЯ СВЯЗЬ
Качественный и количественный состав
Химическая молекулярная формула
Ковалентная связь. Полярная и неполярная.
Валентность.

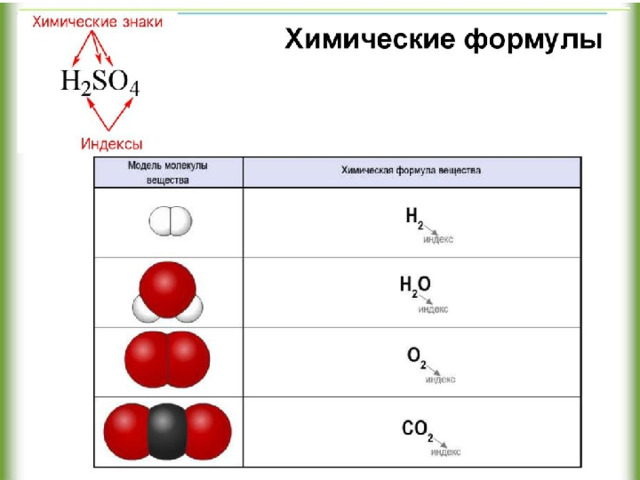

Состав любого вещества выражают химической формулой.
КАЧЕСТВЕННЫЙ СОСТАВ – показывает из атомов каких химических элементов состоит вещество.
КОЛИЧЕСТВЕННЫЙ СОСТАВ – число атомов каждого элемента в его составе.
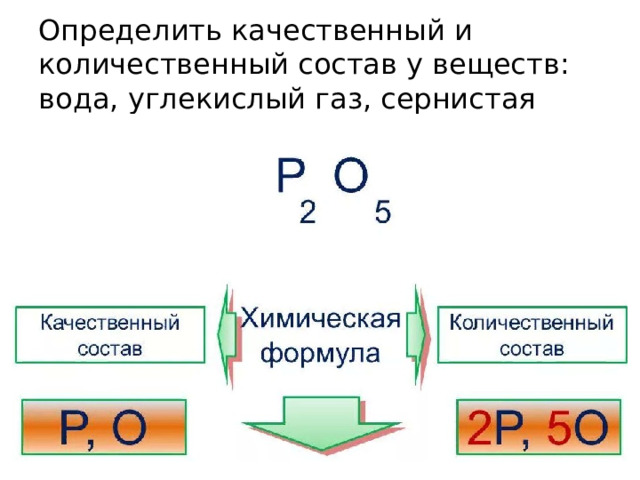
Определить качественный и количественный состав у веществ: вода, углекислый газ, сернистая кислота, графит.

Образование ковалентной связи
Ковалентная связь может образовываться между атомами одного химического элемента-неметалла или между атомами разных химических элементов-неметаллов.
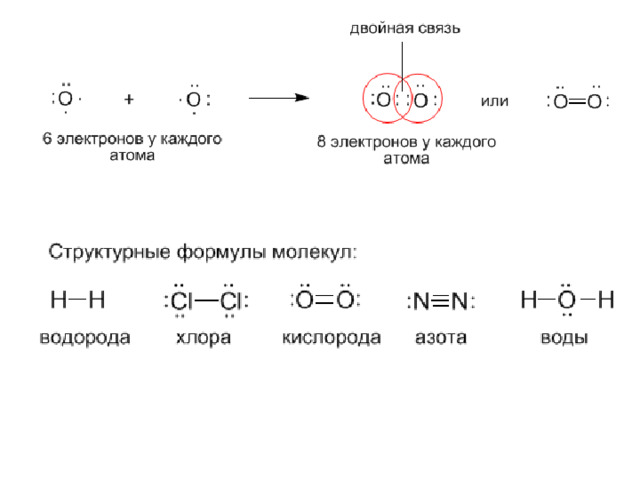

Атомы неметаллов объединяют свои неспаренные электроны и образуют общую электронную пару, то есть возникает ковалентная связь.
Т.к. ковалентная связь образуется между атомами различных элементов-неметаллов , то общая электронная пара будет принадлежать взаимодействующим атомам уже не в равной степени .
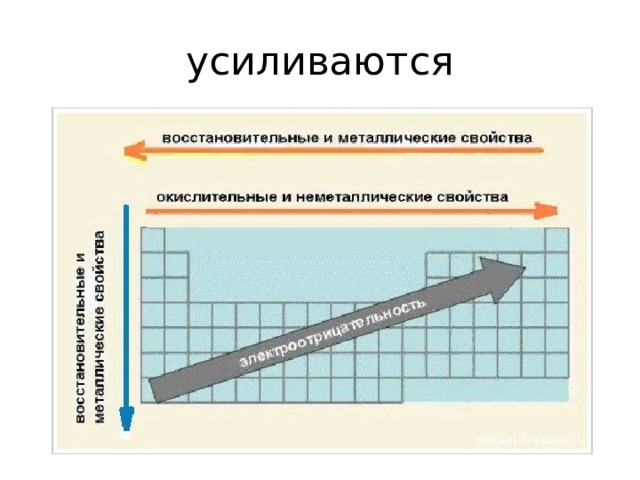
Для того, что бы определить к какому из атомов будет смещаться электронная пара в большей мере, используется понятие ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ. (ЭО).
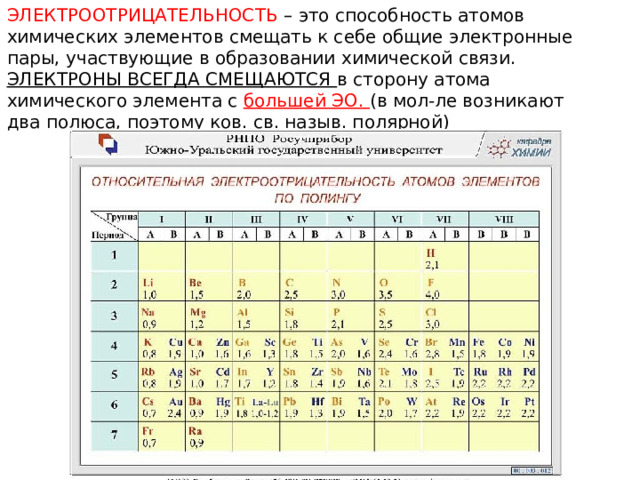
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ – это способность атомов химических элементов смещать к себе общие электронные пары, участвующие в образовании химической связи.
ЭЛЕКТРОНЫ ВСЕГДА СМЕЩАЮТСЯ в сторону атома химического элемента с большей ЭО. (в мол-ле возникают два полюса, поэтому ков. св. назыв. полярной)
усиливаются

Если молекула образована атомами одного химического элемента-неметалла, то общая электронная пара в равной степени принадлежит обоим атомам. Это неполярная ковалентная связь.
Если же молекула состоит из атомов различных химических элементов-неметаллов, то общая электронная пара обычно смещена в сторону атома, который обладает более сильными неметаллическими свойствами. Это полярная ковалентная связь.

Число ковалентных связей, которыми атом одного химического элемента связан с атомами этого же или других химических элементов, называют ВАЛЕНТНОСТЬЮ.
Валентные электроны - это электроны, которые могут принимать участие в образовании химической связи.


Валентные возможности атома определяются числом:
- Неспаренных валентных электронов
- Не поделённых электронных пар
- Вакантных (свободных) валентных орбиталей

Валентность не имеет заряда и пишется римскими цифрами сверху над химическим элементом.
В атомах элементов главных подгрупп валентными являются электроны внешнего энергетического уровня.
При этом валентные электроны завершенного энергетического уровня располагаются парно (спаренные электроны), и по одному – неспаренные электроны.
В образовании химической связи принимают участие не все валентные электроны, а только НЕСПАРЕНЫЕ .

Правила определения валентности элементов в соединениях:
- 1. Валентность водорода, фтора, металлы 1А группы принимают за I (единицу) ВСЕГДА.
- 2. Кислород, цинк, металлы 2А группы в своих соединениях проявляет валентность II ВСЕГДА.
- Алюминий, бор ВСЕГДА III валентность
- 3. Высшая валентность НЕМЕТАЛЛОВ равна номеру группы N группы (исключения O, F - для этих элементов характерна только низшая валентность).
- 4. Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 - N группы













































