МКОУ «Сиртичская СОШ»,
МР «Табасаранский район»
Открытый урок химии в 9 классе
по теме: «Гидролиз солей»
Разработал и провел урок - учитель биологии и химии
Шихбабаев Артур Шихбабаевич
Дидактическая цель: создание условий для усвоения знаний учащихся о процессе гидролиза солей, гидролизе органических веществ и их сущность.
Задачи урока:
Образовательные: Сформировать представление о процессе гидролиза солей, гидролизе органических веществ и их сущности.
Развивающие: Развивать: учебно-информационные навыки: умение извлекать информацию из устного сообщения, справочных таблиц, наблюдаемых процессов;
Воспитательные: Совершенствовать коммуникативные умения в ходе коллективного обсуждения, развивать умение формулировать и аргументировать собственное мнение, развивать самостоятельность.
Планируемые результаты
Предметные: знать и понимать: физическую и химическую теорию растворов; насыщенные и ненасыщенные растворы; типы концентрации растворов, понятие гидролиза.
Метапредметные: Уметь распознавать растворы кислот и щелочей практическим путём.
Личностные: Определение сущностных характеристик изучаемых реакций; самостоятельный выбор критериев для сравнения, сопоставления, оценки и классификации.
Средства обучения: Компьютер, мультимедийное сопровождение, оборудование и реактивы для демонстрационного эксперимента и эксперимента учащихся, справочная таблица «Растворимость оснований, кислот, солей в воде», видеоролик.
Методы обучения: Проблемно-поисковый, практический, объяснительно- иллюстративный
Способы мотивации учения: Связь темы с повседневной жизнью. Влияние гидролиза на процесс геологической, химической и биологической эволюции планеты. Межпредметные связи: география, биология.
Ход урока:
Этап 1. Организационный
Учащийся зачитывает стихотворение о воде, одновременно просматривается учащимся видеоролик. Учитель задаёт вопрос: почему было прочитано данное стихотворение?
Стихотворение (читает ученик полностью наизусть)
Безбрежная ширь океана,
И тихая заводь пруда
Струи водопада
И брызги фонтана
А в сущности только вода
Этап 2. Разминка.
Дайте определение следующим понятиям и ответьте на вопросы.
Электролиты, электролитическая диссоциация, кислоты, основания, соли,
Катион, анион, индикатор, водородный показатель, назовите формулы сильных оснований, назовите формулы слабых оснований, назовите формулы сильных кислот, назовите формулы слабых кислот.
- По какому признаку эти вещества классифицируют на сильные и слабые?
- Какие ионы образуются при диссоциации оснований?
- Какова среда раствора в данном случае?
- Какие ионы образуются при диссоциации кислот?
- Какова среда раствора?
Этап 3. Актуализация субъектного опыта
Создание проблемной ситуации.
Химический эксперимент
(работа проводиться в группах)
Перед вами три пробирки, в которых растворы кислоты, щелочи, дистиллированная вода, водопроводная вода. Подтвердим ваши ответы экспериментом. При работе не забывайте о правилах ТБ при обращении с химическими веществами.
Возьмите пробирку № 1 с раствором воды опустите в неё универсальную индикаторную бумагу.
Отметьте цвет индикаторной бумаги, сделайте вывод.
Возьмите пробирку № 2 с раствором кислоты опустите в неё универсальную индикаторную бумагу.
Отметьте цвет индикаторной бумаги, сделайте вывод.
Возьмите пробирку № 3 с раствором щёлочи опустите в неё универсальную индикаторную бумагу.
Отметьте цвет индикаторной бумаги, сделайте вывод.
Какова окраска универсальной индикаторной бумаги в пробирках?
Результаты реакций в 1-3 пробирках мы легко можем объяснить. А как объяснить слабощелочную реакцию среды в пробирке с водопроводной водой?
Вспомним, в чем различие дистиллированной воды и воды водопроводной. Значит, окраску лакмуса обуславливает наличие в воде растворенных солей.
Это явление – гидролиз солей в водных растворах, и ему мы посвятим сегодняшний урок.
Изменения цвета универсальной индикаторной бумаги в растворах
кислот и щелочей.
| Название | Окраска индикатора в среде |
|
| Кислая [H+] [OH-] рН | Нейтральная [H+] = [OH-] рН = 7 | Щелочная [OH-] [H+] рН 7 |
| Лакмус | красный | фиолетовый | синий |
| Фенолфталеин | бесцветный | бесцветный | малиновый |
| Метилоранж | розовый | оранжевый | желтый |
И так, запишите тему урока: гидролиз солей
Этап 4. Этап изучения новых знаний и способов деятельности
Рассмотрим название явления «гидролиз». Данный термин состоит из двух составных частей от греческого «гидро» – вода, «лизис» – разложение. Дословно, гидролиз – разложение водой. Думаю, к концу занятия нам удастся сформулировать полное определение понятия «гидролиз».
Лабораторная работа: «Определение среды растворов в солях»
Учащиеся работают в парах по инструктивной карточке. Учащиеся самостоятельно делают выводы и записывают реакции гидролиза солей.
В 3 пробирках находятся вещества: растворы AICI3, Na2CO3, NaCI. Учащиеся, используя универсальную индикаторную бумагу, исследуют растворы этих веществ. Как видите, в первой пробирке среда – кислая пробирке хлорид алюминия (РН меньше 7) во второй – карбонат натрия (РН больше 7) – щелочная, в четвёртой (РН = 7) – хлорид натрия нейтральная. Следовательно, можно сделать вывод, что
в первой пробирке присутствуют Н+, во второй пробирке ОН-, в третьей пробирке Н+ и ОН-. Попробуем разобраться, что же произошло.Вода, как вы знаете, является слабым электролитом и диссоциирует на положительные ионы водорода и гидроксид-ионы.
H
 2O H+ + OH-
2O H+ + OH-
Мы знаем, что соли – производные кислот и оснований.
Растворимая соль в воде диссоциирует на составляющие ее ионы.
Хлорид алюминия – соль, образованная слабым основанием и сильной кислотой, диссоциирует следующим образом

 Al(NO3)3 Al3+ + 3NO3-
Al(NO3)3 Al3+ + 3NO3-
О
 чевидно, что в растворе данной соли противоположно заряженные ионы объединятся. Al3+ + 3NO3- + H+ + OH- Al OH2- + H+ + 3NO3-
чевидно, что в растворе данной соли противоположно заряженные ионы объединятся. Al3+ + 3NO3- + H+ + OH- Al OH2- + H+ + 3NO3-
Катионы алюминия прочно связывают гидроксид-ионы, так как гидроксид алюминия слабое основание и не подвергается диссоциации.
Хлорид-ионы не могут быть связаны с катионами водорода, так как азотная кислота – сильная и диссоциирует полностью.
В результате – в растворе избыток катионов водорода, вследствие этого – среда раствора кислотная.
Al(NO3)3

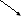
Al(OH)3 HNO3
слабое основание сильная кислота
[OH]- H]+
Кислотная среда
Для того, чтобы записать уравнение гидролиза, воспользуемся памяткой.
Определим состав соли:
Al(NO3)3
сл. осн с. к-та
2. Возьмем ион слабого электролита и напишем уравнение его взаимодействия с составными частями воды:
A
 l3+ + HOH AlOH2+ + H+
l3+ + HOH AlOH2+ + H+
3. На основании краткого ионного уравнения напишем молекулярное уравнение. Исходные вещества известны – соль и вода, продукты гидролиза составим, связывая образовавшиеся ионы с теми ионами соли, которые не участвуют в гидролизе:
A
 l(NO3)3 + H2O AlOH(NO3 )2 + HNO3
l(NO3)3 + H2O AlOH(NO3 )2 + HNO3
Одним из продуктов данной обменной реакции является основная соль.
Сформулируем вывод:
Раствор соли, образованной слабым основанием и сильной кислотой, имеет кислотную реакцию, так как в растворе избыток катионов водорода.
Карбонат натрия – соль, образованная сильным основанием и слабой кислотой, диссоциирует следующим образом
N
 a2CO3 2Na+ + CO32-
a2CO3 2Na+ + CO32-
Карбонат-ионы прочно связывают катионы водорода, так как угольная кислота слабая.
Катионы натрия не могут быть связаныгидроксид-ионами, так как гидроксид натрия – сильное основание и диссоциирует полностью.
2
 Na+ + CO32- + H+ +OH- HCO3-+ 2Na+ + OH-
Na+ + CO32- + H+ +OH- HCO3-+ 2Na+ + OH-
В результате в растворе избыток гидроксид-ионов, вследствие чего среда щелочная.
Na2CO3


NaOH H2CO3
сильное основание слабая кислота
[OH]- [H]+
Щелочная среда
В оспользовавшись памяткой, самостоятельно составьте молекулярное уравнение гидролиза карбоната натрия.
оспользовавшись памяткой, самостоятельно составьте молекулярное уравнение гидролиза карбоната натрия.
C O32- + H++OH- HCO3- + OH-
O32- + H++OH- HCO3- + OH-
N
 a2CO3 + H2O NaHCO3 + Na OH
a2CO3 + H2O NaHCO3 + Na OH
Одним из продуктов данной обменной реакции является кислая соль.
Сформулируем вывод:
Раствор соли, образованной сильным основанием и слабой кислотой, имеет щелочную реакцию, так как в растворе избыток гидроксид-ионов.
Хлорид натрия – соль, образованная сильным основанием и сильной кислотой.
N
 aCl Na+ + Cl-
aCl Na+ + Cl-
H
 2O H+ + OH-
2O H+ + OH-
Хлорид натрия гидролизу не подвергается, так как в составе соли нет иона, который мог бы при взаимодействии с водой образовывать слабый электролит.
NaCl


NaOH HCl
сильное основание сильная кислота
[OH]- ═ [H]+
Среда нейтральная

N
 aCl + H2O
aCl + H2O
Сформулируем вывод:
Раствор соли, образованной сильным основанием и сильной кислотой, имеет нейтральную реакцию, так как в растворе равное количество катионов водорода и гидроксид-ионов.
Этап 5. Первичная проверка понимания учащимися нового материала
Можно ли по составу соли сделать заключение о возможности ее гидролиза? Это возможно с помощью таблицы растворимости. Нерастворимые соли гидролизу практически не подвергаются. Если соль в воде растворима, то следует выяснить, входит ли в ее состав катион, отвечающий слабому основанию, или анион, отвечающий слабой кислоте.
Выполнение тестового задания. 1 вариант
Гидролиз солей – это:
А) обменная реакция соли с водой;
Б) растворение соли в воде;
В) диссоциация соли в воде.
2. Сущность гидролиза заключается:
А) в диссоциации молекул соли на ионы;
Б) в образовании слабодиссоциирующих веществ;
В) в образовании молекул сильных электролитов.
3. Раствор нитрата магния Mg(NO3)2 имеет
А) кислотную среду;
Б) щелочную среду;
В) нейтральную среду.
а) аминокислота б) глюкоза в) глицерин г) фосфорная кислота
4. В результате гидролиза жиров в организме человека образуются:
а) аминокислоты и жирные кислоты б) глицерин и жирные кислоты в) глицерин и глюкоза г) глюкоза
5. Гидролиз белка протекает:
а) в желудке
б) в кишечнике
в) в ротовой полости
г) в толстой кишке
Выполнение тестового задания. 2 вариант
Гидролиз солей – это:
А) растворение соли в воде;
Б) обменная реакция соли с водой;
В) диссоциация соли в воде.
2. Сущность гидролиза заключается:
А) в диссоциации молекул соли на ионы;
Б) в образовании молекул сильных электролитов;
В) в образовании слабодиссоциирующих веществ.
3. Раствор фосфата калия K3PO4 имеет
А) кислотную среду;
Б) щелочную среду;
В) нейтральную нейтральную среду.
4. В результате гидролиза белков в пищеварительном тракте человека образуется: а) аминокислота б) глюкоза в) глицерин г) фосфорная кислота
5. Хлорид натрия имеет среду раствора:
а) кислую б) щелочную в) слабокислую г) нейтральную
7. В ротовой полости гидролизу подвергается:
а) крахмал,
б) жир,
в) белок.
Этап 8. Рефлексия.
1. Ваше отношение к сегодняшнему уроку?
2. Чему новому Вы научились на уроке?
3. Какие ранее полученные знания Вы использовали на уроке?
Итоговая контрольная работа по теме:
«ЭЛЕКТРИЧЕСКАЯ ДИССОЦИАЦИЯ».
Вариант № 1
1.Допишите уравнения реакций, протекающих до конца. Составьте к ним полные и краткие ионные уравнения реакций.
а) ZnCl2 + Ba(OH)2 → б) AgNO3 + KCl→
в) H2SO4 + Ca(OH)2 → (6 баллов)
2. Приведите полные ионные и молекулярные уравнения реакций, соответствующие сокращенным ионным уравнениям:
а) ZnO + 2H+ = Zn2+ + H2O, б) ОН- + H+ = H2O,
в) Ag+ + Cl– = AgCl , (6 баллов)
, (6 баллов)
3.Осуществить превращения и определить тип реакций. (2 балла за уравнение). Zn → ZnO → ZnSО4→ВаSО4.
4 . Раствор хлорида железа (III) массой 200 г и массовой долей10% смешали с гидроксидом натрия. Вычислите массу образовавшегося осадка? (6 баллов)
Вариант № 2
1. Допишите уравнения реакций, протекающих до конца. Составьте к ним полные и краткие ионные уравнения реакций.
а) HNO3 + Ba(OH)2 → б) CuCl2 + Ca(OH)2 →
в) FeSO4 + NaOH → (6 баллов)
2. Приведите полные ионные и молекулярные уравнения реакций, соответствующие сокращенным ионным уравнениям:
Al3+ + 3OH- = Al(OH)3 OH- + H+ = H2O
CO32- + 2H+ = H2 О + CO2 (6 баллов)
3. Осуществить превращения и определить тип реакций. (2 балла)
С → СО2 → Nа2СО3 → СaСО3 (6 баллов)
4. Задача. Раствор хлорида меди (II), массой 160 г и массовой долей 20% смешали с гидроксидом натрия. Вычислите массу образовавшегося осадка? (6 баллов)
рекомендации
Учащиеся, в начале обучения химии, в силу своих возрастных и индивидуальных особенностей, имеют, выражено разные интенсивность и степени усвоения. Если в процессе обучения не соблюдать особенности учащихся, вид восприятия и развития, невозможно обеспечить оптимальные темп и уровень усвоения учебного материала.
Психологи утверждают, что 9 класс – пик эмоциональной неуравновешенности. Это может приводить к ухудшению дисциплины, особенно на последних уроках или после контрольных работ. Возрастает обидчивость, раздражительность. Даже незначительное замечание нередко приводит к бурной реакции.
В основу модернизации образования на первое место ставится постепенное изменение образовательного мировоззрения. Это долговременная задача, которая в первую очередь затрагивает педагогов, от которых общество давно отвернулось, и детей, у которых сложилось устойчивое мнение, если родители состоятельные, то беспокоиться ни о чём им не следует. Понадобятся педагоги, владеющие психолого-педагогическими знаниями и понимающие особенности развития школьников, являющиеся профессионалами во всех областях своей деятельности, способные помочь детям найти себя в будущем. Естественно, нужно значительно повысить социальный статус учителя и строго придерживаться правовых норм проведения ЕГЭ и ГИА.
Важнейшим требованием к подготовке и обеспечению введения ФГОС является постоянное научное и методическое сопровождение, включая консультирование всех участников данного процесса. При введении ФГОС должна быть организована широкая разъяснительная работа среди педагогической и родительской общественности о целях и задачах ФГОС, его актуальности для системы образования, для обучающихся и их семей. При этом образовательные учреждения должны стать основными площадками проведения работы с общественностью, в первую очередь с родителями, по разъяснению необходимости введения ФГОС, его требований, механизмов введения, ожидаемых результатов.







 2O H+ + OH-
2O H+ + OH- Al(NO3)3 Al3+ + 3NO3-
Al(NO3)3 Al3+ + 3NO3-
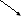

 l(NO3)3 + H2O AlOH(NO3 )2 + HNO3
l(NO3)3 + H2O AlOH(NO3 )2 + HNO3
 a2CO3 2Na+ + CO32-
a2CO3 2Na+ + CO32-


















