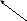МКОУ «Сиртичская СОШ»,
МО «Табасаранский район»
Открытый урок химии в 9 классе
по теме: «Азот и его свойства»
Разработал и провел урок - учитель биологии и химии
Шихбабаев Артур Шихбабаевич
Дидактическая цель: Создание условий для усвоения знаний учащихся о аммиаке и его свойствах.
Задачи:
Образовательные: Сформировать у учащихся знания о строении и составе молекулы аммиака, о физических и химических свойствах аммиака в связи со строением молекулы, об особенностях образования ковалентной связи в ионе аммония, о сущности процесса окисления аммиака.
Развивающие: Продолжить работу над формированием у учащихся умение находить взаимосвязь строения молекулы аммиака и его физических и химических свойств, умения рассматривать химические свойства с точки зрения ОВР.
Воспитательные: Формировать умение вести диалог, дискутировать, выслушивать друг друга.
Планируемые результаты
Предметные. Знать состав и строение молекулы, физические и химические свойства аммиака, получение и области применения.
. Метапредметные. Уметь описывать свойства и физиологическое действие аммиака на организм.
Личностные. Ответственное отношение к учению.
Оборудование:
прибор для наблюдения растворения NH3 в Н2О: круглодонная колба, наполненная NH3; штатив, простоквашница с Н2О, фенолфталеин.
прибор для демонстрации горения NH3: пробирка с газоотводной трубкой (с КМnО4), пробирка с аммиачной водой; две спиртовки, штатив для пробирок; демонстрационный штатив (2 шт.); лучинка, спички.
прибор для демонстрации каталитического окисления NH3: свежеприготовленный Сr2О3; ложечка для сжигания веществ; круглодонная колба с аммиачной водой (с пробкой); штатив, спиртовка, спички.
раствор NH3; лакмус, фенолфталеин, метилоранж, держалка для пробирок, демонстрационный штатив, спички, спиртовка.
к. НС1; 2 полоски фильтровальной бумаги.
Ход урока:
1. Опрос:
Три ученика работают на доске:
- нарисовать схему строения атомов N и P. В чем сходство и различие в электронном строении этих атомов, как изменяются окислительные свойства по п/гр;
- окислительные и восстановительные свойства азота на примере взаимодействия азота с водородом и кислородом. Сравнить условия протекания этих реакций, дать их характеристики;
- домашнее упражнение №3 (стр. 111):

 2NO + O2 2NO2 + Q
2NO + O2 2NO2 + Q
Реакция: гомогенная, обратимая, некаталитическая, экзотермическая, ОВР.
Смещение равновесия: а) добавлять исходные вещества, отводить продукт;
б) понижать температуру (+ Q) ; в) повышать давление (3V → 2V).
Устный опрос:
- какой тип связи в молекуле азота?
- в каком виде встречаются азот в природе?
- почему в природе больше свободного азота и меньше связанного?
- как получают азот в промышленности?
- какие степени окисления характерны для азота?
(-3; 0; +1; +2; +3; +4; +5)
низшая высшая
- какая степень окисления азота в аммиаке NH3? Чем может выступать NH3 в окислительно –восстановительных реакциях?
(с.о. -3. т.к. с.о. низшая, то азот может только отдавать ē более электроотрицательным неМе, т.е. будет проявлять восстановительные свойства)
2. Изучение нового материала.
Вопрос: почему азот называют элементом, без которого невозможна жизнь?
Ответ: азот входит в состав белков, которые являются строительным материалом всех живых организмов.
В атмосфере содержится 78% азота, но усваиваться живыми организмами может только химически связанный азот. Техническое решение проблемы «связывания» азота с водородом во многом решило проблему урожайности полей. Понять эту взаимосвязь химии азота и проблем урожая можно, изучив одно из ценных соединений азота – аммиака (нитрид Н).
а) Состав и строение молекулы аммиака
Вопрос: сколько ē затрачивает атом N на образование связей с атомами Н в молекуле аммиака?
Вопрос: какого характера связи в молекуле аммиака?


H+1 N-3 H+1

H+1
Молекула аммиака имеет пространственное строение, она представляет собой треугольную пирамиду (тетраэдр), валентный угол 1070, в результате чего молекула аммиака полярна.
 1070 . .
1070 . .


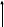 N -δ
N -δ
H+δ H+δ



H+δ
б) Физические свойства аммиака.
Вопрос: какие физические свойства следует ожидать у аммиака, исходя из его состава и строения?
Аммиак легко снижается, а при испарении жидкого аммиака происходит сильное охлаждение → его применяют в некоторых холодильных установках.
Демонстрационный эксперимент – растворение аммиака в воде.
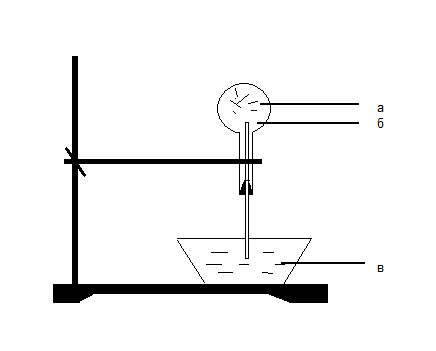
Круглодонную колбу наполнить NH3 (б), для этого 10-15 минут пропускать NH3 в колбу. Закрыть колбу пробкой с газоотводной трубкой, конец которой закрыть зажимом. Впустить воду – 1 каплю в (в) колбу → резкое растворение NH3 → фонтан малинового цвета (а), т.к. вода была с небольшим количеством фенолфталеина.
в) Химические свойства: Для аммиака характерны две группы химических свойств. Первая группа характеризует восстановительные свойства NH3 – это реакции окисления.Вторая группа обусловлена способностью аммиака образовывать ион аммония NH4+.
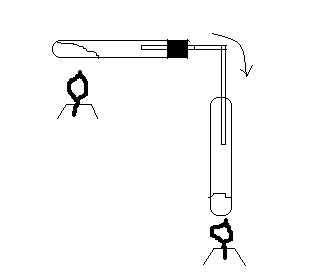
Окисление аммиака.
Данная реакция в зависимости от условий идет в разных направлениях. В отсутствии катализатора образуется молекулярный азот и водяной пар.

 KMnO4
KMnO4
O2

NH4OH
Нагреть KMnO4 , после начала выделения О2 нагреть NH4OH, поджечь у отверстия пробирки → горение голубым пламенем.
В оптимальных условиях удается получить выход NO до 98%. Т.е. применяя тот или иной катализатор можно изменять направление реакции. Поэтому говорят, что катализаторы обладают избирательным действием.
Катализаторы – вещества, увеличивающие скорость реакции или меняющие ее направление.
Демонстрационный опыт.
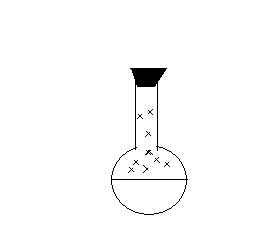
Сr2O3 В качестве катализатора свежеприготовленный Cr2O3 (разложение бихромата аммония (NH4)2 Сr2O7). Нагреть Сr2O3 в ложечке для сжигания веществ, постукивая пальцем по ложечке, всыпать его в колбу – «огненный дождь».
Конц. NH3·Н2О
Учащиеся рассматривают окислительно-восстановительную реакцию:
Химические реакции, связанные с образованием иона аммония.
В аммиаке у атома азота имеется неподелённая электронная пара, которая может участвовать в образовании еще одной ковалентной полярной связи между атомами N и катионом водорода (Н+) по донорно-акцепторному механизму:




H+1 +
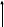
. . ↓



 H+1 N-3 H+1 + H+1 → О-2 ← H+1 → H+1 → N-3 ← H+1 + ОН-
H+1 N-3 H+1 + H+1 → О-2 ← H+1 → H+1 → N-3 ← H+1 + ОН-

↑

H+1


H+1 ион аммония щелочная среда раствора
Происходит химическое взаимодействие при растворении NH3 в Н2О – протон от воды перемещается к аммиаку вследствие «перетягивания» его азотом, у которого большая, чем у кислорода, отрицательная с.о. Азот – донор ē пары (от латинского donare – дарить); H+ - акцептор ē пары (acceptor – приемщик).
 ..
..

 NH3 + Н2+ О NH3·H2O гидроксид аммония, нашатырный спирт.
NH3 + Н2+ О NH3·H2O гидроксид аммония, нашатырный спирт.
Демонстрационный опыт:
В пробирке нагреть аммиачную воду, к которой предварительно добавить фенолфталеин. Наблюдается исчезновение малиновой окраски, т.к. аммиак улетучивается, а в пробирке остается вода. При нагревании равновесие смещается влево, т.к. с повышением t0 растворимость газов понижается.

 NH3 + Н2О NH3·H2O
NH3 + Н2О NH3·H2O
Рефлексия урока:
Узнали ли вы что-то новое для себя?
Что оказалось трудным, что лёгким?
Домашнее задание: §25;
рекомендации
Учитель химии теперь уже не просто источник информации, и обучить - не главная его цель. Он должен стать для школьника проводником в мир знаний, опорой в становлении личности. Он в своей деятельности не может ограничиваться только лишь стремлением выдать набор законов и формул, научить решать задачи, составлять уравнения химических реакций. Необходимо создать такие условия, чтобы у школьников возникла мотивация к изучению химии, чтобы они сами захотели узнавать новое. Для этого нужно, прежде всего, вызвать интерес к изучаемому материалу.
Сухое изложение теории, непонятные знаки и символы вызывают неприятие даже у взрослого человека. Подростки же в силу своих физиологических особенностей не способны подолгу концентрировать внимание на одном объекте, быстро утомляются и теряют интерес к предмету.
С этой целью учителю приходится обращаться к различным образовательно-педагогическим технологиям, апробированным школьной практикой и приводящим к положительным результатам. мы предлагаем в качестве «универсального» использовать эвристический метод, который дает возможность каждому ученику получить, открыть или сконструировать собственное знание об объекте и при этом неизбежно проявляет и развивает свои собственные возможности;







 2NO + O2 2NO2 + Q
2NO + O2 2NO2 + Q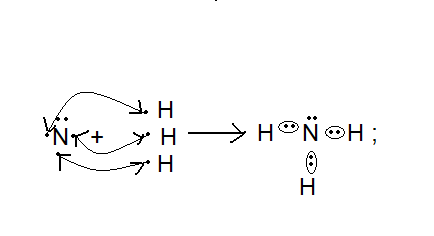



 1070 . .
1070 . .

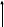 N -δ
N -δ




 KMnO4
KMnO4