Вывод формул веществ
| При взаимодействии щелочноземельного металла массой 3,425 г с водой выделился водород объемом 560 мл (н.у.) Определите, какой металл взят для реакции. |
Решение:
1. Щелочно-земельный металл двухвалентный, поэтому можно составить уравнение химической реакции: Ме + 2Н2О = Ме(ОН)2 + Н2
2.Находим количество вещества выделившегося водорода v(H2) = 0,56 / 22,4 = 0,025 моль
3.По ур-ю реакции v(Me) = v(H2) = 0,025 моль
4. Находим молдярную массу металла: v= m / M; M = m/v
M(Me) = 3,425 / 0,025 = 137 г/ моль, следовательно для реакции был взят барий.
Задачи для самостоятельного решения
При сгорании порошка металла массой 13.5г образовалось 25,5г оксида, в котором металл трехвалентен. Определите, порошок какого металла сожгли. (Мr (Al)=27)
При сгорании порошка металла массой 26г образовалось 32,4г оксида, в котором металл двухвалентен. Определите, порошок какого металла сожгли. (Мr (Zn)=65)
При сгорании порошка вещества массой 159г образовалось 230г оксида, в котором элемент пятивалентен. Определите, порошок какого вещества сожгли. (Мr (As)=75)
При сгорании в хлоре 12.8г порошка некоторого металла образовалось 27г хлорида, в котором металл двухвалентен. Порошок какого металла сожгли? (Мr (Сu)=64)
При сгорании в хлоре 224г порошка некоторого металла образовалось 650г хлорида, в котором данный металл трехвалентен. Порошок какого металла сожгли? (Мr (Fe)=56)
Для полного сгорания 14г некоторого простого вещества потребовалось 11,2л (н.у.) кислорода. В полученном оксиде элемент, элемент который образовал исходное вещество четырехвалентен. Какое простое вещество сожгли? (Мr (Si)=28)
При взаимодействии 3.92г сульфата трехвалентного металла с хлоридом бария образовалось 6.99г осадка. Установите формулу исходного сульфата. (Cr2(SO4)3)
Из 3.92г сульфата некоторого трехвалентного металла можно получить 3.17г его хлорида. Установите формулу исходного сульфата. (Cr2(SO4)3)
На нейтрализацию 1г гидроксида некоторого двухвалентного металла идет 20.6г 55-ного раствора азотной кислоты. Установите формулу гидроксида. (Sr(OH)2)
Сожгли 54.8г неизвестного двухвалентного металла в избытке кислорода. Получили оксид металла, который полностью растворили в избытке соляной кислоты. При взаимодействии полученного раствора с избытком раствора сульфата калия образуется 93.2г белого осадка. Определите исходный металл.
Задачи на смеси с участием только одного реагента
| Смесь карбоната и сульфата бария массой 10 г обработали раствором азотной кислоты, при этом выделилось 0,448 л газа (н.у.). Определить массовую долю сульфата бария в смеси. |
![]() Решение
Решение
Дано:
m(смеси) = 10 г
V(газа) = 0,448 л
w(ВаSO4) - ?
![]() 1. Учитывая, что из двух компонентов смеси с азотной кислотой реагирует только карбонат бария, запишем уравнение реакции.
1. Учитывая, что из двух компонентов смеси с азотной кислотой реагирует только карбонат бария, запишем уравнение реакции.
х г 0,448 л
BaCO3 + 2 HNO3 = Ba(NO3)2 + CO2 + H2O
10 г
1 моль 1 моль
197 г/моль 22,4 л/моль

 ВаSO4 + HNO3
ВаSO4 + HNO3
2. Рассчитаем количество вещества оксида углерода (IV):
V(СО2) 0,448 л
(СО2) = = = 0,02 моль
Vm 22,4 л/моль
3. Найдем количество вещества карбоната бария:
m(BaCO3) = (BaCO3) M(BaCO3) = 0,02 моль 197 г/моль = 3,94 г
4. Вычислим массу сульфата бария в смеси:
m(BaSO4) = m(смеси) m(BaCO3) = 10 г – 3,94 г = 6,06 г
5. Определим массовую долью сульфата бария в смеси:
m(BaSO4) 6,06 г
w(BaSO4) = 100% = 100% = 60,6%
m(смеси) 10 г
Ответ: 60,6%
Задачи для самостоятельного решения
Смесь оксида и сульфида цинка массой 114,9 г обработали избытком соляной кислоты. При этом выделилось 13,44 л (н.у.) газа. Определите массовую долю оксида цинка в смеси. Ответ: w(ZnO) = 49,3%
При действии соляной кислоты на 6,5г смеси цинка с оксидом цинка выделилось некоторое количество газа, при горении которого образовалось 0,9г воды. Какова массовая доля цинка в исходной смеси? Ответ: w(Zn) = 50%.
Смесь оксида меди (II) и оксида железа (III) массой 191г была полностью восстановлена до соответствующих металлов, при действии на которые избытка соляной кислоты выделилось 8,96 л (н.у.) водорода. Определите массовую долю оксидов в исходной смеси.
Задачи на смеси с участием параллельных реакций.
| При обжиге образца минерала массой 26,8г, представляющего собой смесь сульфидов железа (II) и меди (II), выделилось 6.72л оксида серы (IV). Рассчитайте массовые доли сульфидов в минерале. |
Решение:
1.Запишем уравнения реакций:
х
4FeS +7O2 = 2Fe2O3 + 4SO2 (1)
у
2CuS + 3O2 = 2CuO +2SO2 (2)
2.Пусть количество вещества (SO2) в первой реакции будет х, тогда количество вещества (SO2) во второй реакции будет у, так как общий объем выделившегося (SO2) = 6,72л, найдем общее количество вещества (SO2) образовавшееся в ходе двух реакций:
v(SO2)=V(SO2)/Vm = 6.72л/22.4л/моль= 0.3 моль
х+у =0,3 –первое уравнение в системе
3.По уравнению реакций:
V(FeS)=v(SO2) =x моль, а V(СuS)=v(SO2) =у моль,
тогда m(FeS)=88x, а m(СuS)96у, так как общая масса минералов известна, получаем второе уравнение в системе алгебраических уравнений:
88х+96у=26,8
4. Решив систему уравнений, получаем:
х(FeS)=0,25 моль, m (FeS)=22г, w(FeS)=82,1%
х(CuS)=0,05 моль, m (CuS)=4,8г, w(CuS)17,9%
Первый уровень.
Вычислите массовые доли серы и угля в смеси, если известно, что для сжигания 27г такой смеси потребуется 22,4 л кислорода (н.у.) (88,9% и 11.1%)
Вычислите массовые доли цинка и магния в смеси, если известно, что для сжигания 68,5г такой смеси потребуется 32 г кислорода (47.4% и 52.6%)
Вычислите массовые доли алюминия и магния в смеси, если известно, что для сжигания 78г такой смеси потребуется 44,8 л кислорода (н.у.)(69.2% и 30.8%)
При окислении 80г смеси порошков магния и меди образовалось 120г смеси оксидов данных металлов. Рассчитайте массовые доли оксидов в данной смеси.(60% и 40%)
В результате сгорания 126г смеси порошков алюминия и магния образовалось 222г смеси оксидов этих металлов. Рассчитайте массовые доли оксидов в данной смеси.(42,9% и 57,1%)
Повышенный уровень
В раствор, содержащий 15,9г смеси сульфатов калия и магния, прилили избыток хлорида бария, в результате чего образовалось 25,63г сульфата бария. Определите массовую долю в исходной смеси.
Смесь карбонатов кальция и магния массой 10г обработали соляной кислотой. При этом выделилось 2,54л газа (н.у.) Определите массовую долю компонентов смеси.
При обработке 3.8г смеси карбоната и гидрокарбоната натрия соляной кислотой образовалось 896 мл газа. Какой объем соляной кислоты (массовая доля 20%, плотность 1,1г/ см3)был израсходован и каков состав исходной смеси в процентах.
200г раствора, содержащего 18.8г смеси сульфидов натрия и калия, обработали избытком раствора нитрата свинца, при этом выделилось 47,8г черного осадка. Вычислите массовые доли веществ в исходной смеси.
При избытке смеси гидрокарбонатов калия и карбоната кальция избытком соляной кислоты выделилось 12л углекислого газа. Вычислите массовые доли веществ в исходной смеси.
При нейтрализации смеси 2.24г азотной и серной кислот потребовалось 16г 10%-ного раствора гидроксида натрия. Вычислите состав исходной смеси. Ответ: m(HNO3) =1.26 и m (H2SO4)=0.98
1.19г сплава алюминия с цинком растворили в 40мл 25.4%-ной серной кислоты с плотностью 1,185г/ мл. В результате реакции выделилось 896мл водорода (при н.у.). Вычислите массовые доли алюминия и цинка в сплаве. Ответ: w(Al)=45.4%, w(Zn)=54.6%
На 20г смеси карбоната и сульфата бария подействовали раствором соляной кислоты. Требуется определить массовую долю сульфата бария в исходной смеси, если образуется средняя соль и выделяется газ, на поглощение которого было затрачено 400г 0,5-ного (по массе) раствора гидроксида натрия.
Смеси газов. Объемная доля газов в смеси.
| Смесь газов метана и этана массой 200г занимает при нормальных условиях объем 201,6л. Вычислите объемные доли газов в смеси и массовые доли газов в смеси. |
Решение:
Пусть количество вещества метана в смеси будет х моль, а количество вещества этана у моль, тогда
m(CH4)=16x, а m(C2H6) =30у, зная общую массу газовой смеси составляем 1 уравнение в алгебраической системе:
16х+30у=200
Так как молярный объем всех газов одинаков, можно найти суммарное количество вещество газов в смеси:
vобщ. =201,6/ 22,4 л/моль= 9 моль
Составляем второе уравнение в системе:
х+у = 9
Решая систему уравнений получаем v (CH4)=5 моль, v( C2H6)= 4 моль.
Объемные доли в смеси будут соответствовать молярным долям из следствия закона Авогадро (объемы газообразных веществ относятся к друг другу как простые целые числа)
ф (CH4)=5/9 = 0,59, v( C2H6)= 4/9 =0,44
Находим массовую долю газов в смеси:
w = m в-ва /w смеси * 100%, для этого найдем сначала массы газов:
m(CH4)=5*16 = 80г, m ( C2H6)= 4*30=120г
w (CH4)=80/200 =40%,m ( C2H6)= 120/200 =60%
Задачи для самостоятельного решения
Смесь азота и водорода массой 3.4г при нормальных условиях занимает объем 8.96л. Определите объемные доли газов в смеси и массовые доли газов в смеси.(25% и 75%; 82% и 18%)
Смесь водорода и аммиака массой 54г занимает объем при нормальных условиях 268.8л. Определите объемные доли газов в смеси и массовые доли газов в смеси. (37.04% и 62.96%; 83.33% и 16.67%)
Вычислите массовые доли водорода и гелия в смеси, содержащей 20% (по объему) водорода и 80% гелия. (11.1% и 8.9%)
Вычислите массовые доли кислорода и углекислого газа в смеси, содержащей 30% (по объему) кислорода. (23.8% и 76.2%)
Задачи на растворы с образованием кислых и средних солей.
Существует разновидность задач на избыток одного из реагирующих веществ, в которых состав продуктов реакции зависит от соотношения реагентов. Например, при растворении оксида фосфора (V) в растворе щелочи могут образоваться кислые или средняя соли. При мольном соотношении оксид: гидроксид калия 1:2 продуктом реакции будет дигидрофосфат калия, при соотношении 1:4 – гидрофосфат калия, при соотношении 1:6 – фосфат калия.
Р2О5 + 2 КОН + Н2О = 2 КН2РО4
Р2О5 + 4 КОН = 2 К2НРО4 + Н2О
Р2О5 + 6 КОН = 2 К3РО4 + 3 Н2О
Отличительным признаком задач такого типа служит «подсказка» в условии задачи. Обычно там есть фраза «какая соль получится», «какое вещество образуется» и т.п.
Особенность решения подобных задач заключается в том, что следует написать уравнения всех возможных реакций, определить соотношение реагентов и выбрать, по какому именно пути пойдет процесс.
| Через 210 г раствора с массовой долей гидроксида калия 24% пропустили 26,88 л (н.у.) углекислого газа. Какая соль образовалась в растворе и какова ее масса? |
![]() Решение
Решение
Дано:
m(р-ра) = 210 г
w(КОН) = 24%
V(CO2) = 26,88 л
m(соли) - ?
1. Запишем уравнения реакций, которые могут протекать в растворе:
1) KOH + CO2 = KHCO3
![]() 2) 2 KOH + CO2 = K2CO3 + H2O.
2) 2 KOH + CO2 = K2CO3 + H2O.
Очевидно, что реакция 1) протекает в том случае, если ν(CO2) ≥ ν(KOH), а реакция 2) в том случае, если ν(KOH) ≥ 2ν(CO2).
2. Вычислим количества вещества углекислого газа и гидроксида калия.

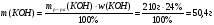 ;
;

Сравнивая количества вещества CO2 и гидроксида калия, видим, что 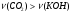 , следовательно, выполняется первая реакция и образуется кислая соль. Следовательно, дальнейшие расчеты проводим по уравнению (1):
, следовательно, выполняется первая реакция и образуется кислая соль. Следовательно, дальнейшие расчеты проводим по уравнению (1):
0,9 моль х г
KOH + CO2 = KHCO3
1 моль 1 моль 1 моль
100 г/моль
Так как 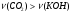 , гидроксид калия взят в недостатке, и расчет количества вещества соли будем вести по (KOH):
, гидроксид калия взят в недостатке, и расчет количества вещества соли будем вести по (KOH):
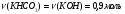 .
.
5.Найдем массу образовавшейся соли:
 .
.
Ответ: m(КНСО3) = 90 г
Задачи для самостоятельного решения.
К 200г раствора ортофосфорной кислоты с массовой долей 9,8% прилили 430,8 мл 5%-ного по массе раствора гидроксида калия плотностью 1,04 г/см3. Определите массовый процент соли в полученном растворе.
327,8 мл 20%-ного по массе раствора гидроксида натрия с плотностью 1,22г/см3 насытили 11.2 л оксида углерода. Определите массовые доли веществ в полученном растворе.
При полном сгорании 13.6г вещества получили 28.4г оксида фосфора (V)и 10.8г воды. К продуктам реакции добавили 74мл 32%-ного по массе раствора гидроксида натрия, имеющего плотность 1,351 г/ см3. О каком веществе идет речь в условии задачи? Какая соль образуется в результате этого процесса и чему равна ее массовая доля?









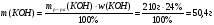 ;
;
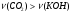 , следовательно, выполняется первая реакция и образуется кислая соль. Следовательно, дальнейшие расчеты проводим по уравнению (1):
, следовательно, выполняется первая реакция и образуется кислая соль. Следовательно, дальнейшие расчеты проводим по уравнению (1):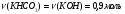 .
. .
.
















