МИНИСТЕРСТВО ОБРАЗОВАНИЯ, НАУКИ
И МОЛОДЕЖНОЙ ПОЛИТИКИ
ЗАБАЙКАЛЬСКОГО КРАЯ
ГПОУ «Читинский политехнический колледж»
Красночикойский филиал
ОУДб. 06 Химия
Методические указания
по выполнению практических работ
для студентов
профессии
21.01.08 Машинист на открытых горных работах
2019
|
Рассмотрено на заседании МЦК профессионального цикла гуманитарного профиля Красночикойского филиала ГПОУ «Читинский политехнический колледж»
|
|
Автор: Тароева М.Н.– преподаватель Красночикойского филиала ГПОУ «Читинский политехнический колледж»
Методические указания предназначены для студентов профессии среднего профессионального образования 21.01.08 Машинист на открытых горных породах. Содержат задания согласно рабочей программе ОУДб.06 Химия.
Введение
В данных методических указаниях описаны методики выполнения лабораторных работ по общей и органической химии, дано краткое теоретическое введение к каждой теме, которое при самостоятельной подготовке поможет студентам выполнить эти работы. В приложении к указаниям приведены справочные таблицы, правила техники безопасности и мероприятия по оказанию первой помощи.
В данных методических указаниях предусмотрено 32 часа на проведение практических и лабораторных занятий согласно рабочей программе по дисциплине.
Указания помогут студентам совершенствовать практические умения и закрепить теоретические знания по дисциплине «Химия».
При выполнении заданий на практических занятиях студенты должны:
Знать:
важнейшие химические понятия;
классификацию и номенклатуру органических и неорганических веществ;
вещества и материалы, используемые в практике;
основные приемы работы с оборудованием;
правила техники безопасности;
химическую посуду и оборудование.
Уметь:
называть вещества по «тривиальной» и международной номенклатуре»;
определять валентность и степень окисления элементов, пространственное строение молекул, окислитель и восстановитель, изомеры и гомологи, принадлежность веществ к различным классам соединений;
выполнять химический эксперимент по распознаванию важнейших неорганических и органических веществ; получению конкретных веществ;
пользоваться химическим оборудованием.
Владеть навыками:
обращения с посудой, лабораторными принадлежностями; с веществами;
сборки приборов из готовых деталей и испытания их на герметичность;
проведения химических операций;
распознавания изученных веществ по физическим свойствам и характерным реакциям;
получения веществ;
организации самостоятельной работы.
К практическим занятиям допускаются студенты, прошедшие инструктаж по технике безопасности.
Инструкция по технике безопасности при выполнении заданий на практических занятиях
1.Общие требования безопасности
Работа в химической лаборатории связана с некоторой опасностью, поскольку многие вещества в той или иной степени ядовиты, огнеопасны и взрывоопасны.
Характер предупредительных мер, обеспечивающих безопасность проведения эксперимента, зависит от вида работы. Однако существуют общие правила, выполнение которых обязательно для каждого работающего в лаборатории, независимо от того, какой эксперимент он проводит.
Работать одному в лаборатории категорически запрещается.
Во время работы в лаборатории необходимо соблюдать чистоту, тишину, порядок и правила техники безопасности.
Каждый работающий должен знать, где находятся в лаборатории средства противопожарной защиты и аптечка.
Категорически запрещается в лаборатории курить, принимать пищу, пить воду.
Нельзя приступать к работе, не усвоив всей техники ее выполнения.
Опыты нужно проводить только в чистой химической посуде. После окончания эксперимента посуду сразу же следует помыть.
В процессе работы необходимо соблюдать чистоту и аккуратность, следить, чтобы вещества не попадали на кожу лица и рук.
Вещества в лаборатории нельзя пробовать на вкус. Нюхать вещества можно, лишь осторожно направляя на себя пары или газы легким движением руки, а не наклоняясь к сосуду и не вдыхая полной грудью.
На любой посуде, где хранятся реактивы, должны быть этикетки с указанием названия веществ.
Сосуды с веществами или растворами необходимо брать одной рукой за горлышко, а другой снизу поддерживать за дно.
Категорически запрещается затягивать ртом в пипетки органические вещества и их растворы.
Во время нагревания жидких и твердых веществ в пробирках и колбах нельзя направлять отверстия на себя и соседей. Нельзя заглядывать сверху в открыто нагреваемые сосуды.
После окончания работы необходимо выключить воду и электричество.
Категорически запрещается выливать в раковину концентрированные растворы кислот и щелочей, а также различные органические растворители, сильно пахнущие и огнеопасные вещества. Все отходы необходимо сливать в специальные бутыли.
В каждой лаборатории обязательно должны быть защитные маски и очки.
В каждом помещении лаборатории необходимо иметь средства противопожарной защиты: ящик с просеянным песком и совком для него, противопожарное одеяло, заряженные огнетушители.
17. При работе в лаборатории необходимо применять индивидуальные средства защиты, а также соблюдать средства личной гигиены.
2. Требования безопасности перед началом работы
1. Проверить исправность и работу вентиляции вытяжного шкафа.
2. Тщательно проветрить помещение кабинета и лаборантской.
3. Надеть спецодежду. При работе с токсичными и агрессивными веществами подготовить к использованию средства индивидуальной защиты.
4. Подготовить к работе необходимое оборудование, лабораторную посуду, реактивы, приборы.
3. Требования безопасности во время работы
1. Во время работы в кабинете химии необходимо соблюдать чистоту, тишину и порядок на рабочем месте.
2. Запрещается пробовать на вкус любые вещества. Нюхать вещества можно, лишь осторожно направляя на себя пары или газы легким движением руки, а не наклоняясь к сосуду и не вдыхая полной грудью.
3. В процессе работы необходимо следить, чтобы вещества не попадали на кожу лица и рук.
4.Опыты нужно проводить только в чистой посуде.
5. На любой посуде, где хранятся реактивы, должны быть этикетки с указанием названия веществ. Запрещается хранить реактивы в емкостях без этикеток или с надписями, сделанными карандашом по стеклу, растворы щелочей – в склянках с притертыми пробками, а легковоспламеняющиеся и горючие жидкости – в сосудах из полимерных материалов.
6. Сосуды с веществами или растворами необходимо брать одной рукой за горлышко, а другой снизу поддерживать за дно.
7. Растворы необходимо наливать из сосудов так, чтобы при наклоне этикетка оказывалась сверху. Каплю, оставшуюся на горлышке сосуда, снимают верхним краем той посуды, куда наливается жидкость.
8. При пользовании пипеткой категорически запрещается втягивать жидкость ртом.
9. Твердые сыпучие реактивы разрешается брать из склянок только с помощью совочков, ложечек, шпателей, пробирок.
10. Во время нагревания жидких и твердых веществ в пробирках и колбах нельзя направлять отверстия на себя и соседей. Нельзя заглядывать сверху в открыто нагреваемые сосуды.
11. Категорически запрещается выливать в раковину концентрированные растворы кислот и щелочей, а также различные органические растворители, сильно пахнущие и огнеопасные вещества. Все отходы необходимо сливать в специальную стеклянную тару емкостью не менее 3 л с крышкой (для последующего обезвреживания).
12. Запрещается использовать в работе самодельные приборы и нагревательные приборы с открытой спиралью.
13. Не допускается совместное хранение реактивов, отличающихся по химической природе.
4. Требования безопасности после окончания работы
1. Привести в порядок рабочее место, убрать все химические реактивы на свои места в лаборантскую в специальные шкафы и сейфы.
2. Отработанные растворы реактивов слить в специальную стеклянную тару с крышкой, емкостью не менее 3 л.
3. Выключить вентиляцию вытяжного шкафа.
4. Снять спецодежду и средства индивидуальной защиты.
5. Тщательно вымыть руки с мылом.
6. Тщательно проветрить помещение кабинета химии и лаборантской.
5. Студентам запрещается:
- прикасаться к нагретым элементам оборудования, электрическим разъемам и открытому пламени;
- пробовать на вкус любые вещества;
- при использовании пипетки засасывать жидкость ртом;
- запрещается направлять острые концы колющих и режущих предметов на себя и других лиц;
- зажигать спиртовки одну от другой и задувать их пламя;
- оставлять без присмотра химические реактивы, включенное оборудование, приспособления, вычислительную и оргтехнику, ТСО;
- выполнять любые действия без разрешения учителя (иного лица, проводящего занятия) или лаборанта.
Обо всех неполадках в работе оборудования необходимо ставить в известность учителя (иное лицо, проводящее занятия) или лаборанта. Запрещается самостоятельное устранение любых неисправностей используемого оборудования.
6. Требования безопасности в аварийных ситуациях.
1. В случаях с разбитой лабораторной посудой, не собирать ее осколки незащищенными руками, а использовать для этого щетку и совок.
Уборку разлитых и рассыпанных реактивов производить, руководствуясь
требованиями инструкции по безопасной работе с соответствующими химическими реактивами.
В случае с разлитой легковоспламеняющейся жидкостью и ее загоранием, немедленно сообщить в ближайшую пожарную часть и приступить к тушению очага возгорания первичными средствами пожаротушения.
При получении травмы немедленно оказать первую помощь пострадавшему, сообщить об этом администрации техникума, при необходимости отправить пострадавшего в ближайшее лечебное учреждение.
7. Оказание первой помощи.
При попадании на кожу кислот и щелочей пораженные места немедленно промыть водой. При тепловых ожогах кожи пораженные участки промыть 3% раствором перманганата калия и наложить повязку с мазью от ожогов. При порезе стеклом следует промыть места пореза водой, смазать рану 5% раствором йода и наложить повязку. Аптечка с необходимыми средствами находится в лаборатории.
1. Перечень практических работ по дисциплине ОУДб.06. Химия
Раздел 1. Общая и неорганическая химия – 8 часов.
Тема 1.2. Периодический закон и периодическая система химических элементов Д.И. Менделеева и строение атома - 1 час
Практическая работа №1
Моделирование построения периодической таблицы химических элементов.- 1 час
Тема 1.3. Строение вещества – 1 час
Лабораторный опыт №2
Приготовление суспензии карбоната кальция в воде. Ознакомление со свойствами дисперсных систем – 1 час
Тема 1.4. Вода. Растворы. Электролитическая диссоциация- 1 час
Лабораторный опыт №3
Приготовление раствора заданной концентрации – 1 час
Тема 1.5. Классификация неорганических соединений и их свойства- 2часа.
Практическая работа №4
Испытание растворов кислот индикаторами. Взаимодействие металлов с кислотами. Взаимодействие кислот с оксидами металлов. Взаимодействие кислот с основаниями. Взаимодействие кислот с солями. – 2 часа
Тема 1.6. Химические реакции – 1 час
Практическая работа №5
Определение ОВР, выявление окислителя и восстановителя в уравнениях реакций- 1 час
Тема 1.7. Металлы и неметаллы – 2 часа
Практическая работа №6
Ознакомление со структурами серого и белого чугуна. Распознавание руд железа – 2 час
Раздел 2. Органическая химия – 4 часа
Тема 2.2. Углеводороды и их природные источники – 1 час
Практическая работа №7
Ознакомление с коллекцией образцов нефти и продуктов ее переработки. Ознакомление с коллекцией каучуков и образцами изделий из резины - 1 час.
Тема 2.3. Кислородсодержащие органические соединения – 1 час.
Лабораторный опыт № 8
Взаимодействие глюкозы и сахарозы с гидроксидом меди (II). Качественная реакция на крахмал - 1 час.
Тема 2.4. Азотсодержащие органические соединения. Полимеры – 2 час.
Лабораторный опыт № 9
Растворение белков в воде. Обнаружение белков в молоке и в мясном бульоне. Денатурация раствора белка куриного яйца спиртом – 2 часа.
Методические указания по выполнению практических работ
Практические работы с использованием инструкций обучающиеся выполняют индивидуально. В этом случае каждый обучающийся будет приобретать необходимые практические умения.
Отчет по выполнению практической работы оформляется каждым обучающимся индивидуально.
От предыдущей практической работы отступают 3-4 клетки и записывают дату выполнения работы и далее посередине следующей строки номер практической работы. Далее, каждый раз с новой строки записывают тему, цель, оборудование и реактивы. После строки «Ход работы» коротко поэтапно приводится описание практической работы (в соответствии с инструкцией по выполнению практической работы).
В отчете по выполнению практической работы приводятся описания эксперимента, наблюдения, уравнения химических реакций, условия проведения реакций, рисунки, ответы на вопросы, выводы.
Важным является умение приводить записи уравнений химических реакций, подтверждающих ход химического эксперимента. При этом необходимо приводить химические формулы и названия всех реагентов и продуктов реакции, упоминание о которых ведется при выполнении практической работы.
Если в ходе выполнения практической работы необходимо ответить на вопросы для выяснения понимания учащимися сущности опыта, то записывается ответ, если требуется оформить рисунок, заполнить таблицу, то соответственно выполняется рисунок или заполняется таблица.
Таблицы заполняются четко и аккуратно, при этом таблица должна занимать всю ширину тетрадной страницы.
Все рисунки должны иметь обозначения составных частей, оборудования, названия реагентов и продуктов реакции. Рисунки должны располагаться на левой стороне тетрадного листа, подписи к рисункам – (с правой стороны или снизу). Рисунки с изображением моделей приборов, схем выполнения химического эксперимента должны быть крупными и четкими, выполненными простым карандашом (допускается использование цветных карандашей), содержать только главные, наиболее характерные особенности.
В конце каждой практической работы обязательно записывается вывод по итогам выполненной работы (вывод формулируется исходя из цели практической работы).
ЛАБОРАТОРНАЯ ХИМИЧЕСКАЯ ПОСУДА
В химической лаборатории очень часто приходится работать с посудой из стекла и фарфора. Лабораторную посуду можно подразделить на следующие виды:
1. Посуду общего назначения;
2. Посуду специального назначения;
3. Мерную посуду;
4. Фарфоровую посуду.

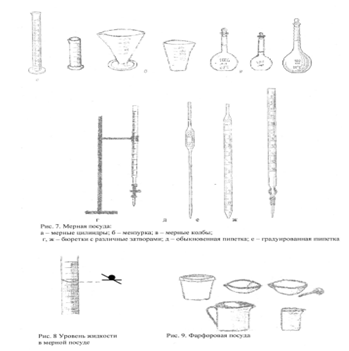
1. Посуда общего назначения
Пробирки (рис.1.) используют для проведения химических опытов с небольшим количеством веществ. Пробирки могут быть цилиндрические и конические. Хранят пробирки в штативах. Перемешивание веществ в них проводят встряхиванием пробирки, нанося небольшой удар пальцем по нижней части пробирки. Моют пробирки с помощью ерша.
Колбы (рис.2.) бывают разной вместимости (от 1-2 литров до 25 миллилитров) и разной формы: плоскодонные, круглодонные, конические, колбы Вюрца.
Стаканы (рис.3.) могут быть разной вместимости (от 1 литра до 25 миллилитров), разной формы, разные по высоте и ширине, термостойкие и нетермостойкие.
Воронки (рис.4.) бывают различной формы и размеров, и в зависимости от этого имеют разное назначение.
2. Посуда специального назначения
Эксикаторы (рис.5.) применяют для хранения веществ, легко поглощающих влагу, и для высушивания веществ. Для этого в нижнюю часть эксикатора помещают вещества, которые способны поглощать воду: СаCl2 (безводный), H2SO4 (концентрированная), Р2О5.
Промывные склянки (рис.6.) используют для промывания, очистки и высушивания газов.
3. Мерная посуда
Мерная посуда (рис.7.) - мерной называют посуду, применяемую для измерения объема жидкости с разной точностью.
Для измерения объема с небольшой точностью применяют мерные цилиндры и мензурки.
Для точного измерения объема жидкости используют пипетки, бюретки и мерные колбы.
Мерная посуда может быть разной вместимости. В зависимости от объема, который должен быть измерен, подбирается посуда соответствующей вместимости. Мерная посуда градуируется в миллилитрах (мл.) или литрах (л). 1 мл соответствует 1 см3, а 1 л - 1 дм3.
При измерении объема жидкости мерный сосуд необходимо держать в вертикальном положении, а отсчёты вести по нижней части вогнутой поверхности мениска жидкости. Причем глаз наблюдателя должен находиться на одной горизонтальной линии с нижним краем мениска (рис.8.).
Пипетки (рис.7.) используют для отмеривания и переноса, точно определенного объема жидкости. Обыкновенная пипетка представляет собой стеклянную трубку небольшого диаметра с расширением посередине или без него, если пипетка небольшой вместимости (от 0,1 до 2-5 мл). Нижний конец пипетки оттянут в капилляр, а на верхнем конце имеется метка, до которой набирают жидкость. Для отмеривания необходимого объема жидкости нижний конец пипетки, соответствующей вместимости, опускают в жидкость до дна сосуда и с помощью груши (или рта, если раствор не опасен) набирают жидкость, следя за тем, чтобы кончик пипетки все время находился в жидкости. Жидкость набирают выше метки на 2-3 см, затем быстро закрывают верхнее отверстие указательным пальцем, придерживаю пипетку большим и средним пальцами. Затем, слегка ослабив нажим указательного пальца, дают жидкости медленно вытекать из пипетки. Как только нижний мениск жидкости дойдет до метки, палец снова плотно прижимают к верхнему отверстию пипетки. Таким образом, с помощью пипетки отбирается необходимый объем жидкости. Затем пипетку вводят в колбу (или стакан), в которую нужно перенести жидкость, отнимают указательный палец от верхнего отверстия пипетки и дают жидкости стечь по стенке колбы. Оставшуюся при этом жидкость в пипетке не выдувают, так как объем пипетки рассчитан на свободное истечение жидкости.
Бюретки (рис.7.) применяют при титровании или для того, чтобы отмерить объем жидкости с точностью до 0,05 мл. Бюретка – стеклянная градуированная трубка, нижний конец которой оттянут и на него надета резиновая трубка со стеклянным шариком. Могут быть и бюретки с притертым стеклянным краном.
Перед началом работы бюретки закрепляют в штативе. Заполняют бюретку жидкостью сверху через воронку так, чтобы внутри находился раствор без пузырьков воздуха. Для удаления пузырьков воздуха резиновую трубку изгибают таким образом, чтобы кончик капилляра был направлен вверх, и вытесняют жидкостью весь воздух. Затем бюретку заполняют до нулевой отметки.
Мерные колбы (рис.7.) используют для приготовления растворов точной концентрации. Для этого в колбу вносят точную навеску сухого вещества или рассчитанный объем исходного раствора. Затем до половины объема колбы наливают дистиллированную воду. Раствор тщательно перемешивают и доливают дистиллированную воду до метки, (последние 1-2 мл лучше по каплям с помощью пипетки). Потом плотно закрывают колбу пробкой и тщательно перемешивают раствор, переворачивая колбу несколько раз.
4. Фарфоровая посуда
К фарфоровой посуде относят тигли, чашки, ступки, кружки, стаканы и т. д. (рис. 9). Чашки и тигли используют для выпаривания жидкостей и прокаливания твердых веществ. Они выдерживают температуру выше 1000°С. для измельчения твердых веществ используют ступки.
ЧТОБЫ ОПЫТ ПОЛУЧИЛСЯ…
…ознакомьтесь с каждым пунктом правил и старайтесь точно их выполнять.
В химический кабинет заходите только после того, как разрешит преподаватель. Не трогайте и не переставляйте на столе приготовленные реактивы и оборудование – это может затруднить вашу дальнейшую работу.
Прежде чем приступить к выполнению химических опытов, обязательно изучите описание лабораторной работы или практического занятия и внимательно выслушайте объяснения преподавателя. Проверьте, все ли необходимое для работы есть на вашем столе.
В ходе выполнения работы координируйте свои действия с действиями группы. Разговаривайте шепотом, чтобы не мешать работать другим. Если возникнут какие-либо затруднения, которые вы не можете разрешить самостоятельно, обратитесь за помощью к преподавателю.
Вещества берите только шпателем или ложечкой и в тех количествах, которые указаны в описании работы; если таких указаний нет, то объемы веществ не должны превышать 1 мл. (3-4 капли).
Чтобы не перепутать пробки, не открывайте одновременно несколько склянок.
Если вы случайно взяли вещества больше, чем нужно для данного опыта, лишнее вылейте в специальную склянку для слива веществ или, если вещество твердое, отсыпьте в коробку для мусора.
В химической лаборатории (кабинете) очень важно быть предельно аккуратным во всем – тут нет мелочей. Прежде чем начать работать руками, продумайте, как разместить оборудование на столе, чтобы было удобно, и работать, и наблюдать за ходом эксперимента.
Не забывайте, что за этим же столом с этими же реактивами и оборудованием будут работать студенты других групп, - не создавайте им дополнительных трудностей, оставив свое рабочее место в беспорядке.
Критерии оценивания практических работ
Отметка «5» ставится в том случае, если студент:
а) выполнил работу в полном объеме с соблюдением необходимой последовательности и правил по технике безопасности;
б) в представленном отчете правильно и аккуратно выполнил все задания;
в) написал химические реакции, расставил коэффициенты, указал наблюдения и сделал необходимые выводы.
Отметка «4» ставится в том случае, если выполнены требования к оценке «5», но:
а) написаны уравнения протекающей реакции, но не расставлены коэффициенты;
б) не указаны признаки протекающих реакций.
в) не сделан вывод по результатам работы.
Отметка «3» ставится, если в работе:
а) указан порядок действий, но нет уравнений протекающих реакций;
б) работа выполнена не полностью, однако объем выполненной части таков, что позволяет оценить базовый уровень усвоения знаний;
в) работа оформлена не по предложенному образцу.
Отметка «2» ставится в том случае, если:
а) работа выполнена не полностью, и объем выполненной части не позволяет оценить уровень усвоения знаний и умений;
б) в ходе работы и в отчете обнаружились в совокупности все недостатки, отмеченные в требованиях к оценке «3»;
в) при выполнении работы не соблюдались правила по технике безопасности.
3. Задания для практических работ
Раздел 1. Общая и неорганическая химия
Тема 1.2. Периодический закон и периодическая система химических элементов Д.И. Менделеева и строение атома
Лабораторный опыт №1
Тема: Моделирование построения периодической таблицы химических элементов
Цель занятия: научиться выявлять законы по таблице элементов.
Задание: изучить закономерности свойств химических элементов на примере 1-го -20-го элементов
Теоретические основы
Д.И. Менделеев определил, что общее у всех элементов – атомная масса. Свойства элементов зависят периодически от атомных масс. Учение о строении атомов вскрыло глубокий физический смысл периодического закона. Главной характеристикой атома является не атомная масса, а положительный заряд ядра атома. Теория строения атомов объясняет периодическое изменение свойств элементов. Свойства химических элементов и свойства их соединений находятся в периодической зависимости от заряда ядра атома. Периодический закон записан графически в виде таблицы. Периодическая таблица химических элементов имеет горизонтальные ряды – периоды, в которых прослеживается периодичность изменения свойств элементов от металлических свойств к неметаллическим свойствам. А также вертикальные ряды – группы, в которых объеденены химические элементы, соединения которых имеют сходные свойства.
При моделировании построения периодической таблицы необходимо рассмотреть периодичность изменения свойств химических элементов в ряду: H, He, Li, Be, B, C, N, O, F, Ne, Na, Mg, Al, Si, P, S, Cl, Ar. Затем разбейте этот ряд на горизонтальные и вертикальные ряды согласно вопросам задания. В итоге объедините эти ряды в прямоугольную таблицу, укажите номер периода, группы, порядковый номер химического элемента.
1.Ход работы:
1.1. Заготовьте 20 карточек размером 6 х 10 см. для элементов с порядковыми номерами с 1-го по 20–й в Периодической системе Менделеева.
На каждую карточку запишите следующие сведения об элементе:
- химический символ
- название
- значение относительной атомной массы
- формулу высшего оксида (в скобках укажите характер оксида- основный, кислотный или амфотерный)
- формулу высшего гидроксида (для гидроксидов металлов также укажите в скобках характер - основный или амфотерный)
- формулу летучего водородного соединения (для неметаллов).
1.2. Выявите и сформулируйте закономерность
1. Расположите карточки по возрастанию значений относительных атомных масс.
2. Расположите сходные элементы, начиная с 3-го по 18-й друг под другом. Водород и калий над литием и под натрием соответственно, кальций под магнием, а гелий над неоном.
3. Сформулируйте выявленную вами закономерность в виде закона
4. Поменяйте в полученном ряду местами аргон и калий. Объясните почему. Расположите сходные элементы, начиная с 3-го по 18-й друг под другом. Водород и калий над литием и под натрием соответственно, кальций под магнием, а гелий над неоном.
Вывод: ___________________________________________________
Контрольные вопросы:
1. Сформулируйте ПЗ по пунктам.
2. В чем физический смысл номера группы?
3. Как изменяются металлические свойства в группе?
4. Как изменяются неметаллические свойства в группе?
Тема 1.3. Строение вещества
Лабораторный опыт №2
Тема: Приготовление суспензии карбоната кальция в воде. Ознакомление со свойствами дисперсных систем
Цель занятия: изучить на ЛПЗ свойства дисперсных систем
Задание: получить дисперсные системы и исследовать их свойства
Теоретические основы
Дисперсные (раздробленные) системы являются гетерогенными, в отличие от истинных растворов (гомогенных). Они состоят из сплошной непрерывной фазы – дисперсионной среды и находящихся в этой среде раздробленных частиц того или иного размера и формы – дисперсной фазы.
Обязательным условием существования дисперсных систем является взаимная нерастворимость диспергированного вещества и дисперсионной среды.
Дисперсные системы классифицируют:
1. по степени дисперсности;
2. по агрегатному состоянию дисперсной фазы и дисперсионной среды;
3. по интенсивности взаимодействия между ними;
4. по отсутствию или образованию структур в дисперсных системах.
В зависимости от рамеров частиц дисперсной фазы дисперсные системы бывают в виде взвесей и коллоидов.
Взвеси (размер дисперсной фазы более 100нм) ─ эмульсии, суспензии, аэрозоли.
Коллоидные растворы (размер дисперсной фазы от 1 до 100нм) – гели, золи.
Агрегатное состояние дисперсных систем бывает разным и обозначается двумя буквами.
Например: аэрозоль обозначается Г-Ж.
Г – газообразная дисперсионная среда, Ж – жидкая дисперсная фаза.
Ход работы:
1.1. Приготовление суспензии мела.
В химический стакан поместите небольшое количество порошка мела и прилейте немного воды. Все тщательно перемешайте. Запишите наблюдения.
Поместите каплю, суспензии на стеклянную пластину и рассмотрите под микроскопом.
Запишите наблюдения.
Сформулируйте вывод о свойствах суспензии и схематически запишите агрегатное состояние дисперсной системы.
1.2. Приготовление эмульсии моторного масла.
В химический стакан поместите небольшое количество моторного масла и прилейте немного воды. Все тщательно перемешайте. Запишите наблюдения.
Поместите каплю, эмульсии на стеклянную пластину и рассмотрите под микроскопом.
Запишите наблюдения.
Сформулируйте вывод о свойствах суспензии и схематически запишите агрегатное состояние дисперсной системы.
Заполните таблицу
| Название дисперсной системы | Дисперсионная среда | Дисперсная фаза | Обозначение агрегатного состояния | Примеры дисперсных систем |
|
|
|
|
|
|
Вывод: _________________________________________________
Контрольные вопросы:
1. 1. Что такое смеси? Какими бывают смеси?
2. Выпишите в один ряд природные смеси, а в другой чистые вещества:
мел, карбонат натрия, песок, известь, оксид кремния, гидроксид натрия, мрамор, гипс, железная руда.
3. Какие смеси называются дисперсными?
4.Что показывает степень дисперсности?
5. Что такое монодисперсная и полидисперсная система?
6.Какие дисперсные системы называются свободнодисперсными и связнодисперсными?
Тема 1.4. Вода. Растворы. Электролитическая диссоциация
Практическая работа №3
Тема: Приготовление раствора заданной концентрации
Цель занятия: научиться готовить раствор с заданной процентной концентрацией.
Задание: Приготовьте раствор вещества с указанной массовой долей вещества (данные указаны в таблице для десяти вариантов)
Теоретические основы
Раствор – гомогенная система, состоящая из растворенного вещества и растворителя.
При решении задач пользуются формулами:
W Р.В. = m Р.В. / m Р-РА.
mр-ра = m Р.В. + m Н2О
m Р-РА – масса раствора, г.
m Р.В. – масса растворенного вещества, г.
m Н2О – масса воды, г.
WР.В. - массовая доля растворенного вещества.
10% раствор вещества содержит 10г растворенного вещества и 90г воды в 100г раствора.
Например: Определите массовую долю растворенного вещества, если 10 г его содержится в 100 г раствора. Какая масса воды содержится в растворе.
Дано: mР.В. = 10 г; mр-ра = 100 г
Найти: W Р.В.; m Н2О
Решение:
1. W Р.В. = (mр.в.)/(m р-ра); W Р.В. = 10/100 = 0,1
2. mн2о = mр-ра – mр.в.; mн2о = 100 – 10 = 90 г
Ответ: 0,1; 90 г
Ход работы:
1.1. Приготовьте раствор вещества с указанной массовой долей вещества (данные указаны в таблице для десяти вариантов).
| № варианта | наименование веществ | массовая доля вещества | масса раствора |
| 1 | сахар | 10 % | 200 г |
| 2 | поваренная соль | 15 % | 150 г |
| 3 | пищевая сода | 5 % | 100 г |
| 4 | сахар | 20 % | 50 г |
| 5 | поваренная соль | 25% | 100 г |
| 6 | пищевая сода | 30 % | 150 г |
| 7 | сахар | 45% | 200 г |
| 8 | поваренная соль | 35 % | 150 г |
| 9 | пищевая сода | 50 % | 100 г |
| 10 | сахар | 5 % | 50 г |
Произведите расчеты: определите, какую массу вещества и воды потребуется взять для приготовления раствора, указанного для вашего варианта.
Отвесьте соль и поместите ее в стакан.
Отмерьте измерительным цилиндром необходимый объем воды и вылейте в колбу с навеской соли.
Внимание! При отмеривании жидкости глаз наблюдателя должен находиться в одной плоскости с уровнем жидкости. Уровень жидкости прозрачных растворов устанавливают по нижнему мениску.
Образец отчёта по практическому занятию
Ответы на вопросы для закрепления теоретического материала
к практическому занятию
………………………………………………………………………
………………………………………………………………………
………………………………………………………………………
……………………………………………………………………….
………………………………………………………………………
| Номер и содержание задачи | Что делали? | Расчёты | Наблюдения |
|
|
|
|
|
Выводы: __________________________________________________
Контрольные вопросы:
1. Что такое растворы?
2.Из чего складывается масса раствора?
3. Как определяется массовая доля растворенного вещества в растворе?
4. Как приготовить10% раствор щелочи NaOH? Какая масса NaOH и воды содержится в таком растворе?
5. Решите задачу
1 уровень
1вариант:
Определите массовую долю растворенного вещества, если 20 г его содержится в 150 г раствора?
2 вариант:
Чему равна масса раствора, если 10г вещества растворили в100г воды?
Практическая работа № 4
Тема: Испытание растворов кислот индикаторами. Взаимодействие металлов с кислотами. Взаимодействие кислот с оксидами металлов. Взаимодействие кислот с основаниями. Взаимодействие кислот с солями.
Цель занятия: закрепить навыки проведения химических опытов и составления уравнений химических реакций
Задание: провести предложенные опыты и составить уравнения химических реакций
Теоретические основы
Галогены (от греч. halos - соль и genes - образующий) - элементы главной подгруппы VII группы периодической системы: фтор, хлор, бром, йод, астат.
Электронное строение и некоторые свойства атомов и молекул галогенов
| Символ элемента | F | Cl | Br | I | At |
| Порядковый номер | 9 | 17 | 35 | 53 | 85 |
| Строение внешнего электронного слоя | 2s22p5 | 3s23p5 | 4s24p5 | 5s25p5 | 6s26p5 |
| Энергия ионизации, эв | 17,42 | 12,97 | 11,84 | 10,45 | ~9,2 |
| Сродство атома к электрону,эв | 3,45 | 3,61 | 3,37 | 3,08 | ~2,8 |
| Относительная электроотрицательность (ЭО) | 4,0 | 3,0 | 2,8 | 2,5 | ~2,2 |
| Радиус атома, нм | 0,064 | 0,099 | 0,114 | 0,133 | – |
| Межъядерное расстояние в молекуле Э2, нм | 0,142 | 0,199 | 0,228 | 0,267 | – |
| Энергия связи в молекуле Э2 (25°С), кДж/моль | 159 | 243 | 192 | 157 | 109 |
| Степени окисления | -1 | -1, +1, +3,
+4, +5, +7 | -1, +1,+4,
+5, +7 | -1, +1, +3,
+5, +7 | – |
| Агрегатное состояние | Бледно-зелёный
газ | Зеленовато-желттый
газ | Бурая
жидкость | Темно-фиолетовые
кристаллы | Черные
кристаллы |
| t°пл.(°С) | -219 | -101 | -8 | 114 | 227 |
| t°кип.(°С) | -183 | -34 | 58 | 185 | 317 |
| r (г*см-3 ) | 1,51 | 1,57 | 3,14 | 4,93 | – |
| Растворимость в воде (г / 100 г воды) | реагирует
с водой | 2,5 : 1
по объему | 3,5 | 0,02 | – |
1) Общая электронная конфигурация внешнего энергетического уровня - nS2nP5.
2) С возрастанием порядкового номера элементов увеличиваются радиусы атомов, уменьшается электроотрицательность, ослабевают неметаллические свойства (увеличиваются металлические свойства); галогены - сильные окислители, окислительная способность элементов уменьшается с увеличением атомной массы.
3) Молекулы галогенов состоят из двух атомов.
4) С увеличением атомной массы окраска становится более темной, возрастают температуры плавления и кипения, а также плотность.
5) Сила галогеноводородных кислот возрастает с увеличением атомной массы.
6) Галогены могут образовывать соединения друг с другом (например, BrCl)
Ход работы:
1.1. Определение качественного состава соляной кислоты
В три пробирки прилейте по 1-2 мл раствора соляной кислоты;
В первую пробирку добавьте несколько капель лакмуса; во вторую – метилоранжа, а в третью пробирку – фенолфталеин;
Заполните таблицу
| Название индикатора | Цвет индикатора в нейтральной среде | Цвет индикатора в кислой среде |
| лакмус |
|
|
| метилоранж |
|
|
| фенолфталеин |
|
|
Определите наличие хлорид-иона в растворе соляной кислоты:
В пробирку прилейте 1 -2 мл раствора соляной кислоты;
Добавьте к раствору соляной кислоты раствор нитрата серебра;
Заполните таблицу
| Название опыта | Что делали? Что наблюдали? Выводы. | Составьте уравнения реакций между веществами |
| Определение хлорид - иона |
| HCl + AgNO3 → |
Выводы: __________________________________________________
Контрольные вопросы:
Составьте формулы всех кислот, образованных галогенами, запишите их названия.
Поставьте знак или = вместо *:
а) заряд ядра: Cl * Br; I * F; Cl * P;
б) число электронных слоёв: Cl * Br; I * F; Cl * P;
в) число электронов на внешнем уровне: Cl * Br; I * F; Cl * P;
г) радиус атома: Cl * Br; I * F; Cl * P;
д) восстановительные свойства: Cl * Br; I * F; Cl * P;
е) окислительные свойства: Cl * Br; I * F; Cl * P.
3. Дайте характеристику соляной кислоты:
а) по наличию кислорода - …………………………………………
б) по основности - …………………………………………………..
в) по растворимости в воде - ……………………………………….
г) по степени электролитической диссоциации - ..............................
д) по летучести - ………………………………………………….
е) по стабильности - ………………………………………………
Тема 1.6. Химические реакции
Практическая работа №5
Тема: Определение ОВР, выявление окислителя и восстановителя в уравнениях реакций
Цель занятия: научиться определять значение степени окисления элементов; процессы окисления и восстановления; расставлять коэффициенты методом электронного баланса;
Задание:
Теоретические основы
Окислительно-восстановительные процессы идут с изменением степеней окисления элементов, участвующих в них.
Степень окисления – это условный заряд атома, который вычисляется исходя из допущения, что молекула состоит из атомов.
Окислитель – это атом, ион или вещество их содержащее, который принимает электрон.
Восстановитель – это атом, ион или вещество их содержащее, который отдает электрон.
Окисление – это процесс отдачи электронов.
Восстановление – это процесс приема электронов.
Сокращения:
окислитель – о-ль,
восстановитель – в-ль,
окисление – о-ние,
восстановление – в-ние,
окислительно-восстановительные реакции – ОВР,
степень окисления – с.о.
Правила определения степени окисления:
1) С.о. элемента в простом веществе = 0;
2) Максимальная положительная с.о. элемента = номеру группы в которой стоит элемент (исключения- О2+, F0, элементы побочной подгруппы 8 группы);
3) Минимальная степень окисления = 8 – номер группы в которой стоит элемент
( только для элементов главных подгрупп 4-7 групп);
4) Сумма степеней окисления всех элементов в сложном веществе равна 0.
Алгоритм составления уравнений электронного баланса.
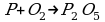
1) Расставить с.о. элементов.
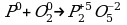
2) Выписать те элементы, у которых изменились с.о.

P0 P+5

O02 2O-2
3) Электронами сбалансировать разницу в с.о.
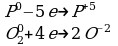
4) Найдите наименьшее общее кратное для количества электронов участвующих в процессе.

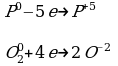 20
20
5) Определить коэффициенты.


 4
4
20
 5
5
6) Уравнять уравнение ОВР.

4P+5O2 2P2O5
7) Определить о-ль, в-ль, процессы о-ния, в-ния.


в-ль  4
4
20
о-ль  5
5
Ход работы:
1.1. Составьте электронные уравнения. Расставьте коэффициенты в окислительно-восстановительной реакции. Укажите окислитель и восстановитель, а так же какое вещество окисляется, какое - восстанавливается.
1. KMnO4 + H3PO4 + H2SO4 = MnSO4 + H3PO4 + K2SO4 + H2O
2. Zn0 + HCl- = H20 + Zn2+Cl2
Выводы: __________________________________________________
Контрольные вопросы:
1. Какие реакции называются окислительно-восстановитель-ными?
2. Что такое степень окисления атома? Как она определяется?
3. Чему равна степень окисления атомов в простых веществах?
4. Чему равна сумма степеней окисления всех атомов в молекуле?
5. Какой процесс называется процессом окисления?
6. Какие вещества называются окислителями?
7. Как меняется степень окисления окислителя в окислительно-восстановительных реакциях?
8. Приведите примеры веществ, являющихся в окислительно-восстановительных реакциях только окислителями.
9. Какой процесс называется процессом восстановления?
10. Дайте определение понятию «восстановитель».
11. Как меняется степень окисления восстановителя в окислительно-восстановительных реакциях?
Тема 1.7. Металлы и неметаллы
Практическая работа№6
Тема: Ознакомление со структурами серого и белого чугуна. Распознавание руд железа
Цель занятия: изучить микроструктуру, свойства, способы получения и применение чугуна
Задание: изучить микроструктуры белого и серого чугунов и описать способы получения чугуна, его свойств, области применения.
Ход работы:
1.1. По атласу микроструктур изучить микроструктуру белого и серых чугунов. Заполнить таблицу 1.
Таблица 1
| Название чугуна | Фазовый состав | Структурные составляющие | Схема микроструктуры |
|
|
|
|
|
|
|
|
|
|
2. Зарисовать схему микроструктуры серого чугуна.
3. Определить фазовый и структурный состав чугуна.
4. Визуально определить количество (в процентах) каждой структурной составляющей.
5. Рассчитать количество углерода в чугуне. Заполнить таблицу 2.
Таблица 2
| Наименование чугуна | Количество структурных составляющих, % | Количество связанного углерода, % | Количество углерода в чугуне, % |
| Ф | П | Г |
|
|
|
|
|
|
|
1.2. Описать способ получения чугуна, его свойства, области применения.
Справочный материал:
Определение содержания углерода в серых чугунах, %:
С= Ссвоб. +С связ.,
где Ссвоб. – количество углерода содержащегося в свободном состоянии в виде графита, %:
Ссвоб. =  ,
,
где Г – площадь шлифа, занятая графитом;
ρ1 – плотность графита, равная 2,3 г/см3;
ρ2 – плотность чугуна, равная 7,7 г/см3.
С связ. – количество связанного углерода (в виде цементита),%:
С связ. =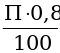 ,где П – площадь шлифа, занятая перлитом.
,где П – площадь шлифа, занятая перлитом.
Принято, что феррит практически не имеет углерода.
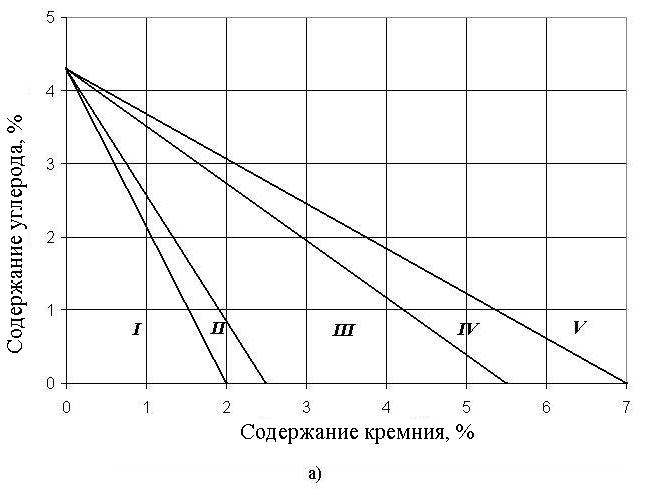
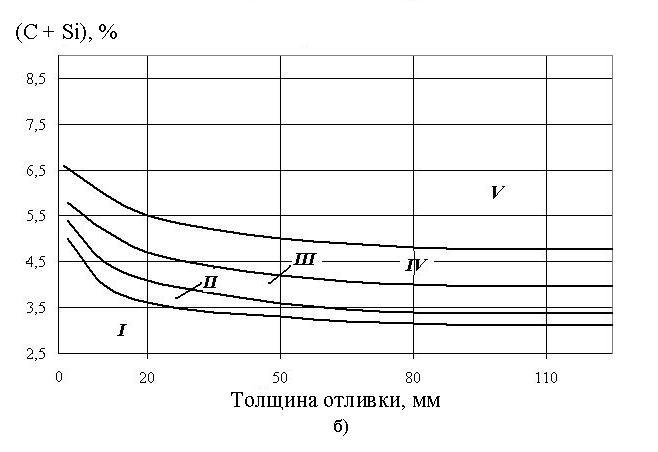
Рис. 1. Структурная диаграмма чугунов:
а) Влияние С и Si на структуру чугуна;
б) Влияние толщины отливки и суммы (С + Si) на структуру чугуна;
I – белые чугуны;
II – половинчатые чугуны;
III – серые перлитные чугуны;
IV – серые ферритно-перлитные чугуны;
V – серые ферритные чугуны.
Выводы: __________________________________________________
Контрольные вопросы:
1. Чем отличается белый чугун от серого?
2. На какие классы подразделяют серые чугуны в зависимости от формы графитовых включений?
3. Какая металлическая основа может быть в серых чугунах и от чего это зависит?
4. Как получить серый чугун?
5. Как получить ковкий чугун?
6. Как получить высокопрочный чугун?
7. Как маркируют серые чугуны?
8. Как влияет содержание углерода на структуру чугуна?.
Раздел 2. Органическая химия
Тема 2.1. Основные понятия органической химии и теория строения органических соединений
Тема 2.2. Углеводороды и их природные источники
Практическая работа №7
Тема: Ознакомление с коллекцией образцов нефти и продуктов ее переработки. Ознакомление с коллекцией каучуков и образцами изделий из резины
Цель занятия: на основе коллекционного материала ознакомиться c образцами нефти, угля и продуктами их переработки, каучуками и образцами изделий из резины.
Задание: ознакомиться с коллекциями: «Нефть и продукты ее переработки», «Каучуки и образцы изделий из резины», «Уголь и продукты его переработки».
Теоретические основы
Природными источниками различных углеводородов являются нефть, уголь, природный газ. Все перечисленное является источником получения энергии, а так же важнейшим химическим сырьем.
Нефть – это жидкий, горючий маслообразный минерал, имеющий окраску от светло-желтой до темно-коричневой, легче воды и практически в ней нерастворима. Нефть состоит из алканов, циклоалканов и ароматических углеводородов.
Уголь содержит 65 – 90% углерода. Уголь черного цвета твердое вещество отличается большой плотностью и блеском.
Каучуки – эластичные материалы, из которых путем специальной обработки получают резину. Сырой каучук липок, непрочен, а при небольшом понижении температуры становится хрупким. Чтобы придать изготовленным из каучука изделиям необходимую прочность и эластичность, каучук подвергают вулканизации – вводят в него серу и нагревают. Вулканизированный каучук называется резиной.
Натуральный каучук (НК) представляет высокомолекулярное соединение - полимер формула которого ( - СН2 – С = СН – СН2 -)n
/
CH3
Синтетические каучуки (СК) производят разного вида.
СКБ – продукт совместной полимеризации бутадиена с другими непредельнми углеводородами.
Формула СК ( - СН2 – СН = СН – СН2 - )n
Ход работы:
1.1 Ознакомление с коллекцией «Нефть и продукты ее переработки».Рассмотрите коллекцию. Запишите образцы нефти и их отличие по составу. Запишите продукты переработки нефти и их применение.
1 2. Ознакомление с коллекцией «Каучуки и образцы изделий из резины».
Рассмотрите коллекцию. Запишите образцы каучуков и их отличие по составу. Запишите образцы изделий из резины и их применение.
1.3. Ознакомление с коллекцией «Уголь и продукты его переработки».Рассмотрите коллекцию. Запишите образцы угля и их отличие по составу. Запишите продукты переработки угля и их применение.Данные наблюдений занесите в таблицу.
| Образцы | Физические свойства | Применение |
| 1.Нефть 1.1. |
|
|
| 2. Каучук 2.1. |
|
|
| 3. Уголь 3.1. |
|
|
Выводы: __________________________________________________
Контрольные вопросы:
1. Какие углеводороды входят в состав нефти?
2. Какие существуют методы переработки нефти?
3. Перечислите фракции перегонки нефти?
4. К каким органическим соединениям относятся каучуки?
5. Какие бывают синтетические каучуки?
6. На какие группы делятся каучуки по их назначению?
Тема 2.3. Кислородсодержащие органические соединения
Лабораторный опыт № 8
Тема: Взаимодействие глюкозы и сахарозы с гидроксидом меди (II). Качественная реакция на крахмал
Цель занятия: овладение навыками проведения химических опытов, с соблюдением правил техники безопасности, подтверждающих свойства глюкозы, сахарозы, крахмала
Задание: провести опыты подтверждающие свойства глюкозы, сахарозы, крахмала.
Теоретические основы
Углеводы. Одним из наиболее распространенных моносахаридов является глюкоза, которая имеет молекулярную формулу С6Н12О6. В молекуле глюкозы объединяются свойства альдегида и многоатомного спирта, поэтому глюкозу называют альдегидоспиртом. Подобно многоатомным спиртам глюкоза с гидроксидом меди (II) образуется ярко-синий раствор
СН2ОН ─ (СНОН)4 ─ C ═ O + 2Cu(OH)2 = CH2OH ─ (CHOH)4 ─ C ═ O + Cu2O + 2H2O
│ │
H OH
При нагревании глюкозы с аммиачным раствором оксида серебра получается характерная реакция на альдегиды – «серебряное зеркало».
СН2ОН ─(СНОН)4 ─C ═ O + Ag2O → CH2OH ─(CHOH)4 ─ C ═ O + 2Ag
│ │
H OH
Под действием биологических катализаторов – ферментов – глюкоза способна превращаться в спирт – это так называемое спиртовое брожение.
С6Н12О6 → 2С2Н5ОН + 2СО2
Крахмал представляет собой белый амфотерный порошок, нерастворимый в холодной воде. В горячей воде крахмал сначала набухает, а затем дает вязкий раствор, который называется клейстером.
Крахмал является смесью полисахаридов, поэтому не дает реакций, свойственных моносахаридам. Он не обладает восстановительными свойствами – не образует красного осадка оксида меди (I).
При действии минеральных кислот крахмал гидролизуется до глюкозы.
(С6Н10О5)n + n H2O → nC6H12O6
Характерной реакцией на крахмал является реакция его с раствором иода - раствор окрашивается в интенсивный синий цвет.
Ход работы:
1.1. В одну пробирку прилейте раствор глюкозы а, в другую пробирку раствор сахарозы и в каждую пробирку добавьте заранее приготовленный гидроксид меди (II). Запишите наблюдения и химическую реакцию взаимодействия глюкозы с Cu(OH)2. Затем обе пробирки нагрейте до кипения. Запишите наблюдения и химическую реакцию взаимодействия глюкозы с Cu(OH)2 при нагревании.
1.2.. Качественная реакция на крахмал.
В пробирку поместите небольшое количество порошка крахмала и прилейте 4мл воды все перемешайте стеклянной палочкой и нагрейте до кипения. Полученный крахмальный клейстер остудите, и добавьте 1 каплю раствора иода. Запишите наблюдения.
Выводы: __________________________________________________
Контрольные вопросы:
1. Почему глюкоза проявляет свойства альдегидов и спиртов?
2. Почему сахароза не дает реакцию «серебряного зеркала»?
3. Как можно обнаружить крахмал в продуктах питания?
Тема 2.4. Азотсодержащие органические соединения. Полимеры
Лабораторный опыт № 9
Тема: Растворение белков в воде. Обнаружение белков в молоке и в мясном бульоне. Денатурация раствора белка куриного яйца спиртом
Цель занятия: овладение навыками проведения химических опытов, подтверждающих свойства белков и их нахождение в продуктах питания
Задание: провести опыты подтверждающие свойства белков и их нахождение в продуктах питания
Теоретические основы
Белками или белковыми веществами, называют высокомолекулярные природные полимеры, молекулы которых построены из остатков аминокислот, соединенных амидной (пептидной) связью.
Белки - амфотерные электролиты. При определенном значении рН среды число положительных и отрицательных зарядов в молекуле белка одинаково. Это одно из основных свойств белка.
Под действием внешних факторов (температуры, механического воздействия, действия химических агентов) происходит изменение вторичной, третичной и четвертичной структур белковой макромолекулы. Первичная структура, а следовательно, и химический состав белка не меняется.
Ход работы:
1.1. Растворение белков в воде.
В пробирку с водой поместите немного куриного бека и перемешайте стеклянной палочкой. Запишите наблюдения.
1.2. Обнаружение белков в молоке и мясном бульоне.
В одну пробирку прилейте 4мл молока а, в другую пробирку 4мл мясного бульона и в каждую пробирку добавьте 4мл щелочи NaOH и 2мл раствора соли CuSO4. Появление характерного фиолетового окрашивания указывает на наличие белка. Запишите наблюдения.
1.3. Денатурация белка спиртом, растворами солей тяжелых металлов и при нагревании.
Полученный в первом опыте раствор куриного белка разлейте в три пробирки. В одну пробирку прилейте этиловый спирт, во вторую раствор нитрата свинца Pb(NO3)2 , а третью пробирку нагрейте. Запишите наблюдения.
Выводы: __________________________________________________
Контрольные вопросы:
1. Какой состав имеет молекула белка?
2. Какова структура белковой молекулы?
3. Какие химические соединения в организме используются для синтеза белков?
4. Какие цветные реакции доказывают наличие белка?
Библиографический список
Габриелян О.С. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования// О.С. Габриелян, И.Г. Остроумов. – 6-е изд., стер. - М.: Издательский центр «Академия», 2017.- 272с.
Ерохин Ю.М. Химия: Задачи и упражнения. – М.: 2014
Ерохин Ю.М. Сборник тестовых заданий по химии. – М.: Академия, 2014
Интернет ресурсы:
1. hemi.wallst.ru - «Химия. Образовательный сайт для школьников»
2. www.alhimikov.net - Образовательный сайт для школьников
3. chem.msu.su - Электронная библиотека по химии
4. www.hij.ru/ -«Химия и жизнь»
5. chemistry-chemists.com/index.html - электронный журнал «Химики и химия»
Содержание
| Введение………………………………………………………………………………….. | 3 |
| Инструкция по технике безопасности при выполнении заданий на практических занятиях………………………………………………………………………………….. |
5 |
| Перечень практических работ…………………………………………………………... | 10 |
| Методические указания………………………………………………………………… | 11 |
| Задания для практических работ ………………………………………………………. | 18 |
| Библиографический список…………….…………………….………………………… | 35 |









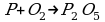
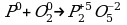

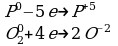

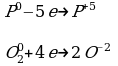 20
20 4
4 5
5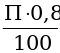 ,где П – площадь шлифа, занятая перлитом.
,где П – площадь шлифа, занятая перлитом.




















