СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока


Методические рекомендации по выполнению лабораторных и практических работ по дисциплине "Естествознание" СПО
Просмотр содержимого документа
«Методические рекомендации по выполнению лабораторных и практических работ по дисциплине "Естествознание" СПО»
МИНИСТЕРСТВО ОБРАЗОВАНИЯ Московской области
государственное бюджетное профессиональное
образовательное учреждение Московской области
«Шатурский энергетический техникум»
(ГБПОУ МО «ШЭТ»)
Методические указания по выполнению
практических (лабораторных) работ
по дисциплине Естествознание (биология, химия)
| Для профессии: | 43.02.15 Поварское и кондитерское |
| | дело |
| | |
( С Б О Р Н И К)
Шатура
2019 г.
Сборник методических указаний по выполнению практических (лабораторных) работ сформирован в соответствии с требованиями ФГОС СПО и соответствует тематике практических (лабораторных) занятий утвержденной рабочей программы по дисциплине Естествознание(биология, химия)
| Авторы -разработчики: | Кудашкина С.Н. преподаватель химии, |
| Ф.И.О.,, должность | |
| биологии | |
| Ф.И.О., должность | |
| | |
| Ф.И.О., , должность |
ОДОБРЕНО
Цикловой комиссией
Общеобразовательных дисциплин
Протокол № 1 от «30» августа 2019г.
Председатель: ___________
СОДЕРЖАНИЕ
I.Описание лабораторных работ
1-2 Наблюдение клеток растений и животных под микроскопом на готовых микропрепаратах и их описание. Сравнение строения клеток растений и животных
3. Реакции замещения меди железом в растворе медного купороса. Реакции, идущие с образованием осадка, газа и воды
этилена с пламенем предельных углеводородов ( пропан -бутановой смеси)
4. Зависимость скорости взаимодействия соляной кислоты с металлами от их природы. Зависимость скорости взаимодействия цинка с соляной кислотой от её концентрации. Зависимость скорости взаимодействия оксида меди (II) с серной кислотой от температуры
5. Ознакомление со структурами серого и белого чугуна. Распознавание руд железа
6. Изготовление моделей молекул органических веществ различных классов
7. Обнаружение углерода и водорода в органическом соединении. Обнаружение галогенов (проба Бейльштейна)
8. Получение этилена дегидратацией этилового спирта. Взаимодействие этилена с бромной водой, раствором перманганата калия. Сравнение пламени этилена с пламенем предельных углеводородов ( пропан -бутановой смеси)
9. Ознакомление с коллекцией каучуков и образцами изделий из резины
10. Ознакомление с коллекцией образцов нефти и продуктов её переработки. Определение наличия непредельных углеводородов в бензине и керосине. Растворимость различных нефтепродуктов (бензина, керосина, дизельного топлива, вазелина, парафина) друг в друге
11. Изучение восстановительных свойств альдегидов: реакция «серебряного зеркала», восстановление гидроксида меди (II). Взаимодействие формальдегида с гидросульфитом натрия
12. Получение уксусной кислоты. Взаимодействие раствора уксусной кислоты с магнием, оксидом цинка, гидроксидом железа (III), раствором карбоната калия и стеарата калия
13. Ознакомление с образцами сложных эфиров. Отношение сложных эфиров к воде и органическим веществам. Выведение жирного пятна с помощью сложного эфира. Растворимость жиров в воде и органических растворителях
14. Ознакомление с физическими свойствами глюкозы (аптечная упаковка, таблетки). Взаимодействие глюкозы и сахарозы с гидроксидом меди (II). Кислотный гидролиз сахарозы.
15. Знакомство с образцами полисахаридов. Качественная реакция на крахмал.
Обнаружение крахмала в меде, хлебе, йогурте, маргарине, макаронных изделий, крупах
II.Описание практических работ
1.Решение элементарных генетических задач
2. Анализ и оценка этических аспектов развития некоторых исследований в биотехнологии
3. Описание особей вида по морфологическому критерию
4. Приспособление организмов к разным средам обитания (к водной, наземно-воздушной, почвенной)
5. Анализ и оценка различных гипотез происхождения человека
6. Составление схем передачи веществ и энергии (цепей питания).
Сравнительная характеристика природных экосистем и агроэкосистем своей местности
7. Решение экологических задач. Анализ и оценка последствий собственной
деятельности в окружающей среде, глобальных экологических проблем и путей их решения
8. Определение рН раствора солей
9. Взаимодействие металлов с растворами кислот и солей
10. Испытание растворов щелочей индикаторами. Взаимодействие щелочей с солями. Разложение нерастворимых оснований
11. Изучение растворимости спиртов в воде. Окисление спиртов различного строения хромовой смесью. Получение диэтилового эфира. Получение глицерата меди
12. Растворимость различных карбоновых кислот в воде. Взаимодействие уксусной кислоты с металлами
13. Омыление жира. Получение мыла и изучение его свойств: пенообразование, реакции ионного обмена, гидролиз, выделение свободных жирных кислот
14. Реакция «серебряного зеркала» глюкозы. Взаимодействие глюкозы с гидроксидом меди (II) при различных температурах. Действие аммиачного раствора оксида серебра на сахарозу.
15. Образование солей глицина. Получение медной соли глицина. Денатурация белка. Цветные реакции белков
РАЗДЕЛ I
Описание лабораторных работ
Лабораторная работа № 1-2
Наблюдений клеток растений и животных под микроскопом на готовых микропрепаратах, их описание. Сравнение строения клеток растений и животных по готовым микропрепаратам
Цель работы: ознакомиться с особенностями строения клеток растений и животных организмов, показать принципиальное единство их строения.
Оборудование и реактивы: конспект лекций, методические указания по выполнению работы, инструкции по технике безопасности; кожица чешуи луковицы, эпителиальные клетки из полости рта человека, микроскоп, микропрепараты, чайная ложечка, покровное и предметное стекла, синие чернила, йод, тетрадь, ручка, простой карандаш, линейка
Общие теоретические сведения: На заре развития жизни на Земле все клеточные формы были представлены бактериями. Они всасывали органические вещества, растворённые в первичном океане, через поверхность тела.
Со временем некоторые бактерии приспособились производить органические вещества из неорганических. Для этого они использовали энергию солнечного света. Возникла первая экологическая система, в которой эти организмы были производителями. В результате этого в атмосфере Земли появился кислород, выделяемый этими организмами. С его помощью можно из той же самой пищи получить гораздо больше энергии, а добавочную энергию использовать на усложнение строения тела: разделение тела на части.
Одно из важных достижений жизни – разделение ядра и цитоплазмы. В ядре находится наследственная информация. Специальная мембрана вокруг ядра позволила защитить от случайных повреждений. По мере необходимости цитоплазма получает из ядра команды, направляющие жизнедеятельность и развитие клетки.
Организмы, у которых ядро отделено от цитоплазмы, образовали надцарство ядерных (к ним относятся – растения, грибы, животные).
Таким образом, клетка – основа организации растений и животных – возникла и развилась в ходе биологической эволюции.
Даже не вооружённым глазом, а ещё лучше под лупой можно видеть, что мякоть зрелого арбуза состоит из очень мелких крупинок, или зёрнышек. Это клетки – мельчайшие «кирпичики», из которых состоят тела всех живых организмов, в том числе и растительных.
Жизнь растения осуществляется соединённой деятельностью его клеток, создающих единое целое. При многоклеточности частей растения существует физиологическое разграничение их функций, специализация различных клеток в зависимости от местоположения их в теле растения.
Растительная клетка отличается от животной тем, что имеет плотную оболочку, покрывающую внутреннее содержимое со всех сторон. Клетка не является плоской (как её принято изображать), она скорей всего похожа на очень маленький пузырёк, наполненный слизистым содержимым. Снаружи клетка покрыта плотной клеточной стенкой, в которой имеются более тонкие участки – поры. Под ней находится очень тонкая плёнка – мембрана, покрывающая содержимое клетки – цитоплазму. В цитоплазме есть полости – вакуоли, заполненные клеточным соком. В центре клетки или около клеточной стенки расположено плотное тельце – ядро с ядрышком. От цитоплазмы ядро отделено ядерной оболочкой. По всей цитоплазме распределены мелкие тельца – пластиды.
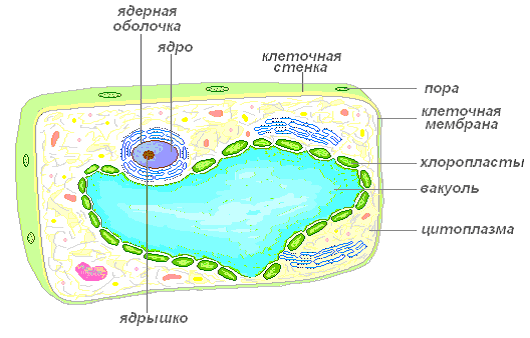
Живая часть клетки – это ограниченная мембраной, упорядоченная, структурированная система биополимеров и внутренних мембранных структур, участвующих в совокупности метаболических и энергетических процессов, осуществляющих поддержание и воспроизведение всей системы в целом.
Важной особенностью является то, что в клетке нет открытых мембран со свободными концами. Клеточные мембраны всегда ограничивают полости или участки, закрывая их со всех сторон.

Плазмалемма (наружная клеточная мембрана) – ультрамикроскопическая плёнка толщиной 7,5 нм., состоящая из белков, фосфолипидов и воды. Это очень эластичная плёнка, хорошо смачивающаяся водой и быстро восстанавливающая целостность после повреждения. Имеет универсальное строение, т.е.типичное для всех биологических мембран. У растительных клеток снаружи от клеточной мембраны находится прочная, создающая внешнюю опору и поддерживающая форму клетки клеточная стенка. Она состоит из клетчатки (целлюлозы) – нерастворимого в воде полисахарида.
Плазмодесмы растительной клетки, представляют собой субмикроскопические канальцы, пронизывающие оболочки и выстланные плазматической мембраной, которая таким образом переходит из одной клетки в другую, не прерываясь. С их помощью происходит межклеточная циркуляция растворов, содержащих органические питательные вещества. По ним же идёт передача биопотенциалов и другой информации.
Порами называют отверстия во вторичной оболочке, где клетки разделяют лишь первичная оболочка и срединная пластинка. Участки первичной оболочки и срединную пластинку, разделяющие соседствующие поры смежных клеток, называют поровой мембраной или замыкающей пленкой поры. Замыкающую пленку поры пронизывают плазмодесменные канальцы, но сквозного отверстия в порах обычно не образуется. Поры облегчают транспорт воды и растворенных веществ от клетки к клетке. В стенках соседних клеток, как правило, одна против другой, образуются поры.
Клеточная оболочка имеет хорошо выраженную, относительно толстую оболочку полисахаридной природы. Оболочка растительной клетки продукт деятельности цитоплазмы. В её образовании активное участие принимает аппарат Гольджи и эндоплазматическая сеть.
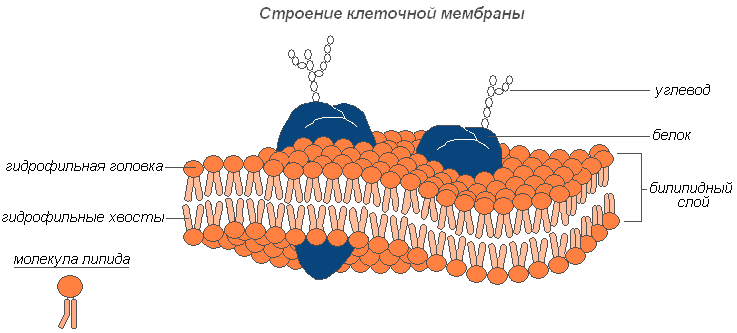
Основу цитоплазмы составляет ее матрикс, или гиалоплазма, - сложная бесцветная, оптически прозрачная коллоидная система, способная к обратимым переходам из золя в гель. Важнейшая роль гиалоплазмы заключается в объединении всех клеточных структур в единую систему и обеспечении взаимодействия между ними в процессах клеточного метаболизма.
Гиалоплазма (или матрикс цитоплазмы) составляет внутреннюю среду клетки. Состоит из воды и различных биополимеров (белков, нуклеиновых кислот, полисахаридов, липидов), из которых основную часть составляют белки различной химической и функциональной специфичности. В гиалоплазме содержатся также аминокислоты, моносахара, нуклеотиды и другие низкомолекулярные вещества.
Биополимеры образуют с водой коллоидную среду, которая в зависимости от условий может быть плотной (в форме геля) или более жидкой (в форме золя), как во всей цитоплазме, так и в отдельных ее участках. В гиалоплазме локализуются и взаимодействуют между собой и средой гиалоплазмы различные органеллы и включения. При этом расположение их чаще всего специфично для определенных типов клеток. Через билипидную мембрану гиалоплазма взаимодействует с внеклеточной средой. Следовательно, гиалоплазма является динамической средой и играет важную роль в функционировании отдельных органелл и жизнедеятельности клеток в целом.
Органеллы (органоиды) – структурные компоненты цитоплазмы. Они имеют определённую форму и размеры, являются обязательными цитоплазматическими структурами клетки. При их отсутствии или повреждении клетка обычно теряет способность к дальнейшему существованию. Многие из органоидов способны к делению и самовоспроизведению. Размеры их настолько малы, что их можно видеть только в электронный микроскоп.
ЯдроЯдро – самая заметная и обычно самая крупная органелла клетки. Оно впервые было подробно исследовано Робертом Броуном в 1831 году. Ядро обеспечивает важнейшие метаболические и генетические функции клетки. По форме оно достаточно изменчиво: может быть шаровидным, овальным, лопастным, линзовидным.
Ядро играет значительную роль в жизни клетки. Клетка, из которой удалили ядро, не выделяет более оболочку, перестаёт расти и синтезировать вещества. В ней усиливаются продукты распада и разрушения, вследствие этого она быстро погибает. Образование нового ядра из цитоплазмы не происходит. Новые ядра образуются только делением или дроблением старого.
Внутреннее содержимое ядра составляет кариолимфа (ядерный сок), заполняющая пространство между структурами ядра. В нём находится одно или несколько ядрышек, а также значительное количество молекул ДНК, соединённых со специфическими белками – гистонами.

Ядрышко – как и цитоплазма, содержит преимущественно РНК и специфические белки. Важнейшая его функция заключается в том, что в нём происходит формирование рибосом, которые осуществляют синтез белков в клетке.
Аппарат ГольджиАппарат Гольджи – органоид, имеющий универсальное распространение во всех разновидностях эукариотических клеток. Представляет собой многоярусную систему плоских мембранных мешочков, которые по периферии утолщаются и образуют пузырчатые отростки. Он чаще всего расположен вблизи ядра.

В состав аппарата Гольджи обязательно входит система мелких пузырьков (везикул), которые отшнуровываются от утолщённых цистерн (диски) и располагаются по периферии этой структуры. Эти пузырьки играют роль внутриклеточной транспортной системы специфических секторных гранул, могут служить источником клеточных лизосом.
Функции аппарата Гольджи состоят также в накоплении, сепарации и выделении за пределы клетки с помощью пузырьков продуктов внутриклеточного синтеза, продуктов распада, токсических веществ. Продукты синтетической деятельности клетки, а также различные вещества, поступающие в клетку из окружающей среды по каналам эндоплазматической сети, транспортируются к аппарату Гольджи, накапливаются в этом органоиде, а затем в виде капелек или зёрен поступают в цитоплазму и либо используются самой клеткой, либо выводятся наружу. В растительных клетках Аппарат Гольджи содержит ферменты синтеза полисахаридов и сам полисахаридный материал, который используется для построения клеточной оболочки. Предполагают, что он участвует в образовании вакуолей. Аппарат Гольджи был назван так в честь итальянского учёного Камилло Гольджи, впервые обнаружившего его в 1897 году.
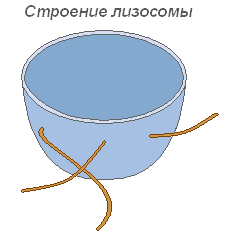
ЛизосомыЛизосомы представляют собой мелкие пузырьки, ограниченные мембраной основная функция которых – осуществление внутриклеточного пищеварения. Использование лизосомного аппарата происходит при прорастании семени растения (гидролиз запасных питательных веществ).
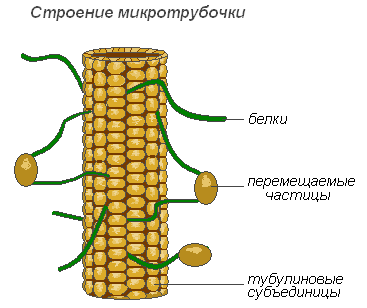
Микротрубочки – мембранные, надмолекулярные структуры, состоящие из белковых глобул, расположенных спиральными или прямолинейными рядами. Микротрубочки выполняют преимущественно механическую (двигательную) функцию, обеспечивая подвижность и сокращаемость органоидов клетки. Располагаясь в цитоплазме, они придают клетке определённую форму и обеспечивают стабильность пространственного расположения органоидов. Микротрубочки способствуют перемещению органоидов в места, которые определяются физиологическими потребностями клетки. Значительное количество этих структур расположено в плазмалемме, вблизи клеточной оболочки, где они участвуют в формировании и ориентации целлюлозных микрофибрилл оболочек растительных клеток.
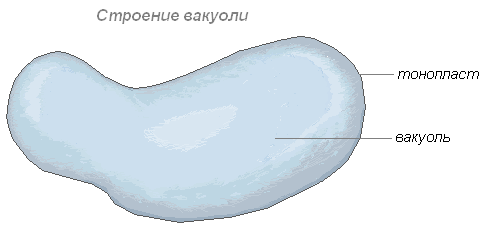
Вакуоль – важнейшая составная часть растительных клеток. Она представляет собой своеобразную полость (резервуар) в массе цитоплазмы, заполненную водным раствором минеральных солей, аминокислот, органических кислот, пигментов, углеводов и отделённую от цитоплазмы вакуолярной мембраной – тонопластом.
Цитоплазма заполняет всю внутреннюю полость только у самых молодых растительных клеток. С ростом клетки существенно изменяется пространственное расположение вначале сплошной массы цитоплазмы: у неё появляются заполненные клеточным соком небольшие вакуоли, и вся масса становится ноздреватой. При дальнейшем росте клетки отдельные вакуоли сливаются, оттесняя к периферии прослойки цитоплазмы, в результате чего в сформированной клетке находится обычно одна большая вакуоль, а цитоплазма со всеми органеллами располагаются около оболочки.
Водорастворимые органические и минеральные соединения вакуолей обусловливают соответствующие осмотические свойства живых клеток. Этот раствор определённой концентрации является своеобразным осмотическим насосом для регулируемого проникновения в клетку и выделения из неё воды, ионов и молекул метаболитов.
В комплексе со слоем цитоплазмы и её мембранами, характеризующимися свойствами полупроницаемости, вакуоль образует эффективную осмотическую систему. Осмотически обусловленными являются такие показатели живых растительных клеток, как осмотический потенциал, сосущая сила и тургорное давление.
Пластиды – самые крупные (после ядра) цитоплазматические органоиды, присущие только клеткам растительных организмов. Они не найдены только у грибов. Пластиды играют важную роль в обмене веществ. Они отделены от цитоплазмы двойной мембранной оболочкой, а некоторые их типы имеют хорошо развитую и упорядоченную систему внутренних мембран. Все пластиды едины по происхождению.
Хлоропласты – наиболее распространённые и наиболее функционально важные пластиды фотоавтотрофных организмов, которые осуществляют фотосинтетические процессы, приводящие в конечном итоге к образованию органических веществ и выделению свободного кислорода. Хлоропласты высших растений имеют сложное внутреннее строение.
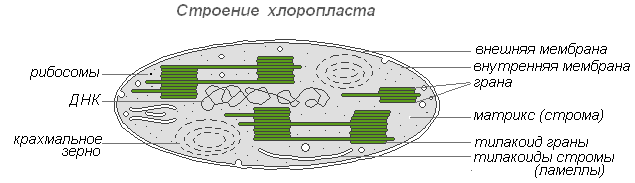
Размеры хлоропластов у разных растений неодинаковы, но в среднем диаметр их составляет 4-6 мкм. Хлоропласты способны передвигаться под влиянием движения цитоплазмы. Кроме того, под воздействием освещения наблюдается активное передвижение хлоропластов амебовидного типа к источнику света.
Хлорофилл – основное вещество хлоропластов. Благодаря хлорофиллу зелёные растения способны использовать световую энергию.
Лейкопласты (бесцветные пластиды) представляют собой чётко обозначенные тельца цитоплазмы. Размеры их несколько меньше, чем размеры хлоропластов. Более и однообразна и их форма, приближающая к сферической.

Встречаются в клетках эпидермиса, клубнях, корневищах. При освещении очень быстро превращаются в хлоропласты с соответствующим изменением внутренней структуры. Лейкопласты содержат ферменты, с помощью которых из излишков глюкозы, образованной в процессе фотосинтеза, в них синтезируется крахмал, основная масса которого откладывается в запасающих тканях или органах (клубнях, корневищах, семенах) в виде крахмальных зёрен. У некоторых растений в лейкопластах откладываются жиры. Резервная функция лейкопластов изредка проявляется в образовании запасных белков в форме кристаллов или аморфных включений.
Хромопласты в большинстве случаев являются производными хлоропластов, изредка – лейкопластов.
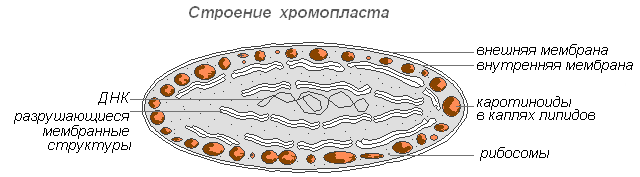
Созревание плодов шиповника, перца, помидоров сопровождается превращением хлоро- или лейкопластов клеток мякоти в каратиноидопласты. Последние содержат преимущественно жёлтые пластидные пигменты – каратиноиды, которые при созревании интенсивно синтезируются в них, образуя окрашенные липидные капли, твёрдые глобулы или кристаллы. Хлорофилл при этом разрушается.
Митохондрии Митохондрии – органеллы, характерные для большинства клеток растений. Имеют изменчивую форму палочек, зёрнышек, нитей. Открыты в 1894 году Р. Альтманом с помощью светового микроскопа, а внутреннее строение было изучено позднее с помощью электронного. 
Митохондрии имеют двухмембранное строение. Внешняя мембрана гладкая, внутренняя образует различной формы выросты – трубочки в растительных клетках. Пространство внутри митохондрии заполнено полужидким содержимым (матриксом), куда входят ферменты, белки, липиды, соли кальция и магния, витамины, а также РНК, ДНК и рибосомы. Ферментативный комплекс митохондрий ускоряет работу сложного и взаимосвязанного механизма биохимических реакций, в результате которых образуется АТФ. В этих органеллах осуществляется обеспечение клеток энергией – преобразование энергии химических связей питательных веществ в макроэргиеские связи АТФ в процессе клеточного дыхания. Именно в митохондриях происходит ферментативное расщепление углеводов, жирных кислот, аминокислот с освобождением энергии и последующим превращением её в энергию АТФ. Накопленная энергия расходуется на ростовые процессы, на новые синтезы и т. д. Митохондрии размножаются делением и живут около 10 дней, после чего подвергаются разрушению.
Эндоплазматическая сетьЭндоплазматическая сеть – сеть каналов, трубочек, пузырьков, цистерн, расположенных внутри цитоплазмы. Открыта в 1945 году английским учёным К. Портером, представляет собой систему мембран, имеющих ультрамикроскопическое строение.

Вся сеть объединена в единое целое с наружной клеточной мембраной ядерной оболочки. Различают ЭПС гладкую и шероховатую, несущую на себе рибосомы. На мембранах гладкой ЭПС находятся ферментные системы, участвующие в жировом и углеводном обмене. Этот тип мембран преобладает в клетках семян, богатых запасными веществами (белками, углеводами, маслами), рибосомы прикрепляются к мембране гранулярной ЭПС, и во время синтеза белковой молекулы полипептидная цепочка с рибосомами погружается в канал ЭПС. Функции эндоплазматической сети очень разнообразны: транспорт веществ как внутри клетки, так и между соседними клетками; разделение клетки на отдельные секции, в которых одновременно проходят различные физиологические процессы и химические реакции.
РибосомыРибосомы – немембранные клеточные органоиды. Каждая рибосома состоит из двух не одинаковых по размеру частичек и может делиться на два фрагмента, которые продолжают сохранять способность синтезировать белок после объединения в целую рибосому.

Рибосомы синтезируются в ядре, затем покидают его, переходя в цитоплазму, где прикрепляются к наружной поверхности мембран эндоплазматической сети или располагаются свободно. В зависимости от типа синтезируемого белка рибосомы могут функционировать по одиночке или объединяться в комплексы - полирибосомы
Строение животной клетки
Особенности строения клеток животных отличаются от особенностей устройства клетки растений или человека.

Животные относятся к эукариотам. Эукариоты представляют собой организмы, которые обладают оформленным ядром клетки, чем не могут похвастаться прокариоты. Генетический материал располагается в линейных молекулах ДНК. Система внутренних мембран эукариотов образовывает широкий ряд органоидов.
Все строение клетки опирается на следующие составляющие:
Клеточная оболочка;
Цитоплазма;
Ядро.
Ядро и цитоплазма образуют собой протоплазму, которая состоит из водорода, азота, углерода и других элементов. Переваренная организмом пища поглощается протоплазмой и становится ее частью. Клеточная стенка – это оболочка для внутренних органоидов, которая отделяет их от внешнего мира. Одна из особенностей строения клетки животного – отсутствие плотной клеточной стенки.
Гликокалис – структура, обеспечивающая выборочную способность мембраны. Нужные вещества пропускаются внутрь, а все остальные задерживаются снаружи. Проникновение любого вещества осуществляется под контролем цитоплазматической мембраны, поверхность которой покрыта ворсинками, изгибами, складками.
Цитоплазма – жидкость, состоящая по большому счету из одной воды. Именно в ней находятся все органоиды клетки. Помимо воды, под микроскопом можно разглядеть белковые нити, которые напрямую отвечают за процесс деления. Еще одна важная составляющая цитоплазмы – гиалоплазма, которая отвечает за эластичность всей структуры клетки. Из-за ряда факторов, гиалоплазма может изменить свою консистенцию.
Клеточные органоидыОсобенности строения животных клеток заключаются в наличии специфических структур клеточных органоидов, которые не характеры для растений или человека.
Главная единица клетки – это ядро, в котором хранится наследственная информация. Происходит это благодаря хроматину, который представляет собой комплекс белков и ДНК. Внутри ядра животной клетки находятся белковый матрикс, отвечающий за верное расположение хромосом.
Самая плотная часть ядра – ядрышко, главная особенность которого проявляется в повышенном содержании РНК. Его основная функция заключается в образовании рибосом.
В большинстве животных клеток аппарат Гольджи имеет форму сети, расположенной вокруг ядра. Главная функция аппарата – транспортировка по каналам белков, углеводов и жиров, также в его мембране происходит синтез полисахаридов.
Лизосомы призваны расщеплять своими ферментами пептиды, полисахариды, нуклеиновые кислоты. Представляют они собой маленькие пузырьки, покрытые собственной мембраной.
Особенности строения клеток животных разнообразны, к ним относятся центриоли, которые во время деления клетки создают микротрубочки, входящие в состав цитоскелета. Строение любой клетки живого организма сложно, ведь именно на клеточном уровне протекает огромное количество процессов, которые обеспечивают жизнедеятельность всего организма.
Методы изучения клетки различны:
методы оптической и электронной микроскопии. Первый микроскоп был сконструирован Р.Гуком 3 столетия назад, давая увеличение до 200 раз. Световой микроскоп нашего времени увеличивает до 300 раз и более. Однако и такое увеличение недостаточно для того, чтобы увидеть клеточные структуры. В настоящее время применяют электронный микроскоп, увеличивающий предметы в десятки и сотни тысяч раз (до 10 000 000).
Строение микроскопа: 1.Окуляр; 2.Тубус; 3.Объективы; 4.Зеркало; 5.Штатив; 6.Зажим; 7.Столик; 8.Винт

2) химические методы исследования
3) метод клеточных культур на жидких питательных средах
4) метод микрохирургии
5) метод дифференциального центрифугирования.
Основные положения современной клеточной теории:
1.Структура. Клетка – это живая микроскопическая система, состоящая из ядра, цитоплазмы и органоидов.
2.Происхождение клетки. Новые клетки образуются путём деления ранее существующих клеток.
3.Функции клетки. В клетке осуществляются:
- метаболизм (совокупность повторяющихся, обратимых, циклических процессов – химических реакций);
- обратимые физиологические процессы (поступление и выделение веществ, раздражимость, движение);
- необратимые химические процессы (развитие).
4.Клетка и организм. Клетка может быть самостоятельным организмом, осуществляющим всю полноту жизненных процессов. Все многоклеточные организмы состоят из клеток. Рост и развитие многоклеточного организма – следствие роста и размножения одной или нескольких исходных клеток.
5.Эволюция клетки. Клеточная организация возникла на заре жизни и прошла длительный путь развития от безъядерных форм к ядерным одноклеточным и многоклеточным организмам.
| Задание: | 1. Изучите строение микроскопа. Подготовьте микроскоп к работе 2. Рассмотрите под микроскопом готовые микропрепараты растительных и животных клеток. 3. Зарисуйте по одной растительной и животной клетке. Подпишите их основные части, видимые в микроскоп. 4.Сравните строение растительной и животной клеток. Сравнение провести при помощи сравнительной таблицы. Сделайте вывод о сложности их строения. 5. Отделите от чешуи луковицы кусочек покрывающей её кожицы и поместите его на предметное стекло микроскопа 6. Нанесите капельку слабого водного раствора йода на препарат. Накройте препарат покровным стеклом. 7. Снимите чайной ложечкой немного слизи с внутренней стороны щеки. 8. Поместите слизь на предметное стекло и подкрасьте разбавленными в воде синими чернилами. Накройте препарат покровным стеклом. 9. Рассмотрите оба препарата под микроскопом. 10. Результаты сравнения занесите в таблицу 1 и 2. 11. Сделайте вывод о проделанной работе. |
| Содержание отчета: | Составьте отчёт в форме таблиц Таблица 1 Сходства и отличия растительной и животной клетки
Таблица 2 Сравнительная характеристика растительной и животной клетки
5. Выводы по проделанной работе - о взаимосвязи строения и функций; - о едином плане строении. | ||||||||||||||||||
Методические указания по выполнению работы:
Повторите материал по данной теме по конспекту или учебнику
Оформите отчет по работе (заполните таблицы, зарисуйте клетки, обозначьте видимые в световой микроскоп органоиды. Сделайте вывод, сравнив эти клетки между собой и ответив на вопрос: каковы причины сходства и различия клеток разных организмов?)
2. Подготовьтесь к защите работы
Тематика контрольных вопросов:
1. Какие функции выполняет наружная цитоплазматическая мембрана?
2. Какие органоиды входят в состав системы цитоплазмы?
3. Каковы строение и функции эндоплазматической сети?
4. Каковы строение и функции митохондрий?
5. О чем свидетельствует сходство клеток растений, грибов и животных? Приведите примеры.
6. О чем свидетельствуют различия между клетками представителей различных царств природы? Приведите примеры.
7. Выпишите основные положения клеточной теории. Отметьте, какое из положений можно обосновать проведенной работой.
8. Каковы функции основных органоидов растительной клетки?
Лабораторная работа № 4
«Зависимость скорости взаимодействия соляной кислоты с металлами от их природы. Зависимость скорости взаимодействия цинка с соляной кислотой от её концентрации. Зависимость скорости взаимодействия оксида меди (II) с серной кислотой от температуры»
Цель работы
провести реакции, которые протекают с различной скоростью;
исследовать факторы влияющие на скорость химических реакций;
отработать навыки экспериментальной работы, соблюдая правила техники безопасности при работе в кабинете химии;
отработать навыки составления уравнений реакций.
Оборудование и реактивы: штатив с пробирками – 4 шт., нагревательный прибор – спиртовка или сухое горючее, спички, держатель для пробирок, Соляная кислота (10% и 70%), цинк, медная проволока, оксида меди (II), серная кислота (20%).
Краткие теоретические сведения
С![]() корость химической реакции - изменением концентрации реагирующих или образующихся веществ в единицу времени.
корость химической реакции - изменением концентрации реагирующих или образующихся веществ в единицу времени.
С – молярная концентрация, t – время

| Задание: | Опыт 1. Все опыты проводим капельным методом (по 3 капли каждого реактива)!!! Налейте в две пробирки соляную и уксусную кислоты. Одновременно в каждую пробирку добавьте кусочек цинка. В какой пробирке реакция протекает быстрее? Почему? Составьте УХР. Опыт 2. В 2 пробирки налейте уксусной кислоты и добавьте одновременно несколько гранулу цинка. Одну пробирку нагрейте. В какой из пробирок реакция идет быстрее? Как влияет температура на скорость реакции? Составьте УХР. Опыт 3. В 1 пробирку налейте раствор НСl. Во 2 пробирку концентрированной НСl. Одновременно в каждую пробирку добавьте гранулу цинка. В какой пробирке реакция идет быстрее? Как влияет концентрация реагирующих веществ на скорость реакции? Почему? Составьте УХР. Опыт 4. В 2 пробирки налить раствор медного купороса. Одновременно в каждую пробирку добавьте гранулу алюминия. В первую пробирку добавить несколько кристаллов хлорида натрия. Что наблюдаете? Составьте УХР. Опыт 5. Налейте в 2 пробирки уксусной кислоты. Одновременно в каждую пробирку добавьте в 1 пробирку кусочек мела, а во 2 пробирку порошок мела. Как зависит скорость реакции от площади соприкосновения веществ? Составьте УХР. 11. Сделайте вывод о проделанной работе. |
| Содержание отчета: | Составьте отчёт в форме таблицы
1. Номер опыта, его название и цели, материальное обеспечение 2. Что делали? – записывается кратко, вместо словесного описания последовательности действий используется рисунок. 3. Наблюдения – рисунок или схема поясняются обозначениями: - образование осадка ↓ - цвет осадка, и его характер (мучнистость, творожистость, студенистый) - Выделение газа ↑; указать цвет, запах, как горит (яркость пламени) 4. Уравнения реакции – записывается уравнение реакции 5. Выводы по проделанной работе |
Методические указания по выполнению работы:
Повторите материал по данной теме по конспекту или учебнику
Оформите отчет по работе (заполните таблицу, номер работы, название опыта, кратко описать что делали?, вместо словесного описания последовательности действий используется рисунок.; в наблюдениях - рисунок или схема; химизм процесса в виде уравнения реакции; вывод)
2. Подготовьтесь к защите работы
Тематика контрольных вопросов:
1.От чего зависит скорость химической реакции между металлом и серой?
2.Как называется реакция в присутствии катализатора?
Лабораторная работа № 5
Ознакомление со структурами серого и белого чугуна. Распознавание руд железа
Цель работы: 1. Ознакомиться со структурами серого и белого чугуна. Научиться распознавать руды железа.
Оборудование и реактивы: образцы серого и белого чугуна, образцы железных руд — гематита, лимонита и магнетит
Краткие теоретические сведения
Чугун — сплав на основе железа, содержащий от 2 до 4,5% углерода, а также марганец, кремний, фосфор и серу. Чугун значительно тверже железа, обычно он очень хрупкий, не куется, а при ударе разбивается. Этот сплав применяется для изготовления различных массивных деталей методом литья, так называемый литейный чугун и для переработки в сталь — передельный чугун.В зависимости от состояния углерода в сплаве различают серый и белый чугун.
Белые чугуны образуются при быстром охлаждении. В своей структуре они содержат большое количество цементита, обладающего высокой твердостью, прочностью, хрупкостью и имеющего белый цвет, чем и обусловлен цвет и название белых чугунов. Из-за большого количества цементита в своей структуре белые чугуны обладают высокой твердостью, износостойкостью, хрупкостью и поддаются обработке резанием только сверхтвердыми сплавами.
Серые чугуны образуются только при малых скоростях охлаждения в узком интервале температур, когда мала степень переохлаждения жидкой фазы. В этих условиях весь углерод или его большая часть графитизируется в виде пластинчатого графита, а содержание углерода в виде цементита составляет не более 0,8 %. Графитизация чугуна и ее полнота зависит от скорости охлаждения, химического состава и наличия центров графитизации.
| Вид | Состав | Свойства | Применение |
| Серый чугун | Содержит 1,7—4,3% С, 1,25—4,0% $i и до 1,5% Мп. Из-за большого содержания кремния снижается растворимость углерода, поэтому углерод находится в свободном состоянии в виде графита | Сравнительно мягкий и поддающийся механичеcкой обработке материал. Свобод- ный углерод придает чугуну вязкость | Производство литых деталей (шестерни, колеса, трубы и т. д.) |
| Белый чугун | Содержит 1,7—4,3% С, более 4% Мп, но очень мало кремния. Углерод в основном содержится в виде цементита — карбида железа Fе3С | Твердый и хрупкий материал. Эти свойства придает цементит, который обладает большой твердостью | Переработка в сталь |
Сталь— сплав на основе железа, содержащий менее 2% углерода. По химическому составу стали разделяют на два основных вида: углеродистая и легированная.
Углеродистая сталь представляет собой сплав железа главным образом с углеродом, но, в отличие от чугуна, содержание в ней углерода, а также Мп, Si, Р и S гораздо меньше. Взависимости от количества углерода стали подразделяют на мягкие (содержание углерода не превышает 0,3%), средней твердости (углерода несколько больше, чем в мягких) и твердые (углерода может быть до 2%). Из мягкой и средней твердости стали делают детали машин, трубы, болты, гвозди, скрепки , а из твердой — различные инструменты.
Легированная сталь — это тоже сплав железа с углеродом, только в него введены еще специальные, легирующие добавки: хром, никель, вольфрам, молибден, ванадий и др.
Легирующие добавки придают сплаву особые качества. Так, хромоникелевые стали очень пластичные, прочные, жаростойкие, кислотоупорные, устойчивые против коррозии (ржавления). Они применяются в строительстве (например, облицовка колонн станции «Маяковская» московского метро выполнена из хромоникелевой стали), а также для изготовления нержавеющих предметов домашнего обихода (ножей, вилок, ложек), всевозможных медицинских и других инструментов. Хромомолибденовые и хромованадиевые стали очень твердые, прочные и жаростойкие. Они используются для изготовления трубопроводов, компрессоров, двигателей и многих других деталей машин современной техники.Хромовольфрамовые стали сохраняют большую твердость при очень высоких температурах. Они служат конструкционным материалом для быстрорежущих инструментов.
Значительная химическая активность металлов (взаимодействие с кислородом воздуха, другими неметаллами, водой, растворами солей, кислотами) приводит к тому, что в земной коре они встречаются главным образом в виде соединений: оксидов, сульфидов, сульфатов, хлоридов, карбонатов и т. д.
Всвободном виде встречаются металлы, расположенные в ряду напряжений правее водорода (Аg, Нg, Рt, Аu, Сu),хотя гораздо чаще медь и ртуть в природе можно встретить в виде соединений.Металлы встречаются в природе как в свободном состоянии (самородные металлы), так и, главным образом, в виде химических соединений.
В виде самородных металлов находятся наименее активные металлы. Типичными их представителями являются золото и платина. Серебро, медь, ртуть, олово могут находиться в природе как в самородном состоянии, так и в виде соединений, все остальные металлы (стоящие в ряду стандартных электродных потенциалов до олова) — только в виде соединений с другими элементами.Минералы и горные породы, содержащие металлы и их соединения, из которых выделение чистых металлов технически возможно и экономически целесообразно,называют рудами.Минералы и горные породы, содержащие металлы или их соединения и пригодные для промышленного получения металлов, называются рудами.Важнейшими рудами металлов являются их оксиды и соли (сульфиды, карбонаты и др.). Если руды содержат соединения двух или нескольких металлов, то они называются полиметаллическимирудами(например, медноцинковые, свицово-серебряные и др.).
Получение металлов из руд — задача металлургии.
| Задание: | Опыт 1. Ознакомление со структурами серого и белого чугуна. Внимательно рассмотрите внешний вид и сколы образцов серого и белого чугуна. Эти образцы имеют зернистую поверхность и многочисленные плоские грани на сколе. В сером чугуне углерод присутствует преимущественно в виде графита. Через лупу можно заметить темные прожилки. Графит придает чугуну характерный цвет и хрупкость. В белом чугуне углерод присутствует преимущественно в виде соединения с железом — цементита Fe3C. Цементит придает белому чугуну твердость и хрупкость. Наблюдаем за тем, что происходит, отвечаем на вопрос: где применяют серый, а где белый чугун? Опыт2. Распознавание железных руд. Возьмите образцы трех типов железных руд — гематита, лимонита и магнетита. Проведите ими по стенке фарфоровой ступки или обратной стороне белой кафельной плитки. По цвету остающейся полосы можно идентифицировать руду. Гематит оставляет на фарфоре полосу бурого цвета, лимонит — желтого, магнетит — черного.
Наблюдаем за тем, что происходит, результаты оформляем в таблицу Сделайте вывод о проделанной работе. |
| Содержание отчета: | Составьте отчёт в форме таблицы
1. Номер опыта, его название и цели, материальное обеспечение 2. Что делали? – записывается кратко, вместо словесного описания последовательности действий используется рисунок. 3. Наблюдения – рисунок или схема поясняются обозначениями: - образование осадка ↓ - цвет осадка, и его характер (мучнистость, творожистость, студенистый) - Выделение газа ↑; указать цвет, запах, как горит (яркость пламени) 4. Уравнения реакции – записывается уравнение реакции 5. Выводы по проделанной работе |
Методические указания по выполнению работы:
Повторите материал по данной теме по конспекту или учебнику
Оформите отчет по работе (заполните таблицу, номер работы, название опыта, кратко описать что делали?, вместо словесного описания последовательности действий используется рисунок.; в наблюдениях - рисунок или схема; химизм процесса в виде уравнения реакции; вывод)
2. Подготовьтесь к защите работы
Контрольные вопросы
Железо сгорает в кислороде, образуя железную окалину, имеющую состав Fe3O4.
Запишите процесс сгорания железа в виде химического уравнения реакции.
Лабораторная работа № 6
Изготовление моделей молекул некоторых органических и неорганических веществ
Цель работы: Развитие навыков пространственного изображения молекул кислорода, воды, углекислого газа ,метана, этана, этена, этина, бензола.
Оборудование: шаростержневые модели, транспортир. Методические рекомендации по выполнению лабораторных и практических работ по химии
Общие теоретические сведения:
В предельных углеводородах (алканы) все углеродные атомы находятся в состоянии гибридизации sp3, и образуют одинарные σ – связи. Угол связи составляет 109,28о. Форма молекул правильный тетраэдр.
В молекулах алкенов углеродные атомы находятся в состоянии гибридизации sp2, и образуют двойные связи σ и π – связи. Угол связи σ составляет 120о, а π – связь распологается перпендикулярно связи σ. Форма молекул правильный треугольник.
В молекулах алкинов углеродные атомы находятся в состоянии гибридизации sp , и образуют тройные связи одну σ и две π – связи. Угол связи σ составляет 180о, а две π – связи распологаются перпендикулярно друг друга. Форма молекул линейная (плоская).
В молекуле бензола C6H6 шесть атомов углерода связаны σ – связью. Угол связи составляет 120о. Состояние гибридизации sp2. В молекуле образуется
6 π – связь, которая принадлежит шести атомам углерода.
Для пространственного изображения молекул органических веществ важно знать, к какому классу веществ относится соединение, угол связи, форму молекул.
Например: Метан (СH4) относится к классу алканов. Атомы находятся в состоянии гибридизации sp3, значит угол связи 109,28о, форма молекулы тетраэдр, между атомами одинарная σ – связь. Для построения молекулы шаростержневым способом нужно заготовить 4 шара из пластилина. Один шар (атом углерода) большего размера и черного цвета, а три атома (водорода) одинакового размера красного цвета. Соединить шары металическими стержнями под углом 109,28о.
Полусферическая модель атома изготавливается также только шары соединяются методом вдавливания в друг друга.
| Задание: | Опыт 1. Изготовление моделей молекул органических веществ СH4, C2H6, C2H4,C2H2, C6H6. Изготовление шаростержневых моделей молекул. Шаростержневые модели изготавливаются из пластилина и металлических стержней. При изготовлении молекул необходимо знать угол связи и ее кратность. Атом химического элемента представляется в виде шара. Атом углерода в виде шара изготавливается большего размера, чем атомы водорода и из другого цвета пластилина. Химическая связь изображается металлическими стержнями. Угол химической связи измеряется траспортиром. Опыт 2. Изготовление полусферических моделей Полусферические модели изготавливаются из пластилина. Сначала заготавливаются шары для атомов углерода и водорода, затем под определенным углом атомы в виде шаров соединяются друг с другом методом вдавливания. Получаются полусферы атомов. Заполните таблицу. Зарисуйте молекулы органических веществ.
2. Составьте (оформите) отчет по работе |
Методические указания по выполнению работы:
1. Повторите материал по данной теме по конспекту или учебнику
2. Оформите отчет по работе (заполните таблицу, номер работы, ее название и цели, материальное обеспечение)
3. Выпишите исходные данные
4. Подготовьтесь к защите работы
Тематика контрольных вопросов:
1. Какие бывают органические соединения по строению углеводородного скелета?
2. Какие бывают органические соединения по наличию функциональных групп?
3. Какие вещества называются гомологами?
4. Какие бывают пространственные формы молекул органических веществ?
5. Какой процесс называется гибридизацией?
7. Дайте понятие σ и π связи?
Лабораторная работа № 7
Обнаружение углерода и водорода в органическом соединении. Обнаружение галогенов (проба Бейльштейна)
Цель работы: Научиться экспериментально доказывать качественный состав углеводородов и их галогенопроизводных, обосновывать данные эксперимента.
Оборудование и реактивы: конспект лекций, методические указания по выполнению работы, инструкции по технике безопасности; Шпатели (2 шт.), кусочек ваты, U- и Г-образные газоотводные трубки, газоотводная трубка-капилляр, спиртовка, спички, штатив железный с лотком, широкогорлая пробирка, пипетка, промывочная склянка, штатив с пробирками, щипцы тигельные, фильтровальная бумага, фарфоровая чашка, синее стекло (Со), санитарная склянка, стакан на 50 мл; лакмусовая бумага (фиолет.), С2Н5ОН (3–4 мл), известковая вода Са(ОН)2 или баритовая вода Ba(OH)2, парафин (измельченный), сахароза С12Н22О11, CuO (порошок), CuSO4 (безвод.), HNO3 (конц.), хлороформ СНСl3 или четыреххлористый углерод CCl4, Na металлический (2–3 горошины, свежеочищенный), AgNO3 (р-р, ![]() = 1%), Cu (тонкая проволока, на конце скрученная в спираль).
= 1%), Cu (тонкая проволока, на конце скрученная в спираль).
Общие теоретические сведения: Качественный анализ органического вещества сводится к определению содержания в нем тех или иных элементов. После разрушения молекулы ее атомы образуют характерные минеральные соединения, открываемые обычными качественными реакциями.
![]() О наличии углерода можно судить по обугливанию органических веществ при нагревании. Более общим методом определения С и Н является окисление органического вещества оксидом меди(II) (сжигание с СuO). При этом углерод окисляется до СО2 (обнаружение известковой Са(ОН)2 или баритовой Ba(OH)2 водой по помутнению, а водород образует воду, которая с безводным сульфатом меди(II) дает кристаллогидрат CuSO4•5H2O голубого цвета).
О наличии углерода можно судить по обугливанию органических веществ при нагревании. Более общим методом определения С и Н является окисление органического вещества оксидом меди(II) (сжигание с СuO). При этом углерод окисляется до СО2 (обнаружение известковой Са(ОН)2 или баритовой Ba(OH)2 водой по помутнению, а водород образует воду, которая с безводным сульфатом меди(II) дает кристаллогидрат CuSO4•5H2O голубого цвета).
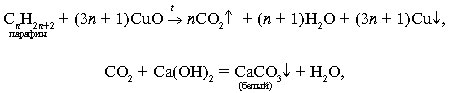
![]()
![]() Определение галогенов производят по Бейльштейну .
Определение галогенов производят по Бейльштейну .
Проба Бейльштейна. При нагревании с СuO галогенсодержащие вещества сгорают с образованием летучих соединений меди с галогеном, окрашивающих пламя в сине-зеленый цвет.
| Задание: | Опыт 1. Соберите прибор как показано на рисунке Смесь 1-2 г оксида меди (II) и 0,2г парафина хорошо перемешайте и поместите на дно пробирки. Сверху насыпьте ещё немного оксида меди (II). В верхнюю часть пробирки введите в виде пробки небольшой кусочек ваты и насыпьте на неё тонкий слой белого порошка безводного сульфата меди (II). Закройте пробирку пробкой с газоотводной трубкой. При этом конец трубки должен почти упираться в комочек ваты с сульфатом меди (II). Нижний конец газоотводной трубки должен быть погружен в пробирку с баритовой водой (раствор гидроксида бария) или известковой воды (раствор гидроксида кальция). Нагрейте пробирку в пламени горелки. Если пробка плотно закрывает пробирку, то через несколько секунд из газоотводной трубки начнут выходить пузырьки газа. Как только баритовая вода помутнеет, пробирку с ней следует удалить и продолжать нагревание, пока пары воды не ДОС тигнут белого порошка сульфата меди (II) и не вызовут его посинения. После изменения окраски сульфата меди (II) следует прекратить нагревание. Опыт 2. Для проведения опыта требуется медная проволока длиной около 10 см, загнутая на конце петлёй и вставленная другим концом в небольшую пробку. Как показано на рисунке Держа за пробку, прокалите петлю проволоки до исчезновения посторонней окраски пламени. Остывшую петлю, покрывшуюся черным налётом оксида меди (II), опустите в пробирку с хлороформом, затем смоченную веществом петлю вновь внесите в пламя горелки. Немедленно появляется характерная зеленовато – голубая окраска пламени, так кА образующиеся при сгорании летучие галогениды меди окрашивают пламя горелки |
| Содержание отчета: | Составьте отчёт в форме таблицы
1. Номер опыта, его название и цели, материальное обеспечение 2. Что делали? – записывается кратко, вместо словесного описания последовательности действий используется рисунок. 3. Наблюдения – рисунок или схема поясняются обозначениями: - образование осадка ↓ - цвет осадка, и его характер (мучнистость, творожистость, студенистый) - Выделение газа ↑; указать цвет, запах, как горит (яркость пламени) 4. Уравнения реакции – записывается уравнение реакции 5. Выводы по проделанной работе |
Методические указания по выполнению работы:
1.Повторите материал по данной теме по конспекту или учебнику
Оформите отчет по работе (заполните таблицу, номер работы, название опыта, кратко описать что делали?, вместо словесного описания последовательности действий используется рисунок.; в наблюдениях - рисунок или схема; химизм процесса в виде уравнения реакции; вывод)
2. Подготовьтесь к защите работы
Тематика контрольных вопросов:
1. Какое вещество, в опыте 1 является окислителем и какое восстановителем?
2. Какие продукты реакции подтверждают наличие углерода и водорода в составе исследуемого углеводорода?
3. Как проверяют на герметичность прибор, в котором будет получен газ?
4. Для определения хлора в галогензамещённом углеводороде прокаливают медную проволоку (спираль), берут с её помощью пробу исследуемого вещества и вносят в пламя. Ярко – зелёное окрашивание свидетельствует об образовании хлорида меди (II), который в расплаве образует ионы меди Сu2+
Именно эти ионы окрашивают пламя в зелёный цвет.
Назовите ионы других металлов, которые также дают характерное окрашивание пламени.
5. Сделайте рисунок прибора, который можно использовать для получения и сбора метана в лабораторных условиях. Используйте детали: пробирки, U- образная трубка, круглодонная колба, трубки стеклянные (изогнутые под углом и прямые), пробки с отверстиями и без них.
Лабораторная работа № 8
Получение этилена дегидратацией этилового спирта. Взаимодействие этилена с бромной водой, раствором перманганата калия. Сравнение пламени этилена с пламенем предельных углеводородов ( пропан -бутановой смеси)
Цель работы: научиться получать в лабораторных условиях этилен и проводить качественные реакции на непредельные углеводороды этиленового ряда; совершенствовать умения получать газообразные вещества в простейших приборах, соблюдая правила техники безопасности
Оборудование и реактивы: конспект лекций, методические указания по выполнению работы, инструкции по технике безопасности; штатив, спиртовка, пробирка с газоотводной трубкой, серная кислота (конц), этиловый спирт, кипелка, пробирки 2 шт, бромная вода, раствор перманганата калия, спички
Общие теоретические сведения: Углеводороды, содержащие в углеродной цепи одну двойную углерод – углеродную связь называют алкенами (этиленовыми, олефинами). Простейшим представителем является этилен СН2 = СН2. В молекуле этилена атомы углерода имеют иной тип гибридизации. Гибридизации подвержены одна s и две p- орбитали; третья p- орбиталь остаётся без изменения. Такое состояние атома углерода называют sp2 – гибридизацией. Каждый атом углерода в молекуле этилена за счёт перекрывания sp2 орбиталей образует три υ- связи: с двумя атомами водорода и соседним атомом углерода. При параллельном расположении осей две p- орбиталей двух атомов происходит их боковое перекрывание с образованием второй углерод – углеродной связи π- типа. Π – связь является менее прочной и более доступной для атаки реагентов.
В отличие от предельных углеводородов алкены встречаются в природе нечасто. Промышленные способы получения этиленовых углеводородов основаны на превращении алканов в алкены. В лабораторных условиях для получения алкенов используют реакции дегидратации спиртов – нагревании спиртов в присутствии концентрированной серной кислоты до температуры выше 180 0 С, происходит внутримолекулярное отщепление воды с образованием этиленового углеводорода.
Н2SO4, t
СН3 – СН2 –ОН → СН2 = СН2 + H2О
Этиловый спирт этилен
Химические свойства алкенов:
1) реакции присоединения
2) реакции окисления
а) горение – алкены горят с образованием углекислого газа и воды:
С2Н4 + 3О2 → 2СО2 + 2Н2О
За счёт большей массовой доли углерода в алкенах по сравнению с алканами пламя этиленовых углеводородов имеет красноватый оттенок, оно более светящееся.
б) окисление перманганатом калия – пропускание газообразного алкена через водный раствор перманганата калия при комнатной температуре приводит к обесцвечиванию раствора:
СН2 = СН2 +[О] + Н2О → НОСН2 - СН2НО
Этилен этиленгликоль
Эта реакция является качественной на двойную углерод – углеродную связь.
| Задание: | Опыт 1. Получение этилена Собрать прибор как показано на рисунке Приготовить пробирки с бромной водой и с раствором перманганата калия. Налейте в пробирку – реактор 1,5 – 2 см3 смеси этилового спирта с концентрированной серной кислотой (3:1). Поместите в эту пробирку немного речного песка, чтобы смесь разогревалась равномерно и не разбрызгивалась при кипении. Прогрейте сначала всю пробирку – реактор, затем нагревайте пробирку у донышка Опыт 2. Пропустите образующийся газ (этилен) через бромную воду, сравните с контрольной пробиркой. Запишите ваши наблюдения, уравнение химической реакции. Пропустите образующийся газ (этилен) через раствор перманганата калия, сравните с контрольной пробиркой. Запишите ваши наблюдения, уравнение химической реакции. Опыт 3. Горение этилена. Поверните газоотводную трубку слегка вверх, не вытаскивая пробки из пробирки. Подожгите выделяющийся газ при помощи горящей лучинки. Сравните пламя этилена с пламенем газовой горелки. Запишите ваши наблюдения, уравнение химической реакции. Составьте (оформите) отчет по работе Заполнить таблицу |
| Содержание отчета: |
5. Подготовьтесь к защите работы 1. Номер опыта, его название и цели, материальное обеспечение 2. Что делали? – записывается кратко, вместо словесного описания последовательности действий используется рисунок. 3. Наблюдения – рисунок или схема поясняются обозначениями: - образование осадка ↓ - цвет осадка, и его характер (мучнистость, творожистость, студенистый) - Выделение газа ↑; указать цвет, запах, как горит (яркость пламени) 4. Уравнения реакции – записывается уравнение реакции 5. Выводы по проделанной работе |
Методические указания по выполнению работы:
Повторите материал по данной теме по конспекту или учебнику
Оформите отчет по работе (заполните таблицу, номер работы, название опыта, кратко описать что делали?, вместо словесного описания последовательности действий используется рисунок.; в наблюдениях - рисунок или схема; химизм процесса в виде уравнения реакции; вывод)
2. Подготовьтесь к защите работы
Необходимые формулы:
H2SO4; C2H5OH; HBr; KMnO4
Тематика контрольных вопросов:
1. Какова роль серной кислоты в реакции получения этилена?
2. Какими опытами можно подтвердить, что в состав этилена входят атомы углерода и водорода?
3. Как опытным путём отличить этилен от этана, если газы находятся в цилиндрах без этикеток?
4. Даны две органические кислоты – уксусная и олеиновая. Как эксперимен
тально доказать, что одна из кислот непредельная (имеет двойную связь)?
Лабораторная работа № 9
Ознакомление с коллекцией каучуков и образцами изделий из резины
Цель работы: Познакомится с образцами пластмасс и каучуков и их применением.
Оборудование: коллекция с образцами каучуков, кусочки резины. Образцы пластмасс (полиэтилен, полихлорвинил, ,полистирол).
Краткие теоретические сведения
1.Натуральный каучук – аморфное, способное кристаллизоваться твердое тело. Природный необработанный каучук – белый или бесцветный углеводород. Он не набухает и не растворяется в воде, спирте, ацетоне и ряде других жидкостей.
Каучук природный и синтетический. Резина.
Каучуками - называют высокомолекулярные материалы, проявляющие при нормальных условиях высокоэластичные и отчасти пластические свойства.
Каучук имеет огромное нороднохозяйственное значение.
Различают 2 вида каучуков: натуральный и синтетические.
Натуральный каучук – упругая масса, получаемая из млечного сока каучуконосных растений (гевеи). По химическому строению натуральный каучук является полимером изопрена (С5Н8)n.
Натуральный каучук имеет стереорегулярное строение: звенья изопрена в молекуле каучука всегда соединены однотипно за счет 1-го и 4-го атомов углерода. Натуральный каучук высокой реакционной способностью, легко взаимодействует с серой, окисляется, хорошо растворяется в бензоле, бензине; обладает высокой прочностью при растяжении, морозостойкостью, хорошей эластичностью и износостойкость. Но он не достаточно пластичен и в случае длительного хранения при температуре 100С и ниже кристаллизуется, вязкость его повышается.Применяется для изготовления технических изделий, резиновых изделий, резинового клея, эбонита.
Синтетические каучуки
Бутадиеновый (дивинильный).
Вспоминаем получение. В 1932 на основе работ академика С.В. Лебедева в нашей стране осуществили промышленное производство (катализатор – Na металлический).
nCH2= СH – CH = CH2 → ….- CH2 – СH = CH – CH2 - CH2 – CH = CH - …
Синтетический каучук бутадиеновый благодаря наличию двойных связей в боковой цепи присоединяет серу быстрее, чем натуральный каучук, а потому вулканизация протекает быстрее.Применяется для изготовления прокладок к машинам и аппаратам в пищевой промышленности и медицине. В смеси с другими каучуками в производстве шин.
Изопреновый каучук (СКИ-3) имеет то же строение, что и природный, обладает рядом преимуществ (хорошая водостойкость, высокие диэлектрические показатели).
Полихлоропреновый каучук (С4Н5Сl)n
Молекулярная масса 150000 ÷ 300000. Хлор придает стойкость к действию химических реактивов, света, тепла. Практически не горит, обладает хорошей клеящей способностью, используется в производстве различных марок клея. Бутадиенстирольный каучук (СКС) получают путем сополимеризации бутадиен 1,3 и стирола.
Бутадиен стирол. Применяется в производстве легковых шин, обуви, а с небольшим содержанием стирола для малостойких изделий.
Резина – высокоэластичное, прочное соединение, но менее пластичное, чем каучук.
Состоит из полимерной основы (каучука) и различных добавок.
Вулканизация – переработка каучуков в резину. Вулканизирующим агентом чаще всего бывает сера. За счет этих агентов при вулканизации происходит «сшивание» макромолекул каучука поперечными связями и образуется пространственная вулканизация трехмерная сетка.
| Задание: | Задание 1. Ознакомиться с различными видами каучуков; Результаты занести в таблицу №2
2. Составьте (оформите) отчет по работе Заполнить таблицу |
| Содержание отчета: |
3. Подготовьтесь к защите работы 1. Номер опыта , его название и цели, материальное обеспечение 2. Что делали? – записывается кратко, вместо словесного описания последовательности действий используется рисунок. 3. Наблюдения – рисунок ил и схема поясняются обозначениями: - образование осадка ↓ - цвет осадка, и его характер (мучнистость, творожистость, студенистый) - Выделение газа ↑; указать цвет, запах, как горит (яркость пламени) 4. Уравнения реакции – записывается уравнение реакции 5. Выводы по проделанной работе |
Методические указания по выполнению работы:
1. Повторите материал по данной теме по конспекту или учебнику
2. Оформите отчет по работе (заполните таблицу, номер работы, ее название и цели, материальное обеспечение)
3. Выпишите исходные данные
4. Подготовьтесь к защите работы
Контрольные вопросы
1.Какие углеводороды входят в состав каучуков?
2.какие существуют методы получения каучуков?
3.к каким органическим соединениям относят каучуки?
4.на какие группы делятся каучуки?
5. как получают резины?
6. что такое эбонит?
Лабораторная работа №10
Ознакомление с коллекцией образцов нефти и продуктов её переработки. Определение наличия непредельных углеводородов в бензине и керосине. Растворимость различных нефтепродуктов (бензина, керосина, дизельного топлива, вазелина, парафина) друг в друге
Цель работы
обобщить и систематизировать знания об углеводородах;
ознакомиться с образцами нефти, гипотезами происхождения нефти, составом и свойствами;
изучить способы получения и областях использования углеводородов, включая экологические аспекты
Оборудование: коллекции: «Нефть и продукты ее переработки», «Топливо», «Уголь и продукты его переработки»
Краткие теоретические сведения
Нефть (от перс. neft) - горючая маслянистая жидкость со специфическим запахом, распространенная в осадочной оболочке Земли и являющаяся важнейшим полезным ископаемым.
Залежи нефти находятся в недрах Земли на разной глубине, где нефть заполняет свободное пространство между некоторыми породами. Если она находится под давлением газов, то поднимается по скважине на поверхность Земли. По запасам нефти наша страна занимает одно из ведущих мест в мире.
Физические свойства.
Нефть – маслянистая жидкость от светло-бурого до черного цвета с характерным запахом. Она немного легче воды и практически в ней не растворяется. Так как нефть – смесь различных углеводородов, то у нее нет определенной температуры кипения.
Нефть сильно варьирует по цвету (от светло-коричневой, почти бесцветной, до темно-бурой, почти черной) и по плотности (от легкой 0,65-0,70 г/см 3 , до тяжелой 0,98-1,05 г/см 3 ).
Начало кипения нефти обычно выше 28 0 С. температура застывания колеблется от +30 0 до –60 0 С и зависит в основном от содержания парафина (чем его больше, тем температура застывания выше). Теплоемкость нефти 1,7-2,1 кДж/кг; теплота сгорания 43,7-46,2 мДж/кг.
Вязкость изменяется в широких пределах и зависит от химического и фракционного состава нефти и смолистости (содержания в ней асфальтосмолистых веществ). Температура вспышки нефти колеблется от –35 до 1200С в зависимости от фракционного состава и давления насыщенных паров. Нефть растворима в органических растворителях, в воде при обычных условиях практически нерастворима, но может образовывать с ней стойкие эмульсии.
| Классификация нефти. | |
| По содержанию серы: Малосернистые (до 0,5 % S) и Сернистые (0,5-2 % S) | По потенциальному содержанию масел: М1 – не меньше 25 % и М2 – меньше 25 %. |
| Высокосернистые (св. 2 % S). По потенциальному содержанию фракций, выкипающих до 3500С: a) Т1 – тип нефти, в которой указанных фракций не меньше 45 %, b) Т2 – 30-44,9 %, c) Т3 – меньше 30 %. | По качеству масел: Подгруппа И1 – с индексом вязкости масел больше 85 Подгруппа И2 – с индексом 40-85. |
Состав нефти
В зависимости от месторождения нефть имеет различный качественный и количественный состав. Так, например, бакинская нефть богата циклопарафинами и сравнительно бедна предельными углеводородами. Значительно больше предельных углеводородов в грозненской и ферганской нефти. Пермская нефть содержит ароматические углеводороды.
Представляя собой жидкость, более легкую, чем вода, нефть разных мест, иногда даже и соседних, различна по многим свойствам: цвету, плотности, летучести, температуры кипения... Однако любая нефть это жидкость почти нерастворимая в воде и по элементарному составу содержащая преимущественно углеводороды с подмесью небольшого количества кислородных, сернистых, азотистых и минеральных соединений, что видно не только по элементарному составу, но и по всем свойствам углеводородов. В бакинской (апшеронской) нефти Марковников и Оглоблин нашли от 86,6 до 87,0% углерода и от 13,1 до 13,4% водорода.
Нефть и способы ее переработки
Истоки современных представлений о происхождении нефти возникли в XVIII – начале XIX века. М. В. Ломоносов заложил гипотезы органического происхождения нефти, объясняя ее образование воздействием “подземного огня” на “окаменелые уголья”, в результате чего, по его мнению, образовывались асфальты, нефти и “каменные масла”. Идея о минеральном происхождении нефти впервые была высказана А. Гумбольдтом в 1805 году.
Добыча нефти
Почти вся добываемая в мире нефть, извлекается посредством буровых скважин, закрепленных стальными трубами высокого давления. Для подъема нефти и сопутствующих ей газа и воды на поверхность скважина имеет герметичную систему подъемных труб, механизмов и арматуры, рассчитанную на работу с давлениями, соизмеримыми с пластовыми. Добыче нефти при помощи буровых скважин предшествовали примитивные способы: сбор ее на поверхности водоемов, обработка песчаника или известняка, пропитанного нефтью, посредством колодцев.
Очистка нефти
Первый завод по очистке нефти был построен в России в 1745 г., в период правления Елизаветы Петровны, на Ухтинском нефтяном промысле. В Петербурге и в Москве тогда пользовались свечами, а в малых городах – лучинами. Но уже тогда во многих церквях горели неугасаемые лампады. В них наливалось гарное масло, которое было не чем иным, как смесью очищенной нефти с растительным маслом. Купец Набатов был единственным поставщиком очищенной нефти для соборов и монастырей.
В конце XVIII столетия была изобретена лампа. С появлением ламп возрос спрос на керосин.
Очистка нефти – удаление из нефтепродуктов нежелательных компонентов, отрицательно влияющих на эксплуатационные свойства топлив и масел.
Химическая очистка производится путем воздействия различных реагентов на удаляемые компоненты очищаемых продуктов. Наиболее простым способом является очистка 92-92% серной кислотой и олеумом, применяемая для удаления непредельных и ароматических углеводородов.
При адсорбционной очистке из нефтепродуктов удаляются непредельные углеводороды, смолы, кислоты и др. адсорбционную очистку осуществляют при контактировании нагретого воздуха с адсорбентами или фильтрацией продукта через зерна адсорбента.
Каталитическая очистка – гидрогенизация в мягких условиях, применяемая для удаления сернистых и азотистых соединений.
Перегонка нефти
Братья Дубинины впервые создали устройство для перегонки нефти. С 1823 г. Дубинины стали вывозить фотоген (керосин) многими тысячами пудов из Моздока внутрь России. Завод Дубининых был очень прост: котел в печке, из котла идет труба через бочку с водой в пустую бочку. Бочка с водой – холодильник, пустая – приемник для керосина.
На современном заводе вместо котла устраивается ложная трубчатая печь. Вместо трубки для конденсации и разделения паров сооружаются огромные ректификационные колонны. А для приёма продуктов перегонки выстраиваются целые городки резервуаров.
Нефть состоит из смеси различных веществ (главным образом углеводородов) и потому не имеет определённой точки кипения. На трубчатках нефть подогревают до 300-325оС. При такой температуре более летучие вещества нефти превращаются в пар.
Печи на нефтеперегонных заводах особые. С виду они похожи на дома без окон. Выкладываются печи из лучшего огнеупорного кирпича. Внутри, вдоль и поперёк, тянутся трубы. Длина труб в печах достигает километра.
Нефтяники нашли способ перегонки нефти без разложения углеводородов.
Крекинг нефтепродуктов.
Выход бензина из нефти можно значительно увеличить (до 65-70 %) путем расщепления углеводородов с длинной цепью, содержащихся, например, в мазуте, на углеводороды с меньшей относительной молекулярной массой. Такой процесс называется крекингом (от англ. Crack- расщеплять).
Крекингом называется процесс расщепления углеводородов, содержащихся в нефти, в результате которого образуются углеводороды с меньшим числом атомов углерода в молекуле.
Крекинг изобрел русский инженер В.Г. Шухов в 1891 г. В 1913 г изобретение Шухова начали применять в Америке. В настоящее время в США 65% всех бензинов получается на крекинг - заводах.
При крекинге нефть подвергается химическим изменениям. Меняется строение углеводородов. В аппаратах крекинг – заводов происходят сложные химические реакции. Эти реакции усиливаются, когда в аппаратуру вводят катализаторы.
Термический крекинг. Расщепление молекул углеводородов протекает при более высокой температуре (470-550 0 С). Процесс протекает медленно, образуются углеводороды с неразветвленной цепью атомов углерода.
В бензине, полученном в результате термического крекинга, наряду с предельными углеводородами, содержится много непредельных углеводородов. Поэтому этот бензин обладает большей детонационной стойкостью, чем бензин прямой перегонки.
В бензине термического крекинга содержится много непредельных углеводородов, которые легко окисляются и полимеризуются. Поэтому этот бензин менее устойчив при хранении. При его сгорании могут засориться различные части двигателя. Для устранения этого вредного действия к такому бензину добавляют окислители.
Каталитический крекинг. Расщепление молекул углеводородов протекает в присутствии катализаторов и при более низкой температуре (450-500 0 С). Главное внимание уделяют бензину. Его стараются получить больше и обязательно лучшего качества. Каталитический крекинг появился именно в результате долголетней, упорной борьбы нефтяников за повышение качества бензина. По сравнению с термическим крекингом процесс протекает значительно быстрее, при этом происходит не только расщепление молекул углеводородов, но и их изомеризация, т.е. образуются углеводороды с разветвленной цепью атомов углеродов.
Бензин каталитического крекинга по сравнению с бензином термического крекинга обладает еще большей детонационной стойкостью , ибо в нем содержатся углеводороды с разветвленной цепью углеродных атомов.
В бензине каталитического крекинга непредельных углеводородов содержится меньше, и поэтому процессы окисления и полимеризации в нем не протекают. Такой бензин более устойчив при хранении.
Риформинг – (от англ. Reforming – переделывать, улучшать) промышленный процесс переработки бензиновых и лигроиновых фракций нефти с целью получения высококачественных бензинов и ароматических углеводородов. При этом молекулы углеводородов в основном не расщепляются, а преобразуются. Сырьем служит бензинолигроиновая фракция нефти.
Перспективы на будущее
В настоящее время нефтехимия дает почти четверть всей химической продукции. Нефть – ценнейшее природное ископаемое, открывшее перед человеком удивительные возможности “химического перевоплощения”. Всего производных нефти насчитывается уже около 3 тысяч.
Нефть занимает ведущее место в мировом топливно-энергетическом хозяйстве. Ее доля в общем потреблении энергоресурсов непрерывно растет. Нефть составляет основу топливно-энергетических балансов всех экономически развитых стран.
Продукты, получаемые из нефти, их применение
Из нефти выделяют разнообразные продукты, имеющие большое практическое значение. Вначале от нее отделяют растворенные углеводороды (преимущественно метан). После отгонки летучих углеводородов нефть нагревают. Первыми переходят в газообразное состояние и отгоняются углеводороды с небольшим числом атомов углерода в молекуле, имеющие относительно низкую температуру кипения. С повышением температуры смеси перегоняются углеводороды с более высокой температурой кипения. Таким образом можно собрать отдельные смеси (фракции) нефти. Чаще всего при такой перегонке получают три основные фракции, которые затем подвергаются дальнейшему разделению. Основные фракции нефти следующие:
Фракция, собираемая от 400 до 200 0С, - газолиновая фракция бензинов – содержит углеводороды от С5 Н12 до С1 Н 24 . При дальнейшей перегонке выделенной фракции получают: газолин (от 400 до 700С), бензин (от 700 до 1200 С) – авиационный, автомобильный и т.д.
Лигроиновая фракция , собираемая в пределах от 1500 до 2500 С, содержит углеводороды от С8 Н18 до С14 Н30 . Лигроин применяется как горючее для тракторов.
Керосиновая фракция включает углеводороды от С12 Н26 до С18 Н38 с температурой кипения от 1800 до 300 0С. керосин после очистки используется в качестве горючего для тракторов, реактивных самолетов и ракет.
Газойль (выше 275 0 С) – дизельное топливо.
Мазут – остаток от перегонки. Содержит углеводороды с большим числом атомов углерода (до многих десятков) в молекуле. Мазут также разделяют на фракции:
Соляровые масла – дизельное топливо,
Смазочные масла (авиатракторные, авиационные, индустриальные и др.),
Вазелин (основа для косметических средств и лекарств).
Из некоторых сортов нефти получают парафин (для производства спичек, свечей и др.). После отгонки остается гудрон . Его широко применяют в дорожном строительстве.
Задание № 1. Ознакомление с различными видами природных источников углеводородов.
Таблица № 1
| ПИУ | Природный и попутный газы | Нефть | Уголь |
| 1. Агрегатное состояние и состав | | | |
| 2. Запасы | | | |
| 3. Переработка | | | |
| 4. Применение | | | |
Задание № 2. Ознакомление с коллекцией «Нефть и продукты ее переработки»
1. Рассмотрите выданную вам коллекцию. Заполните таблицу № 2. Объясните, почему все нефтепродукты (кроме мазута) называют светлыми. Запишите формулы углеводородов, образующих фракции светлых нефтепродуктов. Какие физические процессы лежат в основе их получения?
2. Познакомьтесь со смазочными маслами, получаемыми перегонкой мазута. Какие процессы лежат в основе их получения? Таблица № 2
| Продукты НЕФТЕПЕРЕРАБОТКИ | Свойства (агр. сост., цвет, особенности) | Применение |
| 1. Газ | | |
| 2. Бензин | | |
| 3. Лигроин | | |
| 4. Керосин | | |
| 5. Мазут | | |
| 6. Гудрон | | |
Вопросы для выводов
Дать оценку экологической и экономической эффективности нефти, угля и природного газа как топлива и сырья для хим. промышленности.
Контрольные вопросы
1.какие углеводороды входят в состав нефти, какие в состав газов?
2.Каково происхождение нефти?
3. Какая из главных фракций нефти не поддается перегонке?
Лабораторная работа № 11
Изучение восстановительных свойств альдегидов: реакция «серебряного зеркала», восстановление гидроксида меди (II). Взаимодействие формальдегида с гидросульфитом натрия
Цель работы: закрепить знания о свойствах альдегидов и с помощью качественных реакций распознавать альдегиды среди органических соединений
Оборудование и реактивы: конспект лекций, методические указания по выполнению работы, инструкции по технике безопасности; штатив, спиртовка, спички, пробирки, пробиркодержатель, фарфоровая ступка с пестиком, пипетки, шпатель, химический стакан на 100 мл, раствор гидроксида натрия, раствор сульфата меди, концентрированная серная кислота, водный раствор формальдегида (формалин), аммиачный раствор
Краткие теоретические сведения: Альдегиды – это органические соединения, молекулы которых содержат карбонильную группу СОН, соединённую с атомом водорода и углеводородным радикалом.
Общая формула альдегидов имеет вид RCOH.
Физические свойства. В молекуле альдегида вследствие большой электроотрицательности атома кислорода по сравнению с углеродным атомом связь С =О сильно поляризована за счёт смещения электронной плотности π – связи к кислороду. Альдегиды – полярные вещества с избыточной электронной плотностью на атоме кислорода. Низшие члены ряда альдегидов (формальдегид, уксусный альдегид) растворимы в воде неограниченно. Их температуры кипения ниже, чем у соответствующих спиртов. Это связано с тем, что в молекулах альдегидов в отличие от спиртов нет подвижных атомов водорода и они не образуют ассоциатов за счёт водородных связей. Низшие альдегиды имеют резкий запах , у альдегидов, содержащих от четырёх до шести атомов углерода в цепи, неприятный запах, высшие альдегиды обладают цветочным запахами и применяются в парфюмерии.
Химические свойства альдегидов.
Наличие альдегидной группы в молекуле определяет характерные свойства альдегидов. Наиболее важное их свойство – лёгкое окисление.
В качестве окислителя можно использовать, например, аммиачный раствор оксида серебра (I). В упрощённом виде это процесс можно описать следующими уравнением:
t
R – COH + Аg2О → R – CОOH + 2Аg↓
При осторожном нагревании альдегида с аммиачным раствором оксида серебра (I) на стенках пробирки образуется блестящий налёт металла, поэтому этот опыт получил название реакции «серебряного зеркала». Именно она может служить для обнаружения формальдегида и его гомологов, т.е. являться качественной реакцией на альдегиды.
Окислителем альдегидов может выступать и свежеосаждённый гидроксид меди (II). Окисляя альдегид, Сu2+ восстанавливается до Сu+. Образующийся в ходе реакции гидроксид меди (I) СuОН сразу разлагается на оксид меди (I) красного цвета и воду:
t
R – COH + 2 Сu(ОН)2 → R – CОOH + Сu2О + 2Н2О
Синий творожистый красный мелкокристаллический
Эта реакция, так же как реакция «серебряного зеркала», используется для обнаружения альдегидов.
Реакции присоединения. Так как в состав карбонильной группы входит двойная связь, альдегиды способны вступать в реакции присоединения. Связь С=О полярна, на атоме углерода сосредоточен частичный положительный заряд. Альдегиды вступают в реакции нуклеофильного присоединения. Такие реакции начинаются с взаимодействия атома углерода карбонильной группы с свободной электронной парой нуклефильного реагента (Nu):
С = О + Nu → С
Затем образовавшийся анион присоединяет протон или другой катион:
С +H → С
Альдегиды вступают в реакцию нуклефильного присоединения с гидросульфитом натрия:
ОН
|
СН3 – COH + NaHSO3 → СН3 – С – SO- 3Na+
|
Н
Образующиеся при этом гидросульфитные производные альдегидов при нагревании с минеральными кислотами или содой разлагаются с образованием первоначальных карбонильных соединений.
ОН
| t
СН3 – С – SO- 3Na+ + НСl → СН3 – COH + NaСl + SO2 + Н2О
|
Н
| Задание: | Опыт 1. Реакция «серебряного зеркала» В пробирку, содержащую 1 мл формалина (водный раствор формальдегида), прибавьте несколько капель аммиачного раствора оксида серебра. Пробирку слегка нагрейте , держа её над пламенем спиртовки. На стенках пробирки постепенно образуется слой серебра в виде зеркала: НСНО + Аg2О →НСООН + 2 Аg↓ Опыт 2. Окисление формальдегида гидроксидом меди (II). В пробирку наливают 4-5 мл раствора формальдегида, 3-4 мл раствора гидроксида натрия и при встряхивании по каплям добавляют раствор сульфата меди (II) до появления нерастворяющейся взвеси. Верхнюю часть жидкости осторожно нагревают в пламени спиртовки до кипения. Наблюдают изменение окраски осадка с голубого на желтый, а затем на кирпично – красную: НСНО + 2 Сu(ОН)2 → НСООН + Сu2О↓ + 2Н2О Опыт 3. Взаимодействие уксусного альдегида с натрий гидросульфитом. Опыт проводят в двух пробирках, в которые вносят по 3 мл насыщенного раствора натрий гидросульфита. Энергично перемешивая, в одну из них прибавляют 1 мл уксусного альдегида. Реакционная смесь разогревается, её охлаждают в стакане с ледяной водой. Наблюдают, как образовываются кристаллические осадки гидросульфитных производных уксусного альдегида белого цвета. Если осадок в процессе охлаждения не образовываются, их образования вызывают трением стеклянной палочки об стенки пробирки. Кристаллы гидросульфитных производных уксусного альдегида фильтруют и убеждаются, что они не имеют запаха, характерного для уксусного альдегида и ацетона. 2. Составьте (оформите) отчет по работе Заполнить таблицу |
| Содержание отчета: |
3. Подготовьтесь к защите работы 1. Номер опыта , его название и цели, материальное обеспечение 2. Что делали? – записывается кратко, вместо словесного описания последовательности действий используется рисунок. 3. Наблюдения – рисунок или схема поясняются обозначениями: - образование осадка ↓ - цвет осадка, и его характер (мучнистость, творожистость, студенистый) - Выделение газа ↑; указать цвет, запах, как горит (яркость пламени) 4. Уравнения реакции – записывается уравнение реакции 5. Выводы по проделанной работе |
Методические указания по выполнению работы:
1. Повторите материал по данной теме по конспекту или учебнику
2. Оформите отчет по работе (заполните таблицу, номер работы, ее название и цели, материальное обеспечение)
3. Выпишите исходные данные
4. Подготовьтесь к защите работы
Тематика контрольных вопросов:
1. Сколько атомов углерода содержится в молекуле простейшего альдегида?
2. Какой объём формальдегида(н.у.) необходимо подвергнуть гидрированию для получения 16 г метилового спирта?
3. В ходе реакции «серебряного зеркала» образовалась карбоновая кислота, имеющая относительную молекулярную массу , равную 88. Какие органические вещества могли быть реагентами в этой реакции?
4. Какие вещества образуются при нагревании гидроксида меди (II) с пропаналем? Подтвердите ответ уравнениями реакции. Каковы признаки этой реакции?
Лабораторная работа № 12
Растворимость различных карбоновых кислот в воде. Взаимодействие уксусной кислоты с металлами
Цель работы: подтвердите экспериментально свойства уксусной кислоты, обусловленные наличием ионов водорода; закрепить навыки работы в малых группах, расширить кругозор учащихся, развить их мышление.
Оборудование и реактивы: конспект лекций, методические указания по выполнению работы, инструкции по технике безопасности; уксусная кислота; вода; бензойная кислота; цинк в гранулах; спиртовка, спички, пробиркодержатель, магний,
Краткие теоретические сведения: Карбоновыми кислотами называют органические соединения в молекулах которых содержится карбоксильная группа, связанная с углеводородным радикалом. Общая формула карбоновых кислот R – СООН.
Свойства органических кислот во многом похожи на свойства неорганических кислот. Только сильные электролиты среди органических кислот – большая редкость.
Органические кислоты, хотя и являются слабыми электролитами, способны к электролитической диссоциации. В водном растворе их молекулы обратимо распадаются на катионы водорода и анионы кислотного остатка. Именно наличие катионов водорода придаёт кислотам кислый вкус и специфические химические свойства:
СН3СООН ↔ Н+ + СН3СОО-
С помощью индикатора можно убедиться в наличии кислот в лимонном соке, яблоке, кислом молоке.
Карбоновые кислоты реагируют с активными металлами, основными и амфотерными оксидами, основаниями и солями. В результате этих реакций образуются соли карбоновых кислот:
2СН3СООН + Zn → (СН3СОО)2 Zn + Н2↑
В растворе образуется соль уксусной кислоты. Соли уксусной кислоты называют ацетатами.
2СН3СООН + МgО →(СН3СОО)2Мg + Н2О
СН3СООН + NaOH → СН3СООNa + Н2О
2СН3СООН + К2СО3 → 2СН3СООК + СО2↑ + Н2О
Уксусная кислота известна с глубокой древности. Она образуется при скисании вина на воздухе или под действием ферментов:
ферменты
СН3СН2 ОН + О2 → СН3СООН + Н2О
Уксусная кислота – жидкость с резким запахом; смешивается с водой в любых соотношениях. Соли уксусной кислоты хорошо растворимы в воде за исключением ацетатов серебра и ртути (I). Уксусная кислота в отличие от муравьиной кислоты устойчива к окислению.
Уксусная кислота имеет большое практическое использование в промышленности. Основная часть получаемой кислоты используется для производства искусственных волокон и пластмасс на основе целлюлозы. Уксусную кислоту используют в производстве красителей, медикаментов, ядохимикатов, органического стекла. Раствор уксусной кислоты используют в пищевой промышленности. Высшие карбоновые кислоты встречаются в виде сложных эфиров со спиртами – в воске, в виде эфиров с трёхатомным спиртом глицерином – в жирах. К числу важнейших гомологов принадлежат пальмитиновая (С15Н31СООН ) и стеариновая (С17Н35СООН) кислоты.
Производные карбоновых кислот, в которых атом водорода карбоксильной группы замещен на углеводородный радикал, называют сложными эфирами.
| Задание: | Опыт 1. Растворимость карбоновых кислот в воде. В одну пробирку прилейте 1-2 мл воды и добавьте 2-3 капли уксусной кислоты, взболтайте содержимое. В другую пробирку также прилейте 1-2 мл воды и добавьте 0,1 – 0,2 г бензойной кислоты, взболтайте содержимое. Отметьте различие в поведении уксусной и бензойной кислот. Пробирку с бензойной кислотой нагревайте на пламени газовой горелки до растворения. Охладите пробирку. Дабавьте к выпавшему осадку немного раствора гидроксида натрия. Опыт 2. Взаимодействие уксусной кислоты с металлами В пробирку прилейте 1-2 мл уксусной кислоты и добавьте 1-2 гранулы цинка. Если не наблюдается никаких изменений, пробирку слегка нагрейте. 2. Составьте (оформите) отчет по работе Заполнить таблицу |
| Содержание отчета: |
3. Подготовьтесь к защите работы 1. Номер опыта , его название и цели, материальное обеспечение 2. Что делали? – записывается кратко, вместо словесного описания последовательности действий используется рисунок. 3. Наблюдения – рисунок ил и схема поясняются обозначениями: - образование осадка ↓ - цвет осадка, и его характер (мучнистость, творожистость, студенистый) - Выделение газа ↑; указать цвет, запах, как горит (яркость пламени) 4. Уравнения реакции – записывается уравнение реакции 5. Выводы по проделанной работе |
Методические указания по выполнению работы:
1. Повторите материал по данной теме по конспекту или учебнику
2. Оформите отчет по работе (заполните таблицу, номер работы, ее название и цели, материальное обеспечение)
3. Выпишите исходные данные
4. Подготовьтесь к защите работы
Тематика контрольных вопросов:
1. Почему реакцию нейтрализации уксусной кислоты следует проводить в присутствии индикатора?
2. Напишите три уравнения химических реакций, демонстрирующих:
а) сходство химических свойств муравьиной и уксусной кислот;
б) отличие муравьиной кислоты от уксусной;
в) сходство муравьиной и уксусной кислот с неорганическими кислотами
3. Что такое «ледяная» уксусная кислота?
Лабораторная работа №13
Ознакомление с образцами сложных эфиров. Отношение сложных эфиров к воде и органическим веществам. Выведение жирного пятна с помощью сложного эфира. Растворимость жиров в воде и органических растворителях
Цель работы
познакомиться со свойствами жиров;
изучить свойства СМС и мыла, в лабораторных условиях соблюдая правила техники безопасности;
отработать навыки экспериментальной работы, соблюдая правила техники безопасности при работе в кабинете химии.
научиться проводить наблюдения и делать выводы.
Оборудование и реактивы: растительное масло, спирт, бензин, вода, раствор йодной воды, раствор мыла, СМС, гидроксид натрия, фенолфталеин, раствор хлорида кальция; штатив с пробирками, пробка, фильтровальная бумага
Краткие теоретические сведения
| ЖИРЫ Главной составной частью растительных и животных жиров являются сложные эфиры глицерина и высших жирных кислот (предельных – C15H31COOH пальмитиновой, C17H35COOH – стеариновой; непредельных C17H33COOH – олеиновой; C17H31COOH – линолевой; C17H29COOH – линоленовой). |
| |||
| Физические свойства Жиры, образованные предельными кислотами – твёрдые вещества, а непредельными – жидкие. Все жиры очень плохо растворимы в воде. | Первый синтез жира осуществил Бертло (1854 г.) при нагревании глицерина и стеариновой кислоты:
| |||
Химические свойства
| 1. Гидролиз (омыление) в кислой или в щелочной среде, или под действием ферментов: | 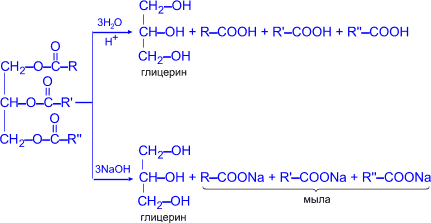 | ||||
| В щелочной среде образуются мыла – соли высших жирных кислот (натриевые – твёрдые, калиевые – жидкие). | |||||
| 2. Гидрирование (гидрогенизация) – процесс присоединения водорода к остаткам непредельных кислот, входящих в состав жира. При этом остатки непредельных кислот переходят в остатки предельных, и жидкие растительные жиры превращаются в твёрдые (маргарин). |
| ||||
3. Количественной характеристикой степени ненасыщенности жиров служит йодное число, показывающее сколько г йода может присоединиться по двойным связям к 100 г жира.
При контакте с воздухом происходит прогоркание жиров, в основе которого лежит окисление по двойным связям (образуются альдегиды и кислоты с короткой цепью) и гидролиз под действием микроорганизмов.
| Задание: | Опыт 1. Свойства жиров В три пробирки налейте по 1 мл дистиллированной воды, спирта и бензина и добавьте в них по 2–3 капли растительного масла. Встряхните содержимое пробирок. В какой жидкости жиры растворяются лучше? Несколько капель раствора жира в этиловом спирте и бензине нанесите на фильтровальную бумагу. Что наблюдаете после испарения растворителя? Опыт 2. Обнаружение ненасыщенной (двойной) связи в молекуле растительного жира. Налить в пробирку йодной воды и по каплям добавлять растительный жир. Закройте пробирку пробкой и хорошо встряхните. Запишите наблюдения. Сделать вывод о строении молекулы и свойствах жидких жиров. Опыт 3. Сравнение свойств растворов мыла и стирального порошка К 1–2 мл растворов мыла и стирального порошка в отдельных пробирках добавьте по 2 капли раствора фенолфталеина. Отметьте окраску раствора. Сделайте вывод, какое из моющих средств лучше использовать для стирки тканей, чувствительных к щелочи (например, шерстяных). В две пробирки налейте по 2 мл жесткой воды (раствора солей кальция, например хлорида кальция СаСl2). В одну пробирку добавьте по каплям раствор мыла, а в другую – раствор стирального порошка. После внесения каждой капли содержимое пробирок взбалтывайте. В каком случае приходится прибавлять больше раствора для образования устойчивой пены? Какой препарат не утрачивает своей моющей способности в жесткой воде? Почему? 2. Составьте (оформите) отчет по работе Заполнить таблицу |
| Содержание отчета: |
3. Подготовьтесь к защите работы 1. Номер опыта , его название и цели, материальное обеспечение 2. Что делали? – записывается кратко, вместо словесного описания последовательности действий используется рисунок. 3. Наблюдения – рисунок ил и схема поясняются обозначениями: - образование осадка ↓ - цвет осадка, и его характер (мучнистость, творожистость, студенистый) - Выделение газа ↑; указать цвет, запах, как горит (яркость пламени) 4. Уравнения реакции – записывается уравнение реакции 5. Выводы по проделанной работе |
Методические указания по выполнению работы:
1. Повторите материал по данной теме по конспекту или учебнику
2. Оформите отчет по работе (заполните таблицу, номер работы, ее название и цели, материальное обеспечение)
3. Выпишите исходные данные
4. Подготовьтесь к защите работы
Контрольные вопросы
1. Какие реакциями называются реакциями омыления?
2. Что, такое мыло?
Лабораторная работа № 14
Ознакомление с физическими свойствами глюкозы (аптечная упаковка, таблетки). Взаимодействие глюкозы и сахарозы с гидроксидом меди (II). Кислотный гидролиз сахарозы.
Цель работы
познакомиться с важнейшими химическими свойствами глюкозы и крахмала;
отработать навыки экспериментальной работы, соблюдая правила техники безопасности при работе в кабинете химии.
Оборудование и реактивы
раствор глюкозы, растворы CuSO4 и NaOH, сахароза, штатив с пробирками, прибор для нагревания, держатель, спички.
Краткие теоретические сведения
Углеводы - природные соединения. Являясь основным компонентом пищи, углеводы поставляют большую часть энергии, необходимой для жизнедеятельности. Некоторые углеводы входят в состав нуклеиновых кислот, осуществляющих биосинтез белка и передачу наследственных признаков.
Углеводы широко распространены в природе и играют большую роль в биологических процессах живых организмов и человека. К ним относятся, например, виноградный сахар или глюкоза, свекловичный (тростниковый) сахар или сахароза, крахмал и клетчатка. Название "углеводы" возникло в связи с тем, что химический состав большинства соединений этого класса выражался общей формулой Сn(H2O)m. Дальнейшее исследование углеводов показало, что такое название является неточным. Во-первых, найдены углеводы, состав которых не отвечает этой формуле. Во-вторых, известны соединения (формальдегид СН2О, уксусная кислота С2Н4О2), состав которых хотя и соответствует общей формуле Сn(H2O)m, но по свойствам они отличаются от углеводов.
Углеводы в зависимости от их строения можно подразделить на моносахариды, дисахариды и полисахариды.
В молекулах моносахаридов может содержаться от четырех до десяти атомов углерода. Названия всех групп моносахаридов, а также названия отдельных представителей оканчиваются на - оза. Поэтому в зависимости от числа атомов углерода в молекуле моносахариды подразделяют на тетрозы, пентозы, гексозы и т. д. Наибольшее значение имеют гексозы и пентозы.
Классификация углеводов
| Простые (не подвергаются гидролизу) | Сложные (подвергаются гидролизу) | |
| Моносахариды | Олигосахариды (Дисахариды) | Полисахариды |
| Глюкоза С6Н12О6 Фруктоза С6Н12О6 Рибоза С5Н10О5 | Сахароза (дисахарид) С12Н22О11 | Крахмал (С6Н10О5)n Целлюлоза (С6Н10О5)n |
Глюкоза C6H12O6, химическое строение глюкозы можно выразить формулой:
O
//
CH2OH - CHOH - CHOH - CHOH - CHOH - C
\
H
Вывод: глюкоза - многоатомный альдегидоспирт. Изомер глюкозы - фруктоза - кетоноспирт.
В водном растворе глюкозы находятся в динамическом равновесии три изомерные формы: α-форма, альдегидная и β-форма.
К дисахаридам относятся: сахароза (сахар), мальтоза, лактоза. Все они имеют молекулярную формулу С12Н22О11. Часто сведения о строении веществ можно получить путём расщепления - гидролиза молекул. Анализ продуктов гидролиза позволяет обнаружить фруктозу и глюкозу. (Молекулы сахарозы состоят из остатков α-глюкозы и β-фруктозы).
| Задание: | Опыт 1. Свойства глюкозы и сахарозы. а) В пробирку внесите 5 капель раствора глюкозы, каплю раствора соли меди (II) и при взбалтывании несколько капель раствора гидроксида натрия до образования светло - синего раствора. Такой опыт проделывали с глицерином. Что общего в свойствах глицерина и глюкозой? Что доказывает опыт с глюкозой? Наличие какой функциональной группы доказывает опыт, к какому классу веществ относится глюкоза. Составить уравнение реакции глюкозы с гидроксидом меди (II). Наличие, какой функциональной группы в молекуле глюкозы доказывает опыт? Составить уравнение реакции глюкозы с гидроксидом меди (II) при нагревании. Заполнить таблицу |
| Содержание отчета: |
3. Подготовьтесь к защите работы 1. Номер опыта , его название и цели, материальное обеспечение 2. Что делали? – записывается кратко, вместо словесного описания последовательности действий используется рисунок. 3. Наблюдения – рисунок ил и схема поясняются обозначениями: - образование осадка ↓ - цвет осадка, и его характер (мучнистость, творожистость, студенистый) - Выделение газа ↑; указать цвет, запах, как горит (яркость пламени) 4. Уравнения реакции – записывается уравнение реакции 5. Выводы по проделанной работе |
Методические указания по выполнению работы:
1. Повторите материал по данной теме по конспекту или учебнику
2. Оформите отчет по работе (заполните таблицу, номер работы, ее название и цели, материальное обеспечение)
3. Выпишите исходные данные
4. Подготовьтесь к защите работы
Вопросы для выводов
1. Указать какие функциональные группы имеет глюкоза, и какие свойства проявляет?
2. Какие важные химические свойства крахмала были отражены в проведенных реакциях?
Контрольные вопросы
1.Какие вещества относятся к углеводам, и почему им было дано такое название?
2. Какие химические свойства для глюкозы и глицерина являются общими, и чем эти вещества отличаются друг от друга? Напишите уравнения соответствующих реакций.
3. Составить уравнения реакций при помощи, которых сахарозу можно превратить в этанол.
Лабораторная работа № 15
Полисахариды. Качественная реакция на крахмал. Обнаружение крахмала в меде, хлебе, йогурте, маргарине, макаронных изделий, крупах.
Цель работы: уметь экспериментально доказывать, что углеводы – сложные вещества, определять их наличие, пользоваться химическим оборудованием и посудой. Знать свойства углеводов; правила техники безопасности.
Оборудование и реактивы: конспект лекций, методические указания по выполнению работы, инструкции по технике безопасности; металлический штатив, спиртовка, пробирки, стеклянная палочка, химический стакан вместимостью 50 мл, электроплитка, водяная баня; молоко; крахмал, спиртовой раствор иода, раствор сульфата меди (II), раствор гидроксида натрия (10-12 %), раствор серной кислоты (1:5), аммиачный раствор оксида серебра (I).
Краткие теоретические сведения: Углеводы – циклические молекулы, состоящие из углерода, водорода и полимера. Общая формула углеводов С (Н О) они делятся на простые и сложные.
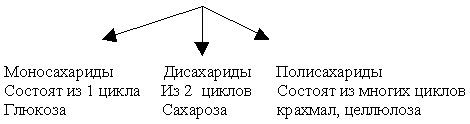
Полисахариды образуются в результате реакции поликонденсации. Важнейшие полисахариды – крахмал, гликоген, хитин, муреин. Крахмал – основной резервный углевод растений, гликоген у животных и человека. Целлюлоза – основной структурный углевод клеточных стенок растений, она не растворима в воде.
Функции углеводов.
1. Энергетическая – могут расщепляться до углекислого газа и воды с выделением энергии.
2. Строительная – мтенки растительных клеток состоят из углеводов (целлюлоза).
Углеводы служат основным источником энергии. Свыше 56% энергии организм получает за счет углеводов, остальную часть – за счет белков и жиров.
В зависимости от сложности строения, растворимости, быстроты усвоения углеводы пищевых продуктов подразделяются на простые углеводы: моносахариды (глюкоза, фруктоза, галактоза), дисахариды (сахароза, лактоза) и сложные углеводы, или полисахариды (крахмал, гликоген, клетчатка).
Простые углеводы легко растворяются в воде и быстро усваиваются. Они обладают выраженным сладким вкусом и относятся к сахарам. Наиболее распространенный моносахарид – глюкоза – содержится во многих плодах и ягодах, а также образуется в организме в результате расщепления дисахаридов и крахмала пищи. Глюкоза наиболее быстро и легко используется в организме для образования гликогена, для питания тканей мозга, работающих мышц (в том числе и сердечной мышцы), для поддержания необходимого уровня сахара в крови и создания запасов гликогена печени. Во всех случаях при большом физическом напряжении глюкоза может использоваться как источник энергии. Фруктоза обладает теми же свойствами, что и глюкоза, и может рассматриваться как ценный, легкоусвояемый сахар. Однако она медленнее усваивается в кишечнике и, поступая в кровь, быстро покидает кровяное русло. Фруктоза в значительном количестве (до 70–80%) задерживается в печени и не вызывает перенасыщение крови сахаром. В печени фруктоза более легко превращается в гликоген по сравнению с глюкозой. Фруктоза усваивается лучше сахарозы и отличается большей сладостью. Высокая сладость фруктозы позволяет использовать меньшие ее количества для достижения необходимого уровня сладости продуктов и таким образом снизить общее потребление Сахаров, что имеет значение при построении пищевых рационов ограниченной калорийности.
Не относитесь к углеводам слишком пренебрежительно. Они в такой же степени необходимы для здоровья, как и остальные питательные вещества, и в грамме углеводов содержатся те же 4 калории, что и в грамме белка. Хотя не существует официальных норм потребления углеводов, рекомендуется минимум в 50 г в день, чтобы избежать кетоза, кислого состояния крови, которое может развиться, если для образования энергии используются преимущественно запасы жира.
| Задание: | Опыт 1. Взаимодействие крахмала с йодом В пробирку внесите 5-6 капель крахмального клейстера и одну каплю спиртового раствора йода. Что при этом наблюдается? Опыт 2. Ферментативный гидролиз крахмала. Опыт 3. Качественная реакция на крахмал (иодная проба). К 1-1,5 мл раствора крахмала добавьте 1 каплю иодной воды. Что наблюдается? Полученную жидкость нагрейте на пламени спиртовки. Какие происходят изменения? Затем охладите содержимое пробирки под струей холодной воды. Что наблюдается? Разотрите мёд. Накапайте на него раствор йода. Наблюдайте за изменением цвета. Накапайте на крахмал раствор йода. Наблюдайте за изменением цвета. Возьмите маленький кусочек белого хлеба и накапайте на него раствор йода. Что Вы наблюдаете? Разотрите горох (зерна риса). Добавьте немного воды и перемешайте. Накапайте йод. Что Вы наблюдаете? Возьмите ложку йогурта, поместите в фарфоровую чашу прилейте 1-2 мл. раствора йода. Наблюдайте за изменением цвета. Нанесите на свежий разрез маргарина каплю раствора йода. При наличии крахмала поверхность маргарина на разрезе окрашивается в синий цвет. На свежеприготовленные отварные макаронины капните раствором йода. Наблюдайте за изменением цвета Заполнить таблицу
2. Составьте (оформите) отчет по работе Заполнить таблицу |
| Содержание отчета: |
3. Подготовьтесь к защите работы 1. Номер опыта , его название и цели, материальное обеспечение 2. Что делали? – записывается кратко, вместо словесного описания последовательности действий используется рисунок. 3. Наблюдения – рисунок ил и схема поясняются обозначениями: - образование осадка ↓ - цвет осадка, и его характер (мучнистость, творожистость, студенистый) - Выделение газа ↑; указать цвет, запах, как горит (яркость пламени) 4. Уравнения реакции – записывается уравнение реакции 5. Выводы по проделанной работе |
Методические указания по выполнению работы:
1. Повторите материал по данной теме по конспекту или учебнику
2. Оформите отчет по работе (заполните таблицу, номер работы, ее название и цели, материальное обеспечение)
3. Выпишите исходные данные
4. Подготовьтесь к защите работы
Тематика контрольных вопросов:
1. Приведите структурную формулу фрагмента молекулы целлюлозы и уравнение реакции гидролиза целлюлозы. Укажите условия.
2.Массовая доля крахмала в картофеле составляет 20 %. Какую массу глюкозы можно получить из 1620 кг картофеля, если выход продукта составляет 75 % от теоретического?
3. Каково строение молекул полисахаридов? Какие полисахариды вы знаете?
4. Найдите черты сходства и различия в строении, физических и химических свойствах крахмала?
II.Описание практических работ
1.Решение элементарных генетических задач
2. Анализ и оценка этических аспектов развития некоторых исследований в биотехнологии
3. Описание особей вида по морфологическому критерию
4. Приспособление организмов к разным средам обитания (к водной, наземно-воздушной, почвенной)
5. Анализ и оценка различных гипотез происхождения человека
6. Составление схем передачи веществ и энергии (цепей питания).
Сравнительная характеристика природных экосистем и агроэкосистем своей местности
7. Решение экологических задач. Анализ и оценка последствий собственной
деятельности в окружающей среде, глобальных экологических проблем и путей их решения
8. Определение рН раствора солей
9. Взаимодействие металлов с растворами кислот и солей
10. Испытание растворов щелочей индикаторами. Взаимодействие щелочей с солями. Разложение нерастворимых оснований
11. Изучение растворимости спиртов в воде. Окисление спиртов различного строения хромовой смесью. Получение диэтилового эфира. Получение глицерата меди
12. Растворимость различных карбоновых кислот в воде. Взаимодействие уксусной кислоты с металлами
13. Омыление жира. Получение мыла и изучение его свойств: пенообразование, реакции ионного обмена, гидролиз, выделение свободных жирных кислот
14. Реакция «серебряного зеркала» глюкозы. Взаимодействие глюкозы с гидроксидом меди (II) при различных температурах. Действие аммиачного раствора оксида серебра на сахарозу.
15. Образование солей глицина. Получение медной соли глицина. Денатурация белка. Цветные реакции белков
Практическая работа №1
Решение элементарных генетических задач
Цель работы: Научиться составлять простейшие схемы моногибридного скрещивания на основе предложенных данных. Научиться составлять простейшие схемы дигибридного скрещивания на основе предложенных данных
Оборудование: таблицы, схемы скрещивания, рисунки к генетическим задачам, схемы родословных человека.
Общие теоретические сведения: Моногибридное наследование представляет собой пример наследования единственного признака (гена), различные формы которого называют аллелями. К примеру, при моногибридном скрещивании между двумя чистыми линиями растений, гомозиготных по соответствующим признакам -- одного с жёлтыми семенами (доминантный признак), а другого с зелёными семенами (рецессивный признак), можно ожидать, что первое поколение будет только с жёлтыми семенами, потому что аллель жёлтых семян доминирует над аллелью зелёных. При моногибридном скрещивании сравнивают только один характерный признак. Как правило, моногибридное скрещивание используется для определения того, каким будет второе поколение от пары родителей, гомозиготных по доминантному и рецессивному аллелью соответственно. Результатом такого скрещивания в первом поколении будет единообразие полученных гибридов (все потомки будут гетерозиготными). Результатом моногибридного скрещивания гетерозиготных потомков во втором поколении будет 75 % вероятность проявления доминантного фенотипа и 25%-ая вероятность проявления рецессивного фенотипа. Дигибридное скрещивание - скрещивание организмов, различающихся по двум парам альтернативных признаков, к примеру, окраске цветков (белая или окрашенная) и форме семян (гладкая или морщинистая).
В случае если в дигибридном скрещивании разные пары аллельных генов находятся в разных парах гомологичныххромосом, то пары признаков наследуются независимо друг от друга (закон независимого наследования признаков).
Правила, которые следует помнить при решении задач по генетике
Каждая гамета получает гаплоидный набор хромосом (генов). Все хромосомы (гены) имеются в гаметах.
В каждую гамету попадает только одна гомологичная хромосома из каждой пары (только один ген из каждой аллели).
Число возможных вариантов гамет равно 2n, где n – число хромосом, содержащих гены в гетерозиготном состоянии.
Одну гомологичную хромосому (один аллельный ген) из каждой пары ребенок получает от отца, а другую (другой аллельный ген) – от матери.
Гетерозиготные организмы при полном доминировании всегда проявляют доминантный признак. Организмы с рецессивным признаком всегда гомозиготны.
Решение задачи на дигибридное скрещивание при независимом наследовании обычно сводится к последовательному решению двух задач на моногибридное (это следует из закона независимого наследования)
Алгоритм решения задачи
1. Внимательно изучите условие задачи.
Определите тип задачи, для чего выясните, сколько пар признаков рассматривается в задаче, сколько пар генов кодирует эти признаки, а также число классов фенотипов, присутствующих в потомстве и их соотношение.
2.Выясните генотипы особей, неизвестных по условию.
3.Запишите схему скрещивания в соответствии с требованиями по оформлению, а также максимально подробное изложение всего хода рассуждений по решению задачи, с обязательным логическим обоснованием каждого вывода. Отсутствие объяснения даже очевидных, на первый взгляд, моментов может быть основанием для снижения оценки.
4.Запишите ответ задачи.
| Задание: | 1. У крупного рогатого скота ген, обусловливающий черную окраску шерсти, доминирует над геном, определяющим красную окраску. Какое потомство можно ожидать от скрещивания гомозиготного черного быка и красной коровы? Разберем решение этой задачи. Вначале введем обозначения. В генетике для генов приняты буквенные символы: доминантные гены обозначают прописными буквами, рецессивные — строчными. Ген черной окраски доминирует, поэтому его обозначим А. Ген красной окраски шерсти рецессивен — а. Следовательно, генотип черного гомозиготного быка будет АА. Каков же генотип у красной коровы? Она обладает рецессивным признаком, который может проявиться фенотипически только в гомозиготном состоянии (организме). Таким образом, ее генотип аа. Если бы в генотипе коровы был хотя бы один доминантный ген А, то окраска шерсти у нее не была бы красной. Теперь, когда генотипы родительских особей определены, необходимо составить схему теоретического скрещивания Черный бык образует один тип гамет по исследуемому гену — все половые клетки будут содержать только ген А. Для удобства подсчета выписываем только типы гамет, а не все половые клетки данного животного. У гомозиготной коровы также один тип гамет — а. При слиянии таких гамет между собой образуется один, единственно возможный генотип — Аа, т.е. все потомство будет единообразно и будет нести признак родителя, имеющего доминантный фенотип — черного быка.. РАА * аа GА а FАа Таким образом, можно записать следующий ответ: при скрещивании гомозиготного черного быка и красной коровы в потомстве следует ожидать только черных гетерозиготных телят Самостоятельное решение задач 2. Задача № 2. Какое потомство можно ожидать от скрещивания коровы и быка, гетерозиготных по окраске шерсти? Задача № 3. У морских свинок вихрастая шерсть определяется доминантным геном, а гладкая — рецессивным. Скрещивание двух вихрастых свинок между собой дало 39 особей с вихрастой шерстью и 11 гладкошерстных животных. Сколько среди особей, имеющих доминантный фенотип, должно оказаться гомозиготных по этому признаку? Морская свинка с вихрастой шерстью при скрещивании с особью, обладающей гладкой шерстью, дала в потомстве 28 вихрастых и 26 гладкошерстных потомков. Определите генотипы родителей и потомков. Задача № 4. Выпишите гаметы организмов со следующими генотипами: ААВВ; aabb; ААЬЬ; ааВВ; АаВВ; Aabb; АаВЬ; ААВВСС; ААЬЬСС; АаВЬСС; АаВЬСс. Разберем один из примеров. При решении подобных задач необходимо руководствоваться законом чистоты гамет: гамета генетически чиста, так как в нее попадает только один ген из каждой аллельной пары. Возьмем, к примеру, особь с генотипом АаВbСс. Из первой пары генов — пары А — в каждую половую клетку попадает в процессе мейоза либо ген А, либо ген а. В ту же гамету из пары генов В, расположенных в другой хромосоме, поступает ген В или b. Третья пара также в каждую половую клетку поставляет доминантный ген С или его рецессивный аллель — с. Таким образом, гамета может содержать или все доминантные гены — ABC, или же рецессивные — abc, а также их сочетания: АВс, AbC, Abe, аВС, аВс, а bС. Чтобы не ошибиться в количестве сортов гамет, образуемых организмом с исследуемым генотипом, можно воспользоваться формулой N = 2n, где N — число типов гамет, а n — количество гетерозиготных пар генов. В правильности этой формулы легко убедиться на примерах: гетерозигота Аа имеет одну гетерозиготную пару; следовательно, N = 21 = 2. Она образует два сорта гамет: А и а. ДигетерозиготаАаВЬ содержит две гетерозиготные пары: N = 22 = 4, формируются четыре типа гамет: АВ, Ab, aB, ab. Тригетерозигота АаВЬСс в соответствии с этим должна образовывать 8 сортов половых клеток N = 23 = 8), они уже выписаны выше. Задача № 5. У крупного рогатого скота ген комолости доминирует над геном рогатости, а ген черного цвета шерсти — над геном красной окраски. Обе пары генов находятся в разных парах хромосом. 1. Какими окажутся телята, если скрестить гетерозиготных по обеим парам признаков быка и корову? |
| Содержание отчета: | Отчёт оформить в виде решения задач |
Методические указания по выполнению работы:
Повторите материал по данной теме по конспекту или учебнику
Оформите отчет по работе в виде схем решения задач
2. Подготовьтесь к защите работы
Тематика контрольных вопросов:
Задача №1. Из желтого семени гороха получено растение, которое дало 215 семян, из них 165 желтых и 50 зелёных. Каковы генотипы всех форм?
Задача №2.У пшеницы ген карликовости доминирует над геном нормального роста. Каковы генотипы исходных форм, если в потомстве получилось расщепление по этому признаку в соотношении 3:1?
Задача №3. Способность владеть правой рукой (правша) доминирует у человека над способностью лучше владеть левой рукой (левша). Оба родители правши, а ребенок у них –левша. Определите генотипы всех членов семьи.
Задача №4 . У крупного рогатого скота ген комолости доминирует над геном рогатости, а ген черного цвета шерсти — над геном красной окраски. Обе пары генов находятся в разных парах хромосом.
1. Какими окажутся телята, если скрестить гетерозиготных по обеим парам
признаков быка и корову?
2. Какое потомство следует ожидать от скрещивания черного комолого быка, гетерозиготного по обеим парам признаков, с красной рогатой коровой?
Задача № 5. У человека ген карих глаз доминирует над геном, обусловливающим голубые глаза. Голубоглазый мужчина, один из родителей которого имел карие глаза, женился на кареглазой женщине, у которой отец имел карие глаза, а мать — голубые. Какое потомство можно ожидать от этого брака?
Практическая работа №2
Тема: Анализ и оценка этических аспектов развития некоторых исследований в биотехнологии
Цель: развивать информационную исследовательскую компетентность обучающихся (поиск, анализ, отбор нужной информации, её преобразование, сохранение и передача), познакомиться с этическими аспектами развития некоторых исследований в биотехнологии и дать им оценку.
Оборудование: тексты к практической работе: «Биотехнологии – это…», «Клонирование»
Общие теоретические сведения:
«Биотехнологии – это…»,
Биотехнологией называют совокупность технических приемов, использующих различные биологические системы или живые организмы для создания или обработки продуктов самого разного назначения.
Существуют несколько отраслей биотехнологии. Наряду с получением антибиотиков, аминокислот, гормонов биотехнологическими методами существуют и другие продукты, получаемые с помощью отраслей биотехнологии. Наибольшие споры вызывают трансгенные организмы и клонирование животных.
Генная инженерия – это методы изменения генетических свойств организмов в результате введения в их клетки генов других организмов. В результате получаются трансгенные организмы.
Генетики скрестить бациллу с картофелем не могут, а генные инженеры — могут. Генетическая селекция улучшает количественные характеристики сорта или породы (урожайность, устойчивость к заболеваниям, надои и др.); генная инженерия способна создать принципиально новое качество — перенести ген, его кодирующий, из одного биологического вида в другой, в частности, ген инсулина от человека в дрожжи. И генетически модифицированные дрожжи становятся фабрикой инсулина.
Считается, что единственное принципиальное препятствие, стоящее перед генными инженерами, — это или их ограниченная фантазия, или ограниченное финансирование. Непреодолимых природных ограничений в генной инженерии, похоже, нет.
При создании таких организмов высказываются опасения биологического и экологического нравственного, этического, философского, религиозного характера. В 1973-1974 годах были выработаны правила техники безопасности по обращению с трансгенными организмами. По мере ускоряющегося развития генной инженерии строгость правил безопасности все время снижалась. Первоначальные страхи оказались сильно преувеличенными.
В итоге 30-летнего мирового опыта генной инженерии стало ясно, что случайно в процессе «мирной» генной инженерии что-либо вредного возникнуть не может. В общем, за все 30 лет интенсивного и все расширяющегося применения генной инженерии ни одного случая возникновения опасности, связанной с трансгенными организмами, зарегистрировано не было. Когда речь идет об опасности или безопасности трансгенных организмов и продуктов из них полученных, то самые распространенные точки зрения основываются преимущественно на «общих соображениях и здравом смысле». Вот что обычно говорят те, кто против:
- природа устроена разумно, любое вмешательство в нее только все ухудшит;
- поскольку сами ученые не могут со100%-ной гарантией предсказать все, особенно отдаленные, последствия применения трансгенных организмов, не надо этого делать вообще.
А вот аргументы тех, кто выступает за:
- в течение миллиардов лет эволюции природа успешно «перепробовала» все возможные варианты создания живых организмов, почему же деятельность человека по конструированию измененных организмов должна вызывать опасения?
- в природе постоянно происходит перенос генов между разными организмами (в особенности между микробами и вирусами), так что ничего принципиально нового трансгенные организмы в природу не добавят.
Дискуссия о выгодах и опасностях применения трансгенных организмов обычно концентрируется вокруг главных вопросов о том, опасны ли продукты, полученные из трансгенных организмов и опасны ли сами трансгенные организмы для окружающей среды?
По характеристикам трансгенная продукция не отличается от аналогичных продуктов, полученных из естественных природных источников. Это неоднократно доказано тестированием, которое обязательно проводится перед выпуском на рынок продуктов, полученных из генетически модифицированных организмов. Методы оценки возможностей токсичности, аллергенности и других видов вредности достаточно надежны и стандартизированы во многих странах, в частности в России.
Разумеется, это не означает, что любые продукты, полученные из любых генетически модифицированных организмов, будут безопасны. Безопасными могут считаться только те, которые прошли всестороннюю государственную проверку. Потребитель должен иметь право информированного выбора. Продукты из трансгенных организмов должны иметь маркировку, которая позволит выбрать: 1) дорогие «экологически чистые» не трансгенные продукты, полученные без применения химических удобрений, пестицидов и гербицидов или 2) не трансгенные, выращенные с применением химии, или 3) трансгенные, но выращенные без «химии», цена которых должна быть в несколько раз ниже, чем экологически чистых.
Производственные посевы ТР уже занимают большие площади, и они продолжают расширяться. За последние 12 лет в США выращено 3,5 трлн трансгенных растений. При этом не было зарегистрировано ни одного случая возникновения серьезных медико-биологических последствий их производства и использования.
В целом при оценке степени биологической и экологической опасности по принципу близкого сходства безопасное ТР должно быть похожим на его исходный нетрансгенный аналог.
Итак, генные инженеры утверждают, что трансгенные продукты безопасны и дешевы, что трансгенное сельское хозяйство не только более экономично, но и более экологично, чем традиционное, основанное на массовом применении химических средств защиты растений.
«Клонирование»
Еще одним достижением биотехнологии, вызывающим много споров, является клонирование млекопитающих, в частности клонирование человека.
Сейчас клонами называются особи животных или растений, полученные путем бесполого размножения и имеющие полностью идентичные генотипы. Клонированием называют искусственное получение клонов животных.
Именно возможность искусственного клонирования человека вызвала бурные эмоции в обществе.
Предполагается, что можно использовать клонирование для преодоления бесплодия — так называемоерепродуктивное клонирование. Бесплодие, действительно, — чрезвычайно важная проблема, многие бездетные семьи согласны на самые дорогие процедуры, чтобы иметь возможность родить ребенка. Однако возникает вопрос: а что принципиально нового может дать клонирование по сравнению, например, с экстракорпоральным оплодотворением с использованием донорских половых клеток? Честный ответ — ничего. Клонированный ребенок не будет иметь генотипа, являющегося комбинацией генотипов мужа и жены. Генетически такая девочка будет монозиготной сестрой своей матери, генов отца у нее не будет. Точно так же клонированный мальчик для своей матери будет генетически чужд. В таком случае — зачем эта сложная и, что особенно важно, очень рискованная процедура? А если вспомнить эффективность клонирования, представить себе, сколько нужно получить яйцеклеток, чтобы родился один клон, который к тому же, возможно, будет больным, с укороченной продолжительностью жизни, сколько эмбрионов, уже начавших жить, погибнет, то перспектива репродуктивного клонирования человека становится устрашающей. В большинстве тех стран, где технически возможно осуществление клонирования человека, репродуктивное клонирование запрещено законодательно.
Терапевтическое клонирование предполагает получение эмбриона, выращивание его до 14-дневного возраста, а затем использование эмбриональных стволовых клеток в лечебных целях. Перспективы лечения с помощью стволовых клеток ошеломляющи — излечение многих нейродегенеративных заболеваний (например, болезней Альцгеймера, Паркинсона), восстановление утраченных органов, а при клонировании трансгенных клеток - лечение многих наследственных болезней. Но посмотрим правде в лицо: фактически это означает вырастить себе братика или сестричку, а потом — убить, чтобы использовать их клетки в качестве лекарства. И если убивается не новорожденный младенец, а двухнедельный эмбрион, дела это не меняет. Поэтому ученые ищут другие пути для получения стволовых клеток.
Китайские ученые с целью получения эмбриональных стволовых клеток человека создали гибридные эмбрионы путем клонирования ядер клеток кожи человека в яйцеклетках кроликов. Было получено более 100 эмбрионов, которые в течение нескольких дней развивались в искусственных условиях, а затем из них были получены стволовые клетки. Ученые надеются, что такой способ получения стволовых клеток окажется этически более приемлемым, чем клонирование человеческих эмбрионов.
К счастью, оказывается, что эмбриональные стволовые клетки можно получать еще проще, не прибегая к сомнительным с этической точки зрения манипуляциям. У каждого новорожденного в его собственной пуповинной крови содержится довольно много стволовых клеток. Если эти клетки выделить, а затем хранить в замороженном виде, их можно использовать, если возникнет необходимость. Создавать банки стволовых клеток можно уже сейчас. Правда, следует иметь в виду, что стволовые клетки могут преподнести сюрпризы, в том числе и неприятные. В частности, имеются данные о том, что стволовые клетки могут легко приобретать свойства злокачественности. Скорее всего, это связано с тем, что в искусственных условиях над ними нет жесткого контроля со стороны организма. А ведь контроль «социального поведения» клеток в организме не только жесткий, но весьма сложный и многоуровневый. Но возможности использования стволовых клеток столь впечатляющи, что исследования в этой области и поиски доступного источника стволовых клеток будут продолжаться.
Допустимо ли клонирование человека в принципе? Какие последствия может иметь применение этого способа размножения?
Одно из вполне реальных последствий клонирования — нарушение соотношения полов в потомстве. Не секрет, что очень и очень многие семьи во многих странах хотели бы иметь скорее мальчика, чем девочку. Уже в настоящее время в Китае возможность пренатальной диагностики пола и меры по ограничению рождаемости привели к такому положению, что в некоторых районах среди детей наблюдается значительное преобладание мальчиков. Что будут делать эти мальчики, когда придет время заводить семью?
Другое негативное следствие широкого применения клонирования — снижение генетического разнообразия человека. Оно и так невелико — существенно меньше, чем, например, даже у таких малочисленных видов, как человекообразные обезьяны. Причина этого — резкое снижение численности вида, имевшее место не менее двух раз за последние 200 тыс. лет. Результат — большое количество наследственных заболеваний и дефектов, вызываемых переходом мутантных аллелей в гомозиготное состояние. Дальнейшее снижение разнообразия может поставить под угрозу существование человека как вида. Правда, справедливости ради следует сказать, что столь широкого распространения клонирования вряд ли следует ожидать даже в отдаленном будущем.
И, наконец, не следует забывать о тех последствиях, которые мы пока не в состоянии предусмотреть.
| Задание: | Задание 1(Вариант 1). Изучите текст «Биотехнологии – это…», ответьте на вопросы: 1. Что такое биотехнология? 2. Чем отличается генетическая селекция и генная инженерия? 3. Приведите аргументы «за» и «против» использования трансгенных продуктов (можно использовать не только материал статьи). Хотите ли вы использовать продукты, полученные из трансгенных организмов в пищу? Почему? Задание 2 (Вариант 2). Изучите текст «Клонирование», ответьте на вопросы: 1. Что такое клон? Возможно ли возникновение клонов человека естественным путем? Если да, то в каком случае? 2. С какой целью предполагается использование клонирования человека? 3. Приведите аргументы «за» и «против» клонирования человека. Хотели бы вы в будущем получить своего клона? Почему? Задание 3. Сделайте вывод о эстетических проблемах биотехнологии 1.Составьте (оформите) отчет по работе |
| Содержание отчета: | 2. Подготовьтесь к защите работы 3. Выводы по проделанной работе |
Методические указания по выполнению работы:
1. Повторите материал по данной теме по конспекту или учебнику
2. Оформите отчет по работе (заполните таблицу, номер работы, ее название и цели, материальное обеспечение)
3. Выпишите исходные данные
4. Подготовьтесь к защите работы
Практическая работа №3
Описание особей одного вида по морфологическому критерию
Цель работы: усвоить понятие «морфологический критерий», закрепить умение составлять описательную характеристику растений.
Оборудование гербарные образцы растений
Общие теоретические сведения
Понятие «Вид» был введён в 17 в. Д. Реем. К. Линней заложил основы систематики растений и животных, ввёл для обозначения вида бинарную номенклатуру. Все виды в природе подвергаются изменчивости и реально существуют в природе. На сегодняшний день описано несколько млн. видов, этот процесс продолжается и сейчас. Виды неравномерно распределены по всему земному шару.
Вид – группа особей, имеющих общие признаки строения, общее происхождение, свободно скрещивающиеся между собой, дающих плодовитое потомство и занимающих определённый ареал.
Часто перед биологами возникает вопрос: принадлежат ли данные особи к одному виду или нет? Для этого существуют строгие критерии.
Критерий – это признак, по которым один вид отличается от другого. Они же являются изолирующими механизмами, препятствующими скрещиванию, независимости, самостоятельности видов.
Видовые критерии, по которым мы отличаем один вид от другого, в совокупности обуславливают генетическую изоляцию видов, обеспечивая самостоятельность каждого вида и разнообразие их в природе. Поэтому изучение видовых критериев имеет определяющее значение для понимания механизмов процесса эволюции, происходящего на нашей планете.
| |
Типы корневых систем
Существует 2 типа корневых систем:
1. стержневая корневая система состоит из одного главного и множества боковых корней.
Пример: такая корневая система имеется у одуванчика, щавеля, моркови, свёклы и др.
2. Мочковатая корневая система состоит из придаточных и боковых корней приблизительно одного и того же размера. Главный корень у растений с мочковатой системой недостаточно развит или рано отмирает.
Пример: такая корневая система имеется у пшеницы, ячменя, лука, чеснока и др.
Классификация стеблей
Классификация стеблей по степени одревеснения
1. Травянистые стебли имеются у травянистых растений и молодых побегов древесных пород. Травянистые стебли существуют обычно один сезон.
| | |
| Одуванчик лекарственный — типичный представитель травянистых растений с зелёным, сочным стеблем | У гигантского борщевика полый стебель |
2. Деревянистые стебли имеются у деревьев и кустарников. Они приобретают твёрдость благодаря отложению в оболочке их клеток особого вещества — лигнина. Одревеснение происходит у стеблей деревьев и кустарников начиная со второй половины лета первого года их жизни.
Классификация стеблей по направлению роста
Стебли растений могут по-разному располагаться относительно почвы и рядом расположенных растений.
Лист. Внешнее строение. Типы листорасположения и жилкования листа
Лист — часть побега. Он осуществляет три основные функции — фотосинтез (образование органических веществ), газообмен и испарение воды.
Части листа
Лист имеет листовую пластинку, черешок, основание и прилистники.
Листовая пластинка является основным местом, в котором происходит фотосинтез. Черешок листа прикрепляет его к стеблю и поворачивает в наилучшее положение по отношению к свету.
Листья, имеющие черешки, называют черешковыми.
Листья без черешков называют сидячими.
Пример: черешковые листья — у крапивы, липы, клёна, берёзы, яблони, вишни и др.
Сидячие листья — у одуванчика, алоэ, льна, цикория, пшеницы и др.
Форма листа
По форме листья бывают округлыми, овальными, сердцевидными, игольчатыми и т. д.
По форме края пластинки листья также разнообразны.
например, лист яблони имеет зубчатый край, осины — пильчатый, сирени — цельнокрайний.
Листья простые и сложные
Простые листья состоят из одной листовой пластинки.
такие листья у берёзы, клёна, дуба, черёмухи и других растений.
 Сложные листья состоят из нескольких листовых пластинок, соединённых с общим черешком небольшими черешками.
Сложные листья состоят из нескольких листовых пластинок, соединённых с общим черешком небольшими черешками.
Пример: такие листья у ясеня, рябины и многих других.

Жилкование листьев.
Типы жилкования листа — дуговое, параллельное, сетчатое (или перистое), пальчатое.
| Дуговидное жилкование У листьев подорожника, ландыша жилки крупные и, помимо центральной, изогнуты подобно дуге. Их жилкование называют дуговидным. | Подорожник большой |
| Параллельное жилкование Если несколько крупных жилок проходят вдоль пластинки параллельно друг другу, то и жилкование называют параллельным. Такое жилкование имеют листья пшеницы, кукурузы, |
Кукуруза |
|
Сетчатое (перистое) жилкование У листьев дуба, берёзы выделяется одна мощная жилка, расположенная по середине. Это — главная жилка, вокруг которой ветвистые мелкие жилки создают сетку. Такое жилкование и называют сетчатым. Так как от главной жилки отходят жилки влево и вправо, напоминая строение пера, такое жилкование ещё называют перистым, или перисто-сетчатым. | Осина обыкновенная |
| Пальчатое (пальчато-сетчатое) жилкование Листья клёна платановидного, лютика едкого имеют несколько крупных, почти одинаковых жилок, расходящихся веером от основания пластинки. Они также многократно ветвятся. Такое жилкование называют пальчатым, или пальчато-сетчатым. |
Клён платановидный |
Листорасположение. Листья к стеблю прикрепляются так, чтобы получать максимально возможное количество света.
Листорасположение может быть мутовчатым, очерёдным, розеточным или супротивным:
| | Хвощ лесной
|
| | Ваниль
|
|
| Подорожник большой
|
| | Очанка Росткова |
Соцветия. Есть растения с одиночными цветками, которые развиваются по одному на концах побегов или в пазухах листьев.
У других растений цветки собраны в соцветия.
Соцветия — это группы цветков, расположенных близко один к другому в определённом порядке.
В соцветия обычно собраны мелкие цветки, что делает их хорошо заметными для насекомых-опылителей. Соцветия бывают простыми и сложными.
Простые соцветия
Соцветия, у которых цветки располагаются на главной оси, называют простыми. К простым соцветиям относят кисть, колос, початок, головку, корзинку, зонтик, щиток.

Соцветие кисть имеют капуста, ландыш, черёмуха. В таком соцветии отдельные цветки расположены один за другим на хорошо заметных цветоножках, отходящих от длинной общей оси.
Простой колос образуют не имеющие цветоножек (т. е. сидячие) цветки, расположенные на общей оси соцветия, как у подорожника.
Початок отличается от колоса толстой, обычно мясистой осью соцветия.
Корзинка — это соцветие у подсолнечника, топинамбура, астры, одуванчика, ромашки, осота, бодяка и многих других растений. В таком соцветии обычно многочисленные мелкие сидячие цветки расположены на утолщённом и расширенном ложе соцветия. Снаружи это соцветие защищено зелёными листьями — обёрткой.
У соцветия головка сидячие цветки находятся на несколько утолщённой укороченной главной оси. Такое шаровидное соцветие образуется у клевера. Простой зонтик — соцветие, в котором цветоножки одинаковой длины выходят из вершины оси соцветия. Такое соцветие имеют примула, вишня.
Цветки в соцветии щиток, отличаются от зонтика тем, что имеют цветоножки разной длины и от верхушки оси обычно отходят на некотором расстоянии друг от друга (ниже расположенные цветки имеют более длинные цветоножки). Соцветие щиток образуют груша, спирея.
Сложные соцветия с цветками, находящимися на боковых осях, отходящих от главной, называют сложными.
 Если несколько кистей отходит от общего стебелька, соцветие называют сложной кистью, или метёлкой. Такое соцветие имеют сирень, виноград.
Если несколько кистей отходит от общего стебелька, соцветие называют сложной кистью, или метёлкой. Такое соцветие имеют сирень, виноград.
Соцветия пшеницы, ржи, ячменя называют сложным колосом. В этом соцветии на общей оси сидят несколько колосков, каждый из которых образован несколькими цветками, у ржи, например, двумя.
Морковь и петрушка имеют соцветия-зонтики, состоящие из нескольких простых зонтиков. Такое соцветие называют сложным зонтиком.
Классификация плодов. Огромное разнообразие плодов у растений обусловлено выработкой в процессе их исторического развития приспособлений к распространению семян.
- По количеству семян плоды разделяют на односемянные и многосемянные.
- В зависимости от количества воды в околоплоднике различают сочные и сухие плоды. Созревшие сочные плоды имеют в составе околоплодника сочную мякоть. Созревшие сухие плоды сочной мякоти не имеют.

Сочные плоды
Ягодовидные плоды — плоды с сочным околоплодником, чаще всего многосемянные.Ягода — сочный плод с мякотью, покрытой снаружи тонкой кожицей. Пример: внутри плодов смородины, клюквы, черники, томатов, винограда много мелких семян. Встречаются и односемянные ягоды, например, у барбариса, финиковой пальмы.
Яблоко — в образовании его, кроме завязи, принимают участие нижние части тычинок, лепестков, чашелистиков и цветоложе. Семена лежат в пленчатых сухих камерах. Пример:такие плоды имеют яблоня, груша, айва.
Тыквина — семена лежат в сочной мякоти плода, наружный слой околоплодника деревянистый. Пример: такие плоды у тыквы, арбуза, огурца.
Померанец (или гесперидий) — ягодовидный плод цитрусовых.
Пример: лимон, апельсин.
Костянковидные плоды — плоды с сочной мякотью и твёрдой косточкой.
Костянка — сочный плод с тонкой кожицей, мякотью и одревесневшим внутренним слоем околоплодника — косточкой, внутри которой находится одно семя. Пример: костянки имеют вишня, слива, абрикос, черёмуха. У некоторых растений костянки многосемянные, например, у бузины, крушины. Многокостянка — на белом коническом сухом цветоложе расположены многочисленные сочные костянки. Пример: такой плод у малины, костяники.
Сухие плоды. Ореховидные плоды — односемянные, нераскрывающиеся плоды с сухим околоплодником. Орех — околоплодник жёсткий, деревянистый. Семя лежит свободно. Пример: такие плоды имеют лещина, фундук. У гречихи плод — орешек (маленьких размеров).
Жёлудь — околоплодник менее жёсткий, чем у ореха, у основания плод окружён чашевидной плюской (защитным покровом). Пример: плод жёлудь имеет дуб.
Семянка — сухой плод, околоплодник которого прилегает к единственному семени, но не срастается с ним. Пример: такие плоды образуются у подсолнечника.
Зерновка — сухой плод, у которого плёнчатый околоплодник срастается с семенной кожурой единственного семени. Пример: такие плоды у пшеницы и кукурузы.
Коробочковидные плоды — многосемянные, обычно раскрывающиеся плоды с сухим околоплодником. Боб — сухой плод, который вскрывается двумя створками. Когда боб созревает, створки его подсыхают и, скручиваясь, выбрасывают семена. Пример: такие плоды у фасоли, гороха, бобов, акации. Стручок, как и боб, имеет две створки, но семена в стручке располагаются не на створках, как у боба, а на перегородке плода. Пример: стручки характерны для сурепки, капусты, редиса, репы, брюквы, редьки, левкоя. Коробочки различаются в основном по способу вскрывания. Многочисленные семена высыпаются через специальные отверстия или трещины в стенке коробочки. Пример: у ириса и тюльпана они открываются створками, у белены — крышечкой, у мака и колокольчика — дырочками. Коробочки развиваются также у льна, хлопчатника, фиалки, табака.
| Задание: | 1. Рассмотрите растения двух видов и опишите их по плану: 1) название растения 2) особенности корневой системы 3) особенности стебля 4) особенности листа 5) особенности цветка 6) особенности плода 2. Сравните растения двух видов, выявите черты сходства и различия. Чем объясняются сходства (различия) растений? |
| Содержание отчета: | Составьте отчёт (заполните таблицу, составьте схему) Сделайте и запишите выводы по проделанной работе |
Методические указания по выполнению работы:
Повторите материал по данной теме по конспекту или учебнику
Оформите отчет по работе. Сделайте вывод.
Подготовьтесь к защите работы
Тематика контрольных вопросов:
1.Какие принципы положены в основу видообразования?
2.Назовите основные формы видообразования. Приведите примеры географического видообразования.
3. Почему появляются эндемичные виды? Приведите примеры
4. Приведите примеры аллопатрического видообразования?
5. В чем заключается механизм симпатрического видообразования. Приведите примеры
6. Какие причины вызывают внезапное видообразование
Практическая работа №4
Приспособление организмов к различным средам
Цель работы: Научиться выявлять черты приспособленности организмов к среде обитания и устанавливать ее относительный характер
Оборудование гербарные образцы растений, комнатные растения, чучела или рисунки животных различных мест обитания.
Общие теоретические сведения
У жителя водной среды должны быть определенные приспособления, многие из них можно обнаружить уже в его внешности. Для плаванья нужны соответствующая форма тела, покрытие его облегчающее движение в воде. Аппарат передвижения включает особые конечности, специальные выросты или иной вариант двигателя.
Приспособления к водной средеФорма тела должна быть всегда обтекаемой при самых разных ее вариантах:
- сплюснутой с боков (карась),
сплюснутой в спино-брюшном направлении (пиявка),
круглой в поперечном сечении (угорь),
каплевидной (жук-плавунец),
торпедообразной (кальмар).
Тело должно минимизировать трение о воду. Это достигается особенностями его покровов:
покров слизи (рыба);
очень гладкая («полированная») твердая поверхность (морская черепаха),
мягкий слой на поверхности твердого корпуса (кит).
Конечности:
имеют плавательную перепонку (лягушка),
преобразованы в плавники (дельфин),
преобразованы в ласты (тюлень).
Специальные выросты и приспособления к движению в воде могут включать:
плавательную перепонку вокруг тела или специальную типа «зонтик» (каракатица, медуза),
водоструйный («реактивный») двигатель (кальмар, личинка стрекозы),
хвост с плавником (рыба).
В воде тоже приходится дышать, и такое дыхание организовано по определенным правилам. Органы дыхания различны:
жабры (рыба),
дыхательная трубка (ранатра),
воздухозаборники (водяные жуки, клопы),
запасание воздуха под водой в виде пузыря (паук серебрянка),
формирование пузыря, заменяющего легкое (жуки-плавунцы).
Основное правило окраски для водных животных диктует соотношение яркости света в воде. Когда смотришь сверху, то видишь темное дно, а при взгляде из воды – светлое небо. Отсюда характерная приспособительная окраска всех живущих в воде. Верхняя часть тела у них темная, маскирует их на фоне темного дна, а нижняя – светлая, маскирует на фоне светлого неба. Из-за этой особенности окраски:большинство водных жителей резко двуцветные: темный верх и светлая нижняя (брюшная) сторона.
Организмы, обитающие в почве, живут по своим правилам и тоже имеют специальные приспособления, которые касаются формы тела, его покровов, конечностей и других его особенностей.
Приспособления к почве
Покровы тела подземного жителя должны позволять ему беспрепятственно продвигаться в плотной почве как вперед, так и назад (не всегда можно развернуться в узком ходу). Вот некоторые правила для покровов:
слизистые выделения, позволяющие скользить в почве (червь),
если имеется шерсть, то она обычно короткая (крот),
шерсть заглаживается вперед и назад (крот), шерсть устойчива к стиранию (крот).
Форма тела и конечностей тоже должна быть специфической. Длинные конечности не дадут возможности двигаться в узкой норе, кроме того конечности нужны для копания земли. Тело не должно цепляться за своды норы или должно легко изгибаться под прямым или даже острым углом. Отсюда следующие правила:
короткие конечности,
копательные конечности (крот) или копательные зубы (слепушонка),
тело тонкое и длинное (геофил),
обтекаемое тело без выступающих частей (крот).
Специфичность органов чувств землероя – тоже его приспособления к особенностям среды обитания. Они могут быть устроены по таким правилам:
уменьшены или отсутствуют ушные раковины (крот),
уменьшены или отсутствуют глаза (крот),
повышена тактильная чувствительность (вибриссы по всему телу).
Почва плотна и тяжела, а, кроме того, в ней может быть недостаточно воздуха. Эти ее особенности также приводят к физиологическим и анатомическим адаптациям:
устойчивость к недостатку кислорода (асфиксии) система лакун (полостей в которых хранится кровь, насыщенная кислородом);
мощные мышцы и кости, противостоящие сдавливанию (крот).
Жители воздушной среды обитания многообразны по своим приспособлениям, потому что специализированы к слишком различающимся местообитаниям. Так бегающие по твердой почве, совсем не похожи на лазающих, а те и другие очень отличаются от летающих. Поэтому здесь все организмы удобно разделить на подгруппы, обладающие сходными адаптациями к одному и тому же местообитанию.
Приспособления к воздушной среде
Наиболее специфичны среди обитателей воздушной среды, конечно летающие формы. Уже особенности внешности организма позволяют заметить его приспособления к полету. Прежде всего, об этом говорит форма его тела.
Форма тела: обтекаемость тела (птица), наличие плоскостей для опоры на воздух (крылья, парашют), облегченная конструкция (полые кости),
наличие крыльев и иных приспособлений для полета (летательные перепонки, например), облегчение конечностей (укорочение, уменьшение массы мышц).
У бегающих животных тоже появляются отличительные особенности, по которым легко узнать хорошего бегуна, а если он передвигается прыжками, то прыгуна:
мощные, но легкие конечности (лошадь),
уменьшение пальцев на ногах (лошадь, антилопа),
очень мощные задние конечности и укороченные передние (заяц, кенгуру),
защитные роговые копыта на пальцах (копытные, мозоленогие).
Лазающие организмы имеют самые различные приспособления. Они могут быть общими для растений и животных, а могут и различаться. Для лазанья может быть использована и своеобразная форма тела:
тонкое длинное тело, петли которого могут служить опорой при лазании (змея, лиана),
длинные гибкие хватательные или цепляющиеся конечности, а возможно, и такой же хвост (обезьяны);
выросты тела – усики, крючки, корешки (горох, ежевика, плющ);
острые коготки на конечностях или длинные когти, загнутые крючком или сильные хватательные пальцы (белка, ленивец, обезьяна);
мощные мышцы конечностей, позволяющие подтягивать тело и перебрасывать его с ветки на ветку (орангутан, гиббон).
Некоторые организмы приобрели своеобразную универсальность приспособлений сразу к двум. У лазающих форм возможно и сочетание признаков лазанья и полета. Многие из них могут, забравшись на высокое дерево совершать длинные прыжки-полеты. Это сходные приспособления у жителей одной среды обитания. Часто встречаются животные способные к быстрому бегу и полету, одновременно несущие оба набора этих адаптаций. Из насекомых это жуки-скакуны (сем. Жужелицы), из птиц: дрофа, стрепет, коростель.
Встречаются сочетания приспособительных признаков у организма к жизни в различных средах. Такие параллельные наборы адаптаций несут все земноводные животные. Приспособления к полету имеют и некоторые плавающие чисто водные организмы. Вспомним летучих рыб или даже кальмаров.
| Задание: | 1.Рассмотрите гербарные растения растений: крапива жгучая, боярышник колючий, борщевик сибирский, чистяк, гусиный лук, ландыш майский. Определите среду обитания каждого из образцов. Опишите черты приспособленности к условиям среды обитания. Результаты оформите в виде таблицы.
Например
2. По гербарным образцам рассмотрите внешнее строение следующих видов растений и заполните таблицу
Например
3. На основе анализа предложенных рисунков животных опишите их адаптации к определенным средам обитания. Результаты зафиксируйте в таблицу Таблица Адаптация животных Например
5. Соотнесите приведённые примеры приспособлений с их характером.
|
| Содержание отчета: | Составьте отчёт (заполните таблицу, составьте схему) Сделайте и запишите выводы по проделанной работе |
Методические указания по выполнению работы:
Повторите материал по данной теме по конспекту или учебнику
Оформите отчет по работе. Сделайте вывод.
Подготовьтесь к защите работы
Тематика контрольных вопросов:
Приведите примеры приспособленности организмов к условиям существования.
Почему одни животные имеют яркую, демаскирующую окраску, а другие, наоборот, - покровительственную?
В чем сущность мимикрии?
Распространяется ли действие естественного отбора на поведение животных? Приведите примеры.
Каковы биологические механизмы возникновения приспособительной (скрывающей и предупреждающей) окраски у животных?
Являются ли физиологические адаптации факторами, определяющими уровень приспособленности организма в целом?
В чем сущность относительности любого приспособления к условиям обитания? Приведите примеры.
Практическая работа № 5
Анализ и оценка различных гипотез происхождения жизни и человека
Цель: знакомство с различными гипотезами происхождения жизни на Земле.
Общие теоретические сведения
Многообразие теорий возникновения жизни на Земле».
1. Креационизм.
Согласно этой теории жизнь возникла в результате какого-то сверхъестественного события в прошлом. Ее придерживаются последователи почти всех наиболее распространенных религиозных учений.
Традиционное иудейско-христианское представление о сотворении мира, изложенное в Книге Бытия, вызывало и продолжает вызывать споры. Хотя все христиане признают, что Библия — это завет Господа людям, по вопросу о длине «дня», упоминавшегося в Книге Бытия, существуют разногласия.
Некоторые считают, что мир и все населяющие его организмы были созданы за 6 дней по 24 часа. Другие христиане не относятся к Библии как к научной книге и считают, что в Книге Бытия изложено в понятной для людей форме теологическое откровение о сотворении всех живых существ всемогущим Творцом.
Процесс божественного сотворения мира мыслится как имевший место лишь однажды и потому недоступный для наблюдения. Этого достаточно, чтобы вынести всю концепцию божественного сотворения за рамки научного исследования. Наука занимается только теми явлениями, которые поддаются наблюдению, а потому она никогда не будет в состоянии ни доказать, ни опровергнуть эту концепцию.
2. Теория стационарного состояния.
Согласно этой теории, Земля никогда не возникала, а существовала вечно; она всегда способна поддерживать жизнь, а если и изменялась, то очень мало; виды тоже существовали всегда.
Современные методы датирования дают все более высокие оценки возраста Земли, что позволяет сторонникам теории стационарного состояния полагать, что Земля и виды существовали всегда. У каждого вида есть две возможности — либо изменение численности, либо вымирание.
Сторонники этой теории не признают, что наличие или отсутствие определенных ископаемых остатков может указывать на время появления или вымирания того или иного вида, и приводят в качестве примера представителя кистеперых рыб — латимерию. По палеонтологическим данным, кистеперые вымерли около 70 млн. лет назад. Однако это заключение пришлось пересмотреть, когда в районе Мадагаскара были найдены живые представители кистеперых. Сторонники теории стационарного состояния утверждают, что, только изучая ныне живущие виды и сравнивая их с ископаемыми остатками, можно делать вывод о вымирании, да и то он может оказаться неверным. Внезапное появление какого-либо ископаемого вида в определенном пласте объясняется увеличением численности его популяции или перемещением в места, благоприятные для сохранения остатков.
3. Теория панспермии.
Эта теория не предлагает никакого механизма для объяснения первичного возникновения жизни, а выдвигает идею о ее внеземном происхождении. Поэтому ее нельзя считать теорией возникновения жизни как таковой; она просто переносит проблему в какое-то другое место во Вселенной. Гипотеза была выдвинута Ю. Либихом и Г. Рихтером в середине XIX века.
Согласно гипотезе панспермии жизнь существует вечно и переносится с планеты на планету метеоритами. Простейшие организмы или их споры («семена жизни»), попадая на новую планету и найдя здесь благоприятные условия, размножаются, давая начало эволюции от простейших форм к сложным. Возможно, что жизнь на Земле возникла из одной-едидственной колонии микроорганизмов, заброшенных из космоса.
Для обоснования этой теории используются многократные появления НЛО, наскальные изображения предметов, похожих на ракеты и «космонавтов», а также сообщения якобы о встречах с инопланетянами. При изучении материалов метеоритов и комет в них были обнаружены многие «предшественники живого» — такие вещества, как цианогены, синильная кислота и органические соединения, которые, возможно, сыграли роль «семян», падавших на голую Землю.
Сторонниками этой гипотезы были лауреаты Нобелевской премии Ф. Крик, Л. Оргел. Ф. Крик основывался на двух косвенных доказательствах:
• универсальности генетического кода;
• необходимости для нормального метаболизма всех живых существ молибдена, который встречается сейчас на планете крайне редко.Но если жизнь возникла не на Земле, то как она возникла вне ее?
4. Физические гипотезы.
В основе физических гипотез лежит признание коренных отличий живого вещества от неживого. Рассмотрим гипотезу происхождения жизни, выдвинутую в 30-е годы XX века В. И. Вернадским.
Взгляды на сущность жизни привели Вернадского к выводу, что она появилась на Земле в форме биосферы. Коренные, фундаментальные особенности живого вещества требуют для его возникновения не химических, а физических процессов. Это должна быть своеобразная катастрофа, потрясение самих основ мироздания.
В соответствии с распространенными в 30-х годах XX века гипотезами образования Луны в результате отрыва от Земли вещества, заполнявшего ранее Тихоокеанскую впадину, Вернадский предположил, что этот процесс мог вызвать то спиральное, вихревое движение земного вещества, которое больше не повторилось.
Вернадский происхождение жизни осмысливал в тех же масштабах и интервалах времени, что и возникновение самой Вселенной. При катастрофе условия внезапно меняются, и из протоматерии возникают живая и неживая материя.
5. Химические гипотезы.
Эта группа гипотез основывается на химической спе-дифике жизни и связывает ее происхождение с историей Земли. Рассмотрим некоторые гипотезы этой группы.
У истоков истории химических гипотез стояли воззрения Э. Геккеля.Геккель считал, что сначала под действием химических и физических причин появились соединения углерода. Эти вещества представляли собой не растворы, а взвеси маленьких комочков. Первичные комочки были способны к накоплению разных веществ и росту, за которым следовало деление. Затем появилась безъядерная клетка — исходная форма для всех живых существ на Земле.
Определенным этапом в развитии химических гипотез абиогенеза сталаконцепция А. И. Опарина, выдвинутая им в 1922—1924 гг. XX века. Гипотеза Опарина представляет собой синтез дарвинизма с биохимией. По Опарину, наследственность стала следствием отбора. В гипотезе Опарина желаемое выдастся за действительное. Сначала нее особенности жизни сводятся к обмену веществ, а затем его моделирование объявляется решенном загадки возникновения жизни.
Гипотеза Дж. Берпапа предполагает, что абиогенно возникшие небольшие молекулы нуклеиновых кислот из нескольких нуклеотидов могли сразу же соединяться с теми аминокислотами, которые они кодируют. В этой гипотезе первичная живая система видится как биохимическая жизнь без организмов, осуществляющая самовоспроизведение и обмен веществ. Организмы же, по Дж. Берналу, появляются вторично, в ходе обособления отдельных участков такой биохимической жизни с помощью мембран.
В качестве последней химической гипотезы возникновения жизни на нашей планете рассмотрим гипотезу Г. В. Войткевича, выдвинутую в 1988 году. Согласно этой гипотезе, возникновение органических веществ переносится в космическое пространство. В специфических условиях космоса идет синтез органических веществ (многочисленные орпанические вещества найдены в метеоритах — углеводы, углеводороды, азотистые основания, аминокислоты, жирные кислоты и др.). Не исключено, что в космических просторах могли образоваться нуклеотиды и даже молекулы ДНК. Однако, по мнению Войткевича, химическая эволюция на большинстве планет Солнечной системы оказалась замороженной и продолжилась лишь на Земле, найдя там подходящие условия. При охлаждении и конденсации газовой туманности на первичной Земле оказался весь набор органических соединений. В этих условиях живое вещество появилось и конденсировалось вокруг возникших абиогенно молекул ДНК. Итак, по гипотезе Войткевича первоначально появилась жизнь биохимическая, а в ходе ее эволюции появились отдельные организмы.
| Задание: | 1. Прочитать текст «Многообразие теорий возникновения жизни на Земле». Заполнить таблицу: Теории и гипотезы
|
| Содержание отчета: | Составьте отчёт (заполните таблицу) Написать эссе Сделайте и запишите выводы по проделанной работе |
Методические указания по выполнению работы:
Повторите материал по данной теме по конспекту или учебнику
Оформите отчет по работе. Сделайте вывод.
Подготовьтесь к защите работы
Тематика контрольных вопросов:
1. Написать эссе. Какой теории придерживаетесь вы лично? Почему?
Практическая работа № 6
Тема: Составление схем передачи веществ и энергии. Решение экологических задач
Цель: сформировать знания о цепях и сетях питания, о правиле экологической пирамиды, научиться составлять схемы передачи веществ и энергии.
Оборудование: рисунки различных биоценозов, таблицы, схемы пищевых цепей в разных экосистемах.
Общие теоретические сведения
Пищевые сети и цепи. Существование любого биоценоза возможно только при постоянном притоке энергии. По существу, вся жизнь на Земле существует за счет энергии солнечного излучения, которая переводится фотосинтезирующими организмами в химические связи органических веществ. Гетеротрофы получают энергию с пищей. Все живые существа являются объектами питания других живых существ, то есть связаны между собой энергетическими отношениями. Пищевые связи в сообществах — это механизм передачи энергии от одного организма к другому или другим.
В каждом сообществе трофические связи переплетены в сложную сеть, так как организмы любого вида являются потенциальными объектами для пищи многих других видов. Например, врагами тлей служат личинки и жуки божьих коровок, личинки мух, пауки, насекомоядные птицы и многие другие животные. За счет дубов в лиственных лесах могут жить несколько сотен форм различных членистоногих, фитонематод, паразитических грибков и т.д.; хищники обычно легко переключаются с одного вида на другой. Некоторые хищники могут потреблять в определенной мере и растительную пищу. Трофические сети в биоценозах очень сложны. Однако первое впечатление о том, что энергия в трофических сетях может долго мигрировать от одного организма к другому, обманчиво. На самом деле путь каждой конкретной порции энергии, накопленной растениями, короток, он может передаваться не более, чем через 4 — 5 звеньев, состоящих из последовательно питающихся друг другом организмов. Устойчивые цепи взаимосвязанных видов, последовательно извлекающих материалы и энергию из исходного пищевого вещества, называются цепями питания. Место каждого звена в цепи питания называют трофическим уровнем. Первый трофический уровень — это всегда продуценты, растения, создатели органического вещества, биомассы; второй трофический уровень составляют травоядные животные — потребители или консументы 1 порядка; потребители травоядных животных — плотоядные — составляют следующий трофический уровень, являются консументами 2 порядка; потребители плотоядных форм относятся к консументам 3 порядка и т.д. по трофической цепи. При этом имеет значение пищевая специализация организмов-консументов. Виды с широким спектром питания могут включаться в пищевую цепь на различных трофических уровнях. Например, человек в рацион которого входят и растительная и животная пища, может явиться в разных пищевых цепях консументом первого, второго и третьего порядков. Количество энергии, расходуемой на поддержание собственной жизнедеятельности, в цепи трофических уровней растет, а продуктивность падает. Энергетический баланс консументов складывается следующим образом. Поглощенная пища обычно усваивается не полностью. Неусвоенная пища вновь возвращается во внешнюю среду в виде экскрементов и в последующем может быть вовлечена в другие цепи питания. Процент усвояемости зависит от состава пищи и набора пищеварительных ферментов организма. У животных усвояемость варьирует от 12 — 20% (некоторые сапрофаги) до 75% у плотоядных видов. Большая часть энергии усвоенной пищи используется на поддержание физиологических процессов в организме, а продукты обмена удаляются из организма в составе мочи, пота, выделений желез и углекислого газа, образующегося при дыхании. Энергетические затраты на поддержание метаболических процессов в организме называют тратой на дыхание. Меньшая часть усвоенной энергии идет собственно на ассимиляцию, то есть на образование тканей, биомассы самого организма или на запасание питательных веществ. Обычно продуктивность каждого последующего трофического уровня не более, как уже было сказано, 5 — 20% от продуктивности предыдущего. Траты на дыхание во много раз больше энергетических затрат на увеличение массы организма. Конкретные соотношения зависят от стадии развития и физиологического состояния особей. У молодых траты на рост достигают больших величин, тогда как взрослые особи используют энергию пищи в основном на поддержание обмена веществ и созревание половых клеток.
Таким образом, большая часть энергии в цепи питания при переходе с одного уровня на другой теряется. К следующему звену в цепи питания поступает только та энергия, которая заключена в массе предыдущего поедаемого звена. Потери энергии составляют около 90% при каждом переходе через трофическую цепь. Например, если энергия растительного организма составляет 1000 Дж, то при полном поедании его травоядным животным в теле последнего ассимилируется всего 100 Дж, в теле хищника 10 Дж, а если этот хищник будет съеден другим, то в его теле ассимилируется только 1 Дж энергии, то есть 0,1%. В результате энергия, накопленная зелеными растениями в цепях питания, стремительно иссякает. Поэтому пищевая цепь не может включать более 4 — 5 звеньев. Потерянная в цепях питания энергия может быть восполнена только за счет поступления новых ее порций. В экосистемах не может быть круговорота энергии, подобно круговороту веществ. Жизнь и функционирование любой экологической системы возможны только при односторонне направленном потоке энергии в виде солнечного излучения или при притоке запасов готового органического вещества.
Пищевая (трофическая) цепь —ряд взаимоотношений между группами организмов (растений,животных, грибов и микроорганизмов) при котором происходит перенос энергии путём поедания одних особей другими.
Организмы последующего звена поедают организмы предыдущего звена, и таким образом осуществляется цепной перенос энергии и вещества, лежащий в основе круговорота веществ в природе. При каждом переносе от звена к звену теряется большая часть (до 80–90 %) потенциальной энергии, рассеивающейся в виде тепла. По этой причине число звеньев (видов) в цепи питания ограничено и не превышает обычно 4–5.
Правило 10% (закон Линдемана) - это правило экологической пирамиды. Оно гласит: На каждое последующее звено пищевой цепи поступает только 10% энергии (массы), накопленной предыдущим звеном.Применяется так: у нас есть какая-то пищевая цепочка:трава – кузнечики – лягушка – цапля. И вопрос " Сколько травы было съедено на лугу, если прибавка в весе цапли, которая питалась лягушками на этом лугу, составила 1 кг? "(при этом имеется в виду, что ничем другим она не питалась, а лягушки ели только кузнечиков, а кузнечики только эту травку). Получается, что этот 1 кг и есть 10% от общей массы лягушек, значит, их масса равна была 10кг, тогда масса кузнечиков-100 кг, а масса съеденной травы составила целую тонну.
Экологическая пирамида. Правило экологической пирамиды
Экологическая пирамида — это графическое изображение потерь энергии в цепях питания. Цепи питания — это устойчивые цепи взаимосвязанных видов, последовательно извлекающих материалы и энергию из исходного пищевого вещества, сложившиеся в ходе эволюции живых организмов и биосферы в целом. Они составляют трофическую структуру любого биоценоза, по которой осуществляются перенос энергии и круговороты веществ. Пищевая цепь состоит из ряда трофических уровней, последовательность которых соответствует потоку энергии. Первичным источником энергии в цепях питания является солнечная энергия. Первый трофический уровень — продуценты (зеленые растения) — используют солнечную энергию в процессе фотосинтеза, создавая первичную продукцию любого биоценоза. При этом только 0,1% солнечной энергии используется в процессе фотосинтеза. Более половины энергии, связанной при фотосинтезе, тут же расходуется растениями в процессе дыхания, остальная часть энергии переносится далее по пищевым цепям. При этом действует важная закономерность, связанная с эффективностью использования и превращения энергии в процессе питания. Сущность ее заключается в следующем: количество энергии, расходуемой на поддержание собственной жизнедеятельности, в цепях питания растет от одного трофического уровня к другому, а продуктивность падает. Обычно продуктивность второго трофического уровня составляет не более 5 - 20% (10%) предыдущего уровня. Это находит отражение в соотношении на планете биомасс растительного и животного происхождения. Объем энергии, необходимой для обеспечения жизнедеятельности организма, растет с повышением уровня морфофункциональной организации. Соответственно, количество биомассы, создаваемой на более высоких трофических уровнях, снижается. Всем без исключения экосистемам свойственны определенные соотношения первичной и вторичной продукции. Всегда количество растительного вещества, служащего основой цепи питания, в несколько раз (около 10 раз) больше, чем общая масса растительноядных животных, а масса каждого последующего звена пищевой цепи, соответственно, пропорционально изменяется. Снижение количества доступной энергии на каждом последующем трофическом уровне сопровождается снижением биомассы и численности особей. Графически экологическую пирамиду изображают в виде нескольких прямоугольников одинаковой высоты, но разной длины. Длина прямоугольника уменьшается от нижнего к верхнему соответственно уменьшению продуктивности на последующих трофических уровнях. Нижний треугольник самый большой по длине и соответствует первому трофическому уровню - продуцентам, второй - приблизительно в10 раз меньше и соответствует второму трофическому уровню — растительноядным животным, потребителям первого порядка и т.д.
Основные экологические проблемы современности
1.Загрязнение атмосферы
Причины экологической проблемы. Загрязнение атмосферы – экологическая проблема, не понаслышке знакомая жителям абсолютно всех уголков земли. Особенно остро её ощущают представители городов, в которых функционируют предприятия чёрной и цветной металлургии, энергетики, химической, нефтехимической, строительной и целлюлозно-бумажной промышленности. В некоторых городах атмосферу также сильно отравляют автотранспорт и котельные. Всё это примеры антропогенного загрязнения воздуха. Что же касается естественных источников химических элементов, загрязняющих атмосферу, то к ним относятся лесные пожары, извержения вулканов, ветровые эрозии (развеивание почв и частиц горных пород), распространение пыльцы, испарения органических соединений и естественная радиация.
Последствия загрязнения атмосферы. Атмосферное загрязнение воздуха отрицательно сказывается на здоровье человека, способствуя развитию сердечных и лёгочных заболеваний (в частности, бронхита). Кроме того, такие загрязнители атмосферы как озон, оксиды азота и диоксид серы разрушают естественные экосистемы, уничтожая растения и вызывая смерть живых существ (в частности, речной рыбы).
Решение экологической проблемы. Глобальную экологическую проблему загрязнения атмосферы, по словам учёных и представителей власти, можно решить следующими путями:
ограничение роста численности населения;
сокращение объёмов использования энергии;
повышение энергоэффективности;
уменьшение отходов;
переход на экологически чистые возобновляемые источники энергии;
очистка воздуха на особо загрязнённых территориях.
2. Глобальное потепление
Причины глобального потепления. В течение XX века средняя температура на земле выросла на 0,5 – 1C. Главной причиной глобального потепления считается повышение концентрации углекислого газа в атмосфере вследствие увеличения объёмов сжигаемого людьми ископаемого топлива (уголь, нефть и их производные). Другими предпосылками глобального потепления являются перенаселение планеты, сокращение площади лесных массивов, истощение озонового слоя и замусоривание. Однако не все экологи возлагают ответственность за повышение среднегодовых температур целиком на антропогенную деятельность. Некоторые считают, что глобальному потеплению способствует и естественное увеличение численности океанического планктона, приводящее к повышению концентрации всё того же углекислого газа в атмосфере.
Последствия парникового эффекта. Если температура в течение XXI века увеличится ещё на 1 C – 3,5 C, как прогнозируют учёные, последствия будут весьма печальными:
поднимется уровень мирового океана (вследствие таяния полярных льдов), возрастёт количество засух и усилится процесс опустынивания земель,
исчезнут многие виды растений и животных, приспособленные к существованию в узком диапазоне температур и влажности,
участятся ураганы.
Решение экологической проблемы. Замедлить процесс глобального потепления, по словам экологов, помогут следующие меры:
повышение цен на ископаемые виды топлива,
замена ископаемого топлива экологически чистым (солнечная энергия, энергия ветра и морских течений),
развитие энергосберегающих и безотходных технологий,
налогообложение выбросов в окружающую среду,
минимизация потерь метана во время его добычи, транспортировки по трубопроводам, распределения в городах и сёлах и применения на станциях теплоснабжения и электростанциях,
внедрение технологий поглощения и связывания углекислого газа,
посадка деревьев,
уменьшение размеров семей,
экологическое просвещение,
применение фитомелиорации в сельском хозяйстве.
3. Загрязнение воды
Причины экологической проблемы. Главными загрязнителями гидросферы на сегодняшний день являются нефть и нефтепродукты. В воды мирового океана эти вещества проникают в результате крушения танкеров и регулярных сбросов сточных вод промышленными предприятиями. Помимо антропогенных нефтепродуктов, индустриальные и бытовые объекты загрязняют гидросферу тяжёлыми металлами и сложными органическими соединениями. Лидерами по отравлению вод мирового океана минеральными веществами и биогенными элементами признаются сельское хозяйство и пищевая промышленность. Не обходит стороной гидросферу и такая глобальная экологическая проблема как радиоактивное загрязнение. Предпосылкой её формирования послужило захоронение в водах мирового океана радиоактивных отходов. Многие державы, обладающие развитой атомной промышленностью и атомным флотом, с 49 по 70-й годы XX века целенаправленно складировали в моря и океаны вредные радиоактивные вещества. В местах захоронения радиоактивных контейнеров нередко и сегодня зашкаливает уровень цезия. Воды морей и океанов обогащаются радиацией и в результате подводных и надводных ядерных взрывов.
Последствия радиоактивного загрязнения воды. Нефтяное загрязнение гидросферы приводит к разрушению естественной среды обитания сотен представителей океанической флоры и фауны, гибели планктона, морских птиц и млекопитающих. Для здоровья человека отравление вод мирового океана также представляет серьёзную опасность: «заражённая» радиацией рыба и прочие морепродукты могут запросто попасть к нему на стол.
| Задание: | 1. Прочитать текст общие теоретические сведения. 2. Заполнить таблицу «Сравнение природных и искусственных экосистем»
|
3.Назовите организмы, которые должны быть на пропущенном
месте следующих пищевых цепей:
 ёё
ёё
Из предложенного списка живых организмов составить трофическую сеть: трава, ягодный кустарник, муха, синица, лягушка, уж, заяц, волк, бактерии гниения, комар, кузнечик. Укажите количество энергии, которое переходит с одного уровня на другой.
Зная правило 10%, рассчитайте сколько нужно травы, чтобы вырос один орел массой 5кг (пищевая цепь: трава – заяц – орел). Условно принимайте, что на каждом трофическом уровне всегда поедаются только представители предыдущего уровня.
Прочитать текст «Основные экологические проблемы современности»
Заполните таблицу:
| Экологические проблемы | Причины | Пути решения экологических проблем |
| | | |
| Содержание отчета: | Составьте отчёт (заполните таблицу) Сделайте и запишите выводы по проделанной работе |
Методические указания по выполнению работы:
Повторите материал по данной теме по конспекту или учебнику
Оформите отчет по работе. Сделайте вывод.
Подготовьтесь к защите работы
Тематика контрольных вопросов:
1. что отражают правила экологических пирамид?
Практическая работа № 7
Тема: Решение экологических задач
Цель: создать условия для формирования умений решать простейшие экологические задачи.
Оборудование и материалы: фотографии, статьи о различных глобальных экологических проблемах
Общие теоретические сведения
| Задание: | |
| Экологические проблемы | Причины | Пути решения экологических проблем |
| | | |
Сформулируйте вывод. Ответить на вопрос: Какие экологические проблемы, по вашему мнению наиболее серьезные и требуют немедленного решения? Почему?
Задача.1.1м2 площади экосистемы дает 800 г сухой биомассы за год. Построить цепь питания (4 трофических уровня) и определить, сколько гектаров необходимо, чтобы прокормить человека массой 70 кг ( из них 63% составляет вода).
РЕШЕНИЕ
| Дано: m – 70 кг (из них 63% - вода); 1м2 - 800 г/год (биопродуктивность); цепь питания: растения → консументы→ I порядка → консументы→ II порядка → человек | Определяем процент органического вещества в теле человека: 70 кг • 0,37 = 25,9 кг Определяем количество биомассы в первом звене цепи питания: растения→консументы →консументы → человек. 26000 кг 2600 кг 260 кг 26 кг Определяем, сколько гектаров экосистемы могут прокормить человека на протяжении года: 1 м2 – 0,8 кг х - 26000 кг Ответ. Необходимо 3,25 га. |
| |
Задача 2. Пользуясь правилом экологической пирамиды, определите, какая площадь (в гектарах) соответствующей экосистемы может прокормить одну особь последнего звена в цепи питания:
А) планктон→рыба→тюлень (300 кг). Сухая биомасса планктона с 1м2 моря составляет 600г. Из указанной в скобках массы 60% составляет вода.
| Дано: Планктон→рыба→тюлень Планктон с 1м2 = 600г. | РЕШЕНИЕ Определяем сухую массу тела тюленя: m =300 • 0,4 = 120 кг Пользуясь правилом экологической пирамиды, определяем массу планктона: планктон → рыба →тюлень Площадь моря, которая может прокормить одного тюленя: х = 12000 /0,6 =20000 м2 Ответ. Необходимо 2 га моря |
| Определить:S моря на 1 тюленя |
Задача 3. На основании правила экологической пирамиды определите, сколько необходимо планктона ( водорослей и бактерий), чтобы в Черном море вырос и мог обитать один дельфин массой 300 кг.
РЕШЕНИЕ.
Зная, что в каждом следующем уровне экологической пирамиды сохраняется 10% вещества и энергии, можно определить массу рыбы, необходимой для существования дельфина.
Пищевая цепь:
Планктон → рыба нехищная → хищная рыба → дельфин
300000 кг 30000 кг 3000 кг 300 кг
Ответ. Чтобы в Черном море вырос и мог обитать 1 дельфин массой 300 кг, необходимо 300000 кг или 300 т планктона.
Самостоятельное решение задач.
Задача №1.
Зная правило десяти процентов, рассчитайте, сколько нужно травы, чтобы вырос один орел весом 5 кг (пищевая цепь: трава – заяц – орел). Условно принимайте, что на каждом трофическом уровне всегда поедаются только представители предыдущего уровня.
Задача №2.
На территории площадью 100 км2 ежегодно производили частичную рубку леса. На момент организации на этой территории заповедника было отмечено 50 лосей. Через 5 лет численность лосей увеличилась до 650 голов. Еще через 10 лет количество лосей уменьшилось до 90 голов и стабилизировалось в последующие годы на уровне 80-110 голов.
Определите численность и плотность поголовья лосей:
а) на момент создания заповедника;
б) через 5 лет после создания заповедника;
в) через 15 лет после создания заповедника.
Тематика контрольных вопросов:
1. что отражают правила экологических пирамид?
2. Решить задачу
Общее содержание углекислого газа в атмосфере Земли составляет 1100 млрд т. Установлено, что за один год растительность ассимилирует почти 1 млрд т углерода. Примерно столько же его выделяется в атмосферу. Определите, за сколько лет весь углерод атмосферы пройдет через организмы (атомный вес углерода –12, кислорода – 16).
Практическая работа № 9
Взаимодействие металлов с растворами кислот и солей
Цели работы
научиться определять реакцию среды растворов солей различных типов;
исследовать растворов различных солей на протекание реакций гидролиза;
отработать навыки экспериментальной работы, соблюдая правила техники безопасности при работе в кабинете химии;
отработать навыки составления уравнений реакций гидролиза и делать выводы.
Реактивы и оборудование
растворы солей: карбонат калия, карбонат натрия, нитрат калия, сульфат алюминия, сульфат железа (III), сульфат меди (II), хлорид железа (III), хлорид натрия, хлорид цинка, гидроксид натрия, железо (гвоздь);
штатив с пробирками, предметные стёкла, пипетка, стеклянная палочка.
Общие теоретические сведения
Солями называются сложные вещества, молекулы которых, состоят из атомов металлов и кислотных остатков (иногда могут содержать водород). Например, NaCl – хлорид натрия, СаSO4 – сульфат кальция и т. Д.
Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла:
Na+Cl– – хлорид натрия
Ca2+SO42– – сульфат кальция и т.д.
Соль является продуктом частичного или полного замещения металлом атомов водорода кислоты. Отсюда различают следующие виды солей:
1.Средние соли– все атомы водорода в кислоте замещены атомами металлов:
Например: Na2CO3, KNO3 и т.д.
2. Кислые соли – не все атомы водорода в кислоте замещены металлом. Разумеется, кислые соли могут образовывать только двух- или многоосновные кислоты. Одноосновные кислоты кислых солей давать не могут: NaHCO3, NaH2PO4 ит. Д.
3. Двойные соли – атомы водорода двух- или многоосновной кислоты замещены не одним металлом, а двумя различными: NaKCO3, Kal(SO4)2 и т.д.
4. Соли основные можно рассматривать как продукты неполного, или частичного, замещения гидроксильных групп оснований кислотными остатками: Аl(OH)SO4 , Zn(OH)Cl и т.д.
Химические свойства солей
Химические свойства солей определяются свойствами катионов и анионов, которые входят в их состав.
5.Некоторые соли разлагаются при прокаливании:
CaCO3 = CaO + CO2↑
5.Взаимодействуют с кислотамис образованием новой соли и новой кислоты. Для осуществление этой реакции необходимо, чтобы кислота была более сильная чем соль, на которую воздействует кислота:
2NaCl + H2 SO4 → Na2SO4 + 2HCl↑.
5.Взаимодействуют с основаниями, образуя новую соль и новое основание:
Ba(OH)2 + Mg SO4 → BaSO4↓ + Mg(OH)2.
5.Взаимодействуют друг с другомс образованием новых солей:
NaCl + AgNO3 → AgCl + NaNO3 .
5. Взаимодействуют с металлами, которые стоят в раду активности до металла, который входит в состав соли:
Fe + CuSO4 → FeSO4 + Cu↓.
Экспериментальная часть
ОПЫТ 1. ВЗАИМОДЕЙСТВИЕ СОЛЕЙ С МЕТАЛЛАМИ.
В одну пробирку влейте 2-3мл раствора нитрата серебра, во вторую – 2-3мл раствора сульфата меди (II), а в третью – столько же раствора нитрата свинца (II). В первую пробирку положите тонкую медную проволоку, во вторую – железо, в третью – медные стружки. Что наблюдаете? Напишите уравнения соответствующих реакций.
ОПЫТ 2. ВЗАИМОДЕЙСТВИЕ СОЛЕЙ С КИСЛОТАМИ.
В одну пробирку налейте 3-4 мл раствора хлорида бария, в другую – нитрата свинца. В каждую из них добавьте столько же серной кислоты. Встряхните содержимое пробирок. Что наблюдаете? Составьте молекулярные и ионные уравнения реакций.
ОПЫТ 3. ВЗАИМОДЕЙСТВИЕ СОЛЕЙ ДРУГ С ДРУГОМ.
В одну пробирку влейте 2-3 мл раствора нитрата серебра, во вторую – 2-3мл раствора хлорида бария, а в третью – столько же раствора хлорида меди. В первую пробирку прилейте хлорид натрия, во вторую – карбонат натрия, в третью – сульфид натрия. Что наблюдаете? Напишите уравнения соответствующих реакций в молекулярном и ионном полном и сокращенном виде.
Контрольные вопросы
1. Что такое соли?
2. На какие типы делятся соли? Приведите примеры.
3. К какому типу реакций относится взаимодействие солей с металлами?
4. Напишите графические формулы следующих оснований: CuSO4, FeCl3, Mn(NO3)2.
5. Проделайте реакции, которые выражаются следующими ионными уравнениями:
а) Ag+ + Cl- =AgCl↓
б) Hg2+ + SО42- = HgSО4↓
Напишите уравнения соответствующих реакций в молекулярном виде.
Практическая работа № 10
Испытание растворов щелочей индикаторами. Взаимодействие щелочей с солями. Разложение нерастворимых оснований
Цель работы
Изучить основания, как важнейший класс соединений их свойства;
провести реакции, которые характерны для оснований;
работать в лаборатории с соблюдением правил ТБ;
Приборы и реактивы
растворы: раствор гидроксида натрия; растворы индикаторов: фенолфталеина, метилоранжа, лакмуса; растворы солей: сульфат меди (II); держатель, прибор для нагревания, спички, фарфоровая чашка, кювета для капельного анализа , пипетка, стеклянная палочка, универсальная индикаторная бумага.
Общие теоретические сведения
Основаниями называются вещества, в которых атомы металла связаны с гидрокси-группами.
Химические свойства оснований
Химические свойства оснований характеризуются отношением их к кислотам, ангидридам кислот и солям.
1. Действуют на индикаторы. Индикаторы меняют свою окраску в зависимости от взаимодействия с разными химическими веществами. В нейтральных растворах – они имеют одну окраску, в растворах кислот – другую. При взаимодействии с основаниями они меняют свою окраску: индикатор метиловый оранжевый окрашивается в жёлтый цвет, индикатор лакмус – в синий цвет, а фенолфталеин становится цвета фуксии.
2.Взаимодействуют с кислотными оксидами с образованием соли и воды:
2NaOH + SiO2 → Na2SiO3 + H2O.
5.Вступают в реакцию с кислотами, образуя соль и воду. Реакция взаимодействия основания с кислотой называется реакцией нейтрализации, так как после её окончания среда становится нейтральной:
2KOH + H2SO4 → K2SO4 + 2H2O.
5.Реагируют с солями, образуя новые соль и основание:
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4.
5.Способны при нагревании разлагаться на воду и основной оксид:
Cu(OH)2 = CuO + H2O.
Экспериментальная часть
ОПЫТ 1. ИСПЫТАНИЕ РАСТВОРОВ ЩЕЛОЧЕЙ ИНДИКАТОРАМИ.
К 6-7 каплям раствора щелочи прилейте 2-3 капли индикатора метилового оранжевого. Как изменился цвет? Испытайте раствор щелочи другими индикаторами. Заполните таблицу, которая предлагается ниже.
| Щелочь | Цвет индикатора | | |||
| метиловый оранжевый | фенолфталеин | универсальная индикаторная бумага | | ||
|
|
|
|
| ||
ОПЫТ 2. ВЗАИМОДЕЙСТВИЕ ЩЕЛОЧЕЙ С СОЛЯМИ.
В одну пробирку налейте 3-4 мл раствора хлорида меди (II) или сульфата меди (II), в другую – нитрат никеля (II). Добавьте в обе пробирки столько же гидроксида натрия. Встряхните содержимое пробирок. Что наблюдаете? Составьте молекулярные и ионные уравнения реакций.
ОПЫТ 3. РАЗЛОЖЕНИЕ НЕРАСТВОРИМЫХ ОСНОВАНИЙ.
Возьмите одну стеклянную лопаточку гидроксида меди (II), поместите в сухую пробирку, которую укрепите наклонно в лапке металлического штатива. Вначале подогрейте всю пробирку, а затем нагревайте то место, где находится гидроксид меди (II). Что наблюдаете на стенках пробирки? Какого цвета получается твердое вещество? Напишите уравнение реакции.
ОПЫТ 4. ВЗАИМОДЕЙСТВИЕ НЕРАСТВОРИМЫХ ОСНОВАНИЙ С КИСЛОТАМИ.
На дно двух пробирок поместите с помощью стеклянной лопаточки: в одну - гидроксид меди (II), в другую – гидроксид железа (III). К гидроксиду меди (II) прилейте 10 капель раствора соляной кислоты, а к гидроксиду железа (III) – столько же по объему раствора серной кислоты. Какого цвета образуются растворы?
На стеклянную пластинку поместите по 1-2 капли каждого раствора и осторожно выпарите их до появления первых кристаллов. Напишите уравнения проделанных реакций.
Контрольные вопросы
1. Дайте определение основаниям исходя из их состава.
2.Дайте определения основаниям с точки зрения теории электролитической диссоциации.
3. Даны растворы двух веществ. Как можно практически доказать, что одно из них является раствором щелочи.
4. К какому типу реакций относится взаимодействие оснований с солями?
5. Напишите графические формулы следующих оснований: Cu(OH)2, Fe(OH)3, Mn(OH)2, Co(OH)3.
6. Проделайте реакции, которые выражаются следующими ионными уравнениями:
а) Fe3+ + 3OH- =Fe(OH)3↓
б) Cо2+ + 2OH- =Cо(OH)2↓
Напишите уравнения соответствующих реакций в молекулярном виде.
Практическая работа № 11
Изучение растворимости спиртов в воде. Окисление спиртов различного строения хромовой смесью. Получение диэтилового эфира. Получение глицерата меди
Цель работы:: Изучить растворимость спиртов в воде. Провести реакции окисления спиртов различного строения хромовой смесью, получить диэтиловый эфир и глицерат меди.
Оборудование и реактивы: конспект лекций, методические указания по выполнению работы, инструкции по технике безопасности; штатив с пробирками, дистиллированная вода, этанол, глицерин, сульфат меди (II), раствор гидроксида натрия, серной кислоты
Общие теоретические сведения: Спиртами называются производные углеводородов, содержащие одну или несколько гидроксильных групп. В зависимости от числа гидроксильных групп спирты бывают одно- или многоатомные. Двухатомные спирты называют диодами или гликолами. Трехатомные спирты носят название триоды или глицерины.
Спиртами алхимики называли летучие вещества (от лат. spiritus — дух). Винным спиртом был назван летучий продукт, выделяющийся при получении вина. Винный спирт был выделен при получении вина в средние века, но его состав был установлен только в IX в.
В зависимости от того, при каком атоме углерода, первичном, вторичном или третичном, находятся гидроксильные группы, различают первичные, вторичные и третичные спирты:
Введение гидроксильной группы в молекулу углеводорода оказывает влияние на физические, химические и фармакологические свойства вещества. Так, гидроксильная группа повышает растворимость вещества в воде. Действительно, спирты, особенно низшие, хорошо растворяются в воде. С увеличением длины углеродной цепи растворимость уменьшается. Как правило, вторичные спирты более растворимы, чем первичные, а третичные — более растворимы, чем вторичные. Закономерно изменяется и температура кипения спиртов: она возрастает от первичных спиртов к третичным. Температуры кипения многоатомных спиртов выше за счет увеличения числа межмолекулярных водородных связей.
Химические свойства спиртов определяются их функциональной группой — гидроксильной группой —ОН. Спирты являются слабыми ОН-кислотами. Поэтому щелочные металлы вытесняют из спиртов водород:
2R-0H + 2Na — 2R-0Na + H2t
Алкоголят
натрия
Образующиеся алкоголяты легко гидролизуются:
R-ONa + Н20 -*■ ROH + NaOH
С увеличением числа ОН-групп кислотные свойства спиртов возрастают, что связано с высокой электроотрицательностью кислорода и ослаблением О—Н-связи соседнего гидроксила в помолах.
Спирты при нагревании в присутствии концентрированной серной кислоты могут вступать в реакцию внутримолекулярной дегидратации.
А1203, 300-400 °с
СН3СН2СН2ОН -.... но------------ СН3СН=СН2
В более мягких условиях (температура 170 °С, каталитические количества H2S04) образуются простые эфиры:
H2S04; 170 X
2СН3СН2СН2ОН - -:^о ■ СН3СН2СН2ОСН2СН2СН3
При взаимодействии спиртов с карбоновыми кислотами (лучше в присутствии следов сильных минеральных кислот) получаются сложные эфиры.
ROH + R'COOH -3- R'COOR + Н20
Реакция образования сложных эфиров носит название реакции этерификации: вода в присутствии кислот или щелочей разлагает сложные эфиры с образованием исходных веществ — кислоты и спирта. Эта реакция обратима.
Первичные и вторичные спирты легко окисляются, причем при окислении первичных спиртов образуются альдегиды, которые окисляются в карбоновые кислоты:
Вторичные спирты окисляются до кетонов.
Для окисления применяют соединения марганца(ІV), марганца(VII), хрома(VI).
Третичные спирты окисляются с большим трудом.
Введение гидроксильной группы в молекулу углеводорода придает соединению сладкий вкус. Это свойство особенно выражено у спиртов с большим числом гидроксильных групп. Например, этиловый спирт С2Н5ОН не имеет сладкого вкуса, глицерин (трехатомный спирт) имеет сладковатый вкус, маннит (шестиатомный спирт) близок по сладости к сахарам.
Введение гидроксильной группы в молекулу углеводорода значительно повышает его физиологическую активность (в данном случае наркотические свойства вещества), но увеличение числа гидроксильных групп ведет к уменьшению активности. Например, в отличие от этилового спирта этиленгликоль, глицерин и маннит практически не имеют наркотических свойств.
Кроме того, на физиологическую активность спиртов оказывают влияние следующие факторы:
длина углеродной цепи — физиологическое действие и токсичность нормальных первичных спиртов возрастают с удлинением углеродной цепи до 6 — 8 атомов, а затем уменьшаются;
разветвление углеродной цепи — физиологическая активность спиртов усиливается с разветвлением углеродной цепи. Например, изобутиловый спирт более активен, чем нормальный бутиловый;
положение гидроксильной группы в молекуле — вторичные спирты оказывают более сильное наркотическое действие, чем первичные спирты, а третичные, в свою очередь, более активны, чем вторичные. Например, изопропиловый спирт почти в 2 раза активнее нормального пропилового;
наличие непредельной связи в молекуле-, спирты, имеющие в молекуле непредельные связи, обладают более сильными наркотическими свойствами; при этом повышается токсичность спирта;
введение галогенов в молекулу спирта-, физиологическое действие спиртов, имеющих в молекуле галогены, усиливается. Например, трибромэтанол СВг3СН2ОН обладает гораздо большей активностью, чем этанол.
В медицинской и фармацевтической практике большое значение имеют одноатомный спирт — этанол и трехатомный спирт — глицерин.
Спирт этиловый
Получение. Синтетический этиловый спирт получают парофазной или жидкофазной гидратацией этилена:
Значительное количество этилового спирта получают из отходов лесной промышленности, так называемый гидролизный спирт.
При получении спирта брожением пищевого сырья, содержащего крахмал зерновых культур, картофеля, к нему добавляют солод — измельченные проросшие зерна ячменя. Содержащийся в солоде фермент амилаза катализирует превращение крахмала в мальтозу:
Амилаза
2(C6HioOs)„ + лН20---------- ► лС12Н220ц
Далее под влиянием фермента мальтозы дрожжей дисахарид мальтоза превращается в глюкозу:
Мальтаза___
С12Н220„ + Н20----------- 2С6Ні20б
Глюкоза под влиянием зимазы дрожжей дает конечные продукты брожения — спирт и углекислый газ:
Зимаза .
С6Н1206 --------- 2С2Н5ОН + 2С02Т
Для брожения наиболее благоприятна температура 25 — 30 °С.
Конец процесса брожения определяется по прекращению выделения углекислого газа: при этом первоначально получается так называемая бражка, содержащая около 10—14% спирта. Бражку подвергают дробной перегонке. В результате первой пере
гонки получается 70 % спирт. После его вторичной перегонки получают уже 95—96 % спирт, называемый спиртом-сырцом. В нем содержатся различные побочные продукты, образующиеся в процессе брожения — уксусный альдегид, смесь высших спиртов и карбоновых кислот, называемая сивушными маслами, и небольшие количества глицерина и янтарной кислоты. Сивушные масла придают спирту неприятный запах и образуются в спирте в результате действия дрожжей на белки исходных продуктов брожения — плодов или зерен.
Спирт, предназначенный для медицинских целей, очищают в первую очередь от сивушных масел, придающих ему токсичность. Фильтруют спирт через активированный уголь, который адсорбирует эту примесь. Полученный спирт подвергают дробной перегонке (ректификация) в ректификационных аппаратах.
Более специфичная реакция на спирт — это реакция образования сложных эфиров. Так, при взаимодействии спирта с ледяной уксусной кислотой в присутствии концентрированной серной кислоты образуется уксусно-этиловый эфир, обладающий своеобразным запахом:
С2Н5ОН + СН3СООН ^ СН3СООС2Н5 + Н20
Спирт можно окислить дихроматом калия в присутствии серной кислоты до уксусного альдегида. При этом ощущается запах уксусного альдегида, напоминающий запах свежих яблок:
ЗСН3СН2ОН + К2Сг207 + 4H2S04 ЗСН3СНО + Cr2(S04)3 + K2S04 + 7Н20
| Задание: | Опыт 1 Растворимость спиртов в воде В отдельные пробирки прилейте по 1—2 мл этилового и изоамилового (изопентилового) спиртов. Добавьте к ним по 2—3 мл воды и взболтайте. Отметьте, что этиловый спирт полностью растворился в воде, а изоамиловый спирт отделяется при отстаивании в виде маслянистого слоя над водой. Опыт 2 Получение глицерата меди В пробирку налейте около 1 мл 10% -ного раствора сульфата меди(II) и добавьте немного 10% -ного раствора гидроксида натрия до образования голубого осадка гидроксида меди(II). К полученному осадку добавьте по каплям глицерин. Взболтайте смесь. Отметьте превращение голубого осадка в раствор темно-синего цвета Опыт 3 Окисление этилового спирта хромовой смесью В пробирке смешайте 2 мл 5% -ного раствора дихромата калия, 1 мл 20%-ного раствора серной кислоты и 0,5 мл этилового спирта. Отметьте цвет раствора. Осторожно нагрейте смесь на пламени горелки до начала изменения цвета. При этом ощущается характерный запах уксусного альдегида, образующегося в результате реакции. Заполнить таблицу |
| Содержание отчета: |
3. Подготовьтесь к защите работы 1. Номер опыта , его название и цели, материальное обеспечение 2. Что делали? – записывается кратко, вместо словесного описания последовательности действий используется рисунок. 3. Наблюдения – рисунок или схема поясняются обозначениями: - образование осадка ↓ - цвет осадка, и его характер (мучнистость, творожистость, студенистый) - Выделение газа ↑; указать цвет, запах, как горит (яркость пламени) 4. Уравнения реакции – записывается уравнение реакции 5. Выводы по проделанной работе |
Методические указания по выполнению работы:
1. Повторите материал по данной теме по конспекту или учебнику
2. Оформите отчет по работе (заполните таблицу, номер работы, ее название и цели, материальное обеспечение)
3. Выпишите исходные данные
4. Подготовьтесь к защите работы
Тематика контрольных вопросов:
1. В чем причина различного «поведения» спиртов в воде?
2. Почему изоамиловый спирт отслаивается над водой, а не наоборот?
3. Какие органические жидкие вещества при смешивании с водой будут отслаиваться над водой?
4. Какая реакция лежит в основе получения гидроксида меди(II)? Напишите уравнение этой реакции.
5. Почему при добавлении глицерина к осадку гидроксида меди(II) осадок растворяется? С чем связано интенсивное окрашивание раствора? Напишите уравнение реакции взаимодействия глицерина с гидроксидом меди(II).
6. Будут ли этиловый и изоамиловый спирты реагировать с гидроксидом меди(II)?
Практическая работа № 12
Растворимость различных карбоновых кислот в воде. Взаимодействие уксусной кислоты с металлами.
Цель работы: подтвердите экспериментально свойства уксусной кислоты, обусловленные наличием ионов водорода; закрепить навыки работы в малых группах, расширить кругозор учащихся, развить их мышление.
Оборудование и реактивы: конспект лекций, методические указания по выполнению работы, инструкции по технике безопасности; уксусная кислота; вода; бензойная кислота; цинк в гранулах; спиртовка, спички, пробиркодержатель, магний,
Общие теоретические сведения: Карбоновыми кислотами называют органические соединения в молекулах которых содержится карбоксильная группа, связанная с углеводородным радикалом. Общая формула карбоновых кислот R – СООН.
Свойства органических кислот во многом похожи на свойства неорганических кислот. Только сильные электролиты среди органических кислот – большая редкость.
Органические кислоты, хотя и являются слабыми электролитами, способны к электролитической диссоциации. В водном растворе их молекулы обратимо распадаются на катионы водорода и анионы кислотного остатка. Именно наличие катионов водорода придаёт кислотам кислый вкус и специфические химические свойства:
СН3СООН ↔ Н+ + СН3СОО-
С помощью индикатора можно убедиться в наличии кислот в лимонном соке, яблоке, кислом молоке.
Карбоновые кислоты реагируют с активными металлами, основными и амфотерными оксидами, основаниями и солями. В результате этих реакций образуются соли карбоновых кислот:
2СН3СООН + Zn → (СН3СОО)2 Zn + Н2↑
В растворе образуется соль уксусной кислоты. Соли уксусной кислоты называют ацетатами.
2СН3СООН + МgО →(СН3СОО)2Мg + Н2О
СН3СООН + NaOH → СН3СООNa + Н2О
2СН3СООН + К2СО3 → 2СН3СООК + СО2↑ + Н2О
Уксусная кислота известна с глубокой древности. Она образуется при скисании вина на воздухе или под действием ферментов:
ферменты
СН3СН2 ОН + О2 → СН3СООН + Н2О
Уксусная кислота – жидкость с резким запахом; смешивается с водой в любых соотношениях. Соли уксусной кислоты хорошо растворимы в воде за исключением ацетатов серебра и ртути (I). Уксусная кислота в отличие от муравьиной кислоты устойчива к окислению.
Уксусная кислота имеет большое практическое использование в промышленности. Основная часть получаемой кислоты используется для производства искусственных волокон и пластмасс на основе целлюлозы. Уксусную кислоту используют в производстве красителей, медикаментов, ядохимикатов, органического стекла. Раствор уксусной кислоты используют в пищевой промышленности. Высшие карбоновые кислоты встречаются в виде сложных эфиров со спиртами – в воске, в виде эфиров с трёхатомным спиртом глицерином – в жирах. К числу важнейших гомологов принадлежат пальмитиновая (С15Н31СООН ) и стеариновая (С17Н35СООН) кислоты.
Производные карбоновых кислот, в которых атом водорода карбоксильной группы замещен на углеводородный радикал, называют сложными эфирами.
| Задание: | Опыт 1. Растворимость карбоновых кислот в воде. В одну пробирку прилейте 1-2 мл воды и добавьте 2-3 капли уксусной кислоты, взболтайте содержимое. В другую пробирку также прилейте 1-2 мл воды и добавьте 0,1 – 0,2 г бензойной кислоты, взболтайте содержимое. Отметьте различие в поведении уксусной и бензойной кислот. Пробирку с бензойной кислотой нагревайте на пламени газовой горелки до растворения. Охладите пробирку. Дабавьте к выпавшему осадку немного раствора гидроксида натрия. Опыт 2. Взаимодействие уксусной кислоты с металлами В пробирку прилейте 1-2 мл уксусной кислоты и добавьте 1-2 гранулы цинка. Если не наблюдается никаких изменений, пробирку слегка нагрейте. 2. Составьте (оформите) отчет по работе Заполнить таблицу |
| Содержание отчета: |
3. Подготовьтесь к защите работы 1. Номер опыта , его название и цели, материальное обеспечение 2. Что делали? – записывается кратко, вместо словесного описания последовательности действий используется рисунок. 3. Наблюдения – рисунок ил и схема поясняются обозначениями: - образование осадка ↓ - цвет осадка, и его характер (мучнистость, творожистость, студенистый) - Выделение газа ↑; указать цвет, запах, как горит (яркость пламени) 4. Уравнения реакции – записывается уравнение реакции 5. Выводы по проделанной работе |
Методические указания по выполнению работы:
1. Повторите материал по данной теме по конспекту или учебнику
2. Оформите отчет по работе (заполните таблицу, номер работы, ее название и цели, материальное обеспечение)
3. Выпишите исходные данные
4. Подготовьтесь к защите работы
Тематика контрольных вопросов:
1. Почему реакцию нейтрализации уксусной кислоты следует проводить в присутствии индикатора?
2. Напишите три уравнения химических реакций, демонстрирующих:
а) сходство химических свойств муравьиной и уксусной кислот;
б) отличие муравьиной кислоты от уксусной;
в) сходство муравьиной и уксусной кислот с неорганическими кислотами
3. Что такое «ледяная» уксусная кислота?
Практическая работа № 13
Омыление жира. Получение мыла и изучение его свойств: пенообразование, реакции ионного обмена, гидролиз, выделение свободных жирных кислот
Омыление жира. Получение мыла и изучение его свойств: пенообразование, реакции ионного обмена, гидролиз, выделение свободных жирных кислот
Цель работы: Рассмотреть состав и строение мыла и моющих средств, показать взаимосвязь строения и свойств моющих средств; закрепить навыки работы в малых группах, расширить кругозор учащихся, развить их мышление.
Оборудование и реактивы: конспект лекций, методические указания по выполнению работы, инструкции по технике безопасности; вода; спиртовка, спички, пробиркодержатель, магний, мыло,
Общие теоретические сведения:
Производные карбоновых кислот, в которых атом водорода карбоксильной группы замещен на углеводородный радикал, называют сложными эфирами.
К сложным эфирам природного происхождения относятся жиры.
Жирами называют сложные эфиры трёхатомного спирта глицерина и карбоновых кислот. В состав природных жиров входят остатки предельных и непредельных кислот, содержащие чётное число углеродных атомов и неразветвлённый углеродный скелет. Жиры, образованные предельными кислотами (масляной, пальмитиновой, стеариновой и др.), имеют, как правило, твёрдую консистенцию. Эти жиры преимущественно животного происхождения . С увеличением длины углеводородного радикала температура плавления жира увеличивается.
Если в состав жира входят остатки непредельных кислот, жиры представляют собой вязкие жидкости; их часто называют маслами. Масла – это жидкие жиры преимущественно растительного происхождения. Природные жиры, как правило, являются смешанными сложными эфирами, т.е. в состав молекул входят остатки разных кислот. Жиры нерастворимы в воде, но хорошо растворяются в органических растворителях: бензоле, тетрахлорметане, гексане.
Щелочной гидролиз жиров приводит к образованию глицерина и солей высших карбоновых кислот, называемых мылами. Поэтому реакцию сложных эфиров со щелочами называют омылением.

Мылами называют натриевые и калиевые соли высших карбоновых кислот.
Натриевые соли высших карбоновых кислот, такие как пальмиат натрия С15Н31СООNa , стеарат натрия С17Н35СООNa, имеют твёрдое агрегатное состояние, калиевые соли – жидкое (жидкое мыло). При изготовлении мыла в него добавляют душистые вещества, глицерин, красители, антисептики.
В жёсткой воде, содержащей ионы Са2+ и Мg2+ , мыло теряет свою моющую способность. Это происходит в результате того, что кальциевые и магниевые соли высших карбоновых кислот нерастворимы в воде. Вместо пены в воде образуются хлопья осадка, и мыло расходуется бесполезно:
2С17Н35СООNa + Са2+ → (С17Н35СОО)2 Са↓ + 2Na+
Этого недостатка нет у синтетических моющих средств. Они представляют собой натриевые соли высших сульфокислот. Их получают взаимодействием высших спиртов с серной кислотой и последующей нейтрализацией щёлочью:
-Н2О
С12Н25СООН + Н2SO4 → С12Н25О SO3Н → С12Н25О SO3Na
Лауриловый спирт лаурилсульфат натриевая соль лаурилсульфата
Мыло было известно человеку до новой эры летоисчисления. Самое раннее упоминание о мыле в европейских странах встречается у римского писателя и ученого Плиния Старшего (23–79 гг.). В трактате «Естественная история» Плиний писал о способах получения мыла омылением жиров. Мало того, он писал о твердом и мягком мыле, получаемом с использованием соды и поташа соответственно.Для мытья и стирки белья на Руси использовали щелок, получаемый при обработке золы водой, т.к. зола от сгоревшего топлива растительного происхождения содержит поташ. Развитию мыловарения способствовало наличие сырьевых источников. Например, марсельская мыловаренная отрасль промышленности, известная с эпохи раннего средневековья, располагала оливковым маслом и содой. Мыловарение развивалось также в Италии, Греции, Испании, на Кипре, т.е. в районах, культивирующих оливковые деревья. Первые германские мыловарни были основаны в XIV столетии. Химическая сущность мыловаренных процессов долгое время была не ясна. Лишь в конце XVIII в. была выяснена химическая природа жиров, и затем поняты реакции их омыления. В 1779 г. шведский химик К.В.Шееле показал, что при взаимодействии оливкового масла с оксидом свинца и водой образуется растворимое в воде сладкое вещество. В 1817 г. французский химик М.Э.Шеврель открыл стеариновую, пальмитиновую и олеиновую кислоты как продукты разложения жиров при их омылении водой и щелочами. Сладкое вещество, полученное Шееле, было Шеврелем названо глицерином. Сорок лет спустя французский химик П.Э.М.Бертло установил природу глицерина и объяснил химическое строение жиров.
| Задание: | Опыт 1. Омыление жира В пробирку поместите жир, маргарин и сливочное масло, прилейте 8–10 мл 15%-го спиртового раствора гидроксида натрия. Смесь перемешайте, нагрейте до кипения. Омыление ведите до тех пор, пока жидкость не станет однородной. К полученной густой жидкости добавьте насыщенный раствор хлорида натрия и кипятите раствор 1–2 минуты. Опыт 2. Выделение жирных кислот В пробирку поместите кусочек твердого мыла, прилейте к нему 8–10 мл дистиллированной воды, взболтайте и подогрейте полученный раствор. К раствору мыла прилейте раствор разбавленной серной кислоты и нагрейте до кипения. Опыт 3. Получение нерастворимых солей жирных кислот В пробирку поместите кусочек твердого мыла, прилейте к нему 8–10 мл дистиллированной воды, взболтайте и подогрейте полученный раствор. Разделите раствор по трем пробиркам, в первую добавьте раствор ацетата свинца, во вторую – раствор хлорида кальция, в третью – раствор сульфата меди. Опыт 4. Сравнение мыла и синтетических моющих средств Приготовьте в трех пробирках по 10 мл разбавленных растворов: а) твердого мыла; б) одного из синтетических порошкообразных моющих средств; в) жидкого мыла. Разделите полученные растворы на две части (в каждой из них – по три пробирки). а) В каждую из трех пробирок первой части с различными растворами добавьте по нескольку капель фенолфталеина. (Если моющее средство предназначено для хлопчатобумажных тканей, то среда бывает щелочной, а если для шелковых и шерстяных – нейтральной.) б) В три оставшиеся пробирки второй части с растворами мыла и синтетических моющих средств добавьте при встряхивании по 2–3 мл воды, содержащей ионы Са2+ и Mg2+. 2. Составьте (оформите) отчет по работе Заполнить таблицу |
| Содержание отчета: |
3. Подготовьтесь к защите работы 1. Номер опыта , его название и цели, материальное обеспечение 2. Что делали? – записывается кратко, вместо словесного описания последовательности действий используется рисунок. 3. Наблюдения – рисунок ил и схема поясняются обозначениями: - образование осадка ↓ - цвет осадка, и его характер (мучнистость, творожистость, студенистый) - Выделение газа ↑; указать цвет, запах, как горит (яркость пламени) 4. Уравнения реакции – записывается уравнение реакции 5. Выводы по проделанной работе |
Методические указания по выполнению работы:
1. Повторите материал по данной теме по конспекту или учебнику
2. Оформите отчет по работе (заполните таблицу, номер работы, ее название и цели, материальное обеспечение)
3. Выпишите исходные данные
4. Подготовьтесь к защите работы
Тематика контрольных вопросов:
1. Для каких практических целей используется процесс омыления жиров?
2. Почему раствор мыла имеет щелочную среду? Ответ поясните уравнением реакции.
3. Какое из моющих средств следует использовать для стирки:
а) хлопчатобумажных тканей;
б) шелковых и шерстяных тканей;
в) в жесткой воде?
4. Почему не рекомендуется мыть посуду стиральным порошком?
5. Почему мыло попавшее на слизистую оболочку глаз, вызывает жжение
6. Как различить два розовых мутноватых раствора – фенола и мыла? Запишите необходимые уравнения реакций и отметьте их условия и признаки.
Практическая работа № 14
Реакция «серебряного зеркала» глюкозы. Взаимодействие глюкозы с гидроксидом меди (II) при различных температурах. Действие аммиачного раствора оксида серебра на сахарозу.
Цель работы: уметь экспериментально доказывать, что углеводы – сложные вещества, определять их наличие, пользоваться химическим оборудованием и посудой. Знать свойства углеводов: глюкозы, крахмала; правила
техники безопасности.
Оборудование и реактивы: конспект лекций, методические указания по выполнению работы, инструкции по технике безопасности; металлический штатив, спиртовка, пробирки, стеклянная палочка, химический стакан вместимостью 50 мл, электроплитка, водяная баня; 1 % раствор глюкозы, 1 % растворы сахарозы, фруктозы; раствор сульфата меди (II), раствор гидроксида натрия (10-12 %), раствор серной кислоты (1:5), аммиачный раствор оксида серебра (I).
Общие теоретические сведения: Углеводы – циклические молекулы, состоящие из углерода, водорода и полимера. Общая формула углеводов С (Н О) они делятся на простые и сложные.

1. Простые Моносахариды – в зависимости от числа атомов углерода в молекуле моносахаридов различают: триозы(3с), тетрозы(4с), пентозы(5с), гексозы(6с), гептозы(7с). В природе наиболее широко распространены пентозы и гексозы. Важнейшие из пентоз – дезоксирибоза и рибоза входящие в состав ДНК, РНК, АТФ, из гексоз наиболее распространены глюкоза, фруктоза и галактоза (общая формула СНО). Моносахариды могут быть представлены в виде а- и в-изомеров. Молекулы крахмала состоят из остатков а-глюкозы, целлюлозы – из остатков в-глюкозы. Дезоксирибоза (СНО) отличается от рибозы (С Н О) тем, что при втором атоме углерода имеет атом водорода, а не гидроксильную группу, как у рибозы.
2 Сложными называются углеводы, молекулы которых, при гидролизе распадаются с образованием простых углеводов.
Среди сложных различают: олигосахариды и полисахариды.
Олигосахаридами – называют сложные углеводы, содержащие от 2 до 10 моносахаридных остатков. В зависимости от количества входящих остатков моносахаридов, входящих в молекулы олигосахаридов, различают дисахариды, трисахариды и т.д. Наиболее широко распространены в природе дисахариды, молекулы которых образованы двумя остатками моносахаридов: мальтоза, состоящая из двух остатков а- глюкозы, молочный сахар (лактоза) и свекловичный (или трасниковый) сахар.
Полисахариды образуются в результате реакции поликонденсации. Важнейшие полисахариды – крахмал, гликоген, хитин, муреин. Крахмал – основной резервный углевод растений, гликоген у животных и человека. Целлюлоза – основной структурный углевод клеточных стенок растений, она не растворима в воде.
Функции углеводов.
1. Энергетическая – могут расщепляться до углекислого газа и воды с выделением энергии.
2. Строительная – мтенки растительных клеток состоят из углеводов (целлюлоза).
Углеводы служат основным источником энергии. Свыше 56% энергии организм получает за счет углеводов, остальную часть – за счет белков и жиров.
В зависимости от сложности строения, растворимости, быстроты усвоения углеводы пищевых продуктов подразделяются на простые углеводы: моносахариды (глюкоза, фруктоза, галактоза), дисахариды (сахароза, лактоза) и сложные углеводы, или полисахариды (крахмал, гликоген, клетчатка).
Простые углеводы легко растворяются в воде и быстро усваиваются. Они обладают выраженным сладким вкусом и относятся к сахарам. Наиболее распространенный моносахарид – глюкоза – содержится во многих плодах и ягодах, а также образуется в организме в результате расщепления дисахаридов и крахмала пищи. Глюкоза наиболее быстро и легко используется в организме для образования гликогена, для питания тканей мозга, работающих мышц (в том числе и сердечной мышцы), для поддержания необходимого уровня сахара в крови и создания запасов гликогена печени. Во всех случаях при большом физическом напряжении глюкоза может использоваться как источник энергии. Фруктоза обладает теми же свойствами, что и глюкоза, и может рассматриваться как ценный, легкоусвояемый сахар. Однако она медленнее усваивается в кишечнике и, поступая в кровь, быстро покидает кровяное русло. Фруктоза в значительном количестве (до 70–80%) задерживается в печени и не вызывает перенасыщение крови сахаром. В печени фруктоза более легко превращается в гликоген по сравнению с глюкозой. Фруктоза усваивается лучше сахарозы и отличается большей сладостью. Высокая сладость фруктозы позволяет использовать меньшие ее количества для достижения необходимого уровня сладости продуктов и таким образом снизить общее потребление Сахаров, что имеет значение при построении пищевых рационов ограниченной калорийности.
Избыток сахарозы оказывает влияние на жировой обмен, усиливая жирообразование. Установлено, что при избыточном поступлении сахара усиливается превращение в жир всех пищевых веществ (крахмала, жира, пищи, частично и белка). Таким образом, количество поступающего сахара может служить в известной степени фактором, регулирующим жировой обмен. Обильное потребление сахара приводит к нарушению обмена холестерина и повышению его уровня в сыворотке крови. Избыток сахара отрицательно сказывается на функции кишечной микрофлоры. При этом повышается удельный вес гнилостных микроорганизмов, усиливается интенсивность гнилостных процессов в кишечнике, развивается метеоризм. Установлено, что в наименьшей степени эти недостатки проявляются при потреблении фруктозы. Основными источниками фруктозы являются фрукты и ягоды. Глюкоза и фруктоза широко представлены в меде: содержание глюкозы достигает 36,2%, фруктозы – 37,1%. В арбузах весь сахар представлен фруктозой, количество которой составляет 8%. Третий моносахарид – галактоза – в свободном виде в пищевых продуктах не встречается. Галактоза является продуктом расщепления основного углевода молока – лактозы.
Из дисахаридов в питании человека основное значение имеет сахароза, которая при гидролизе распадается на глюкозу и фруктозу. Источниками сахарозы в питании человека являются, главным образом, тростниковый и свекловичный сахар. Содержание сахарозы в сахаре-песке составляет 99,75%. Натуральными источниками сахарозы являются бахчевые, некоторые овощи и фрукты . Сложные углеводы, или полисахариды, характеризуются усложненным строением молекулы и плохой растворимостью в воде. К сложным углеводам относятся крахмал, гликоген, пектиновые вещества и клетчатка. Крахмал имеет основное пищевое значение. Высоким его содержанием в значительной степени обуславливается пищевая ценность зерновых продуктов. В пищевых рационах человека на долю крахмала приходится около 80% общего количества потребляемых углеводов. Превращение крахмала в организме в основном направлено на удовлетворение потребности в сахаре.
Гликоген в организме используется в качестве энергетического материала для питания работающих мышц, органов и систем. Восстановление гликогена происходит путем его ресинтеза за счет глюкозы. Пектины относятся к растворимым веществам, усваивающимися в организме. Современными исследованиями показано несомненное значение пектиновых веществ в питании здорового человека, а также возможность использовать их с терапевтической целью при некоторых заболеваниях преимущественно желудочно-кишечного тракта.
Клетчатка по химической структуре весьма близка к полисахаридам. Высоким содержанием клетчатки характеризуются зерновые продукты. Однако помимо общего количества клетчатки, важное значение имеет ее качество. Менее грубая, нежная клетчатка хорошо расщепляется в кишечнике и лучше усваивается. Такими свойствами обладает клетчатка картофеля и овощей. Клетчатка способствует выведению из организма холестерина. Потребность в углеводах определяется величиной энергетических затрат. Средняя потребность в углеводах для тех, кто не занят тяжелым физическим трудом, 400–500 г в сутки.
Способность углеводов быть высокоэффективным источником энергии лежит в основе их сберегающего белок действия. При поступлении с пищей достаточного количества углеводов аминокислоты лишь в незначительной степени используются в организме как энергетический материал. Хотя углеводы не принадлежат к числу незаменимых факторов питания и могут образовываться в организме из аминокислот и глицерина, минимальное количество углеводов суточного рациона не должно быть ниже 50–60 г Дальнейшее снижение количества углеводов ведет к резким нарушениям метаболических процессов.
Избыточное потребление углеводов ведет к ожирению. При построении пищевых рационов чрезвычайно важно не только удовлетворить потребности человека в необходимом количестве углеводов, но и подобрать оптимальные соотношения качественно различных типов углеводов. Наиболее важно учитывать соотношение в рационе легкоусвояемых углеводов (Сахаров) и медленно всасывающихся (крахмал, гликоген). При поступлении с пищей значительных количеств Сахаров они не могут полностью откладываться в виде гликогена, и их избыток превращается в триглицериды, способствуя усиленному развитию жировой ткани. Повышенное содержание в крови инсулина способствует ускорению этого процесса, поскольку инсулин оказывает мощное стимулирующее действие на жироотложение.
В отличие от Сахаров крахмал и гликоген медленно расщепляются в кишечнике. Содержание сахара в крови при этом нарастает постепенно. В связи с этим целесообразно удовлетворять потребности в углеводах в основном за счет медленно всасывающихся углеводов. На их долю должно приходиться 80–90% от общего количества потребляемых углеводов. Ограничение легкоусвояемых углеводов приобретает особое значение для тех, кто страдает атеросклерозом, сердечно-сосудистыми заболеваниями, сахарным диабетом, ожирением.
Углеводы (сахара) – органические вещества, состав которых выражается формулой Сх(Н2О)у, где х и у 3.
Углеводы содержатся в клетках растительных и животных организмов и по массе составляют основную часть органического вещества на Земле. Эти соединения образуются растениями в процессе фотосинтеза из углекислого газа и воды. Животные организмы не способны синтезировать углеводы и получают их с растительной пищей. Фотосинтез можно рассматривать как процесс восстановления СО2 с использованием солнечной энергии. Эта энергия освобождается в животных организмах в результате метаболизма углеводов, который заключается, с химической точки зрения, в их окислении.
По способности к гидролизу углеводы делятся на простые –
моносахариды и сложные – олигосахариды и полисахариды. Моносахариды не гидролизуются с образованием более простых углеводов. Сложные углеводы гидролизуются до моносахаридов, В молекулах олигосахаридов содержится от 2 до 10 моносахаридных остатков, в полисахаридах – от 10 до 3000-5000.
Гликемический индекс продуктов
Углеводы хороши на вкус, помогают достичь феноменальной “накачки” мышц и, как все полагают, являются наиболее здоровым из всех питательных веществ.
недостатки углеводов
Обратной стороной медали тут является накопление жира. Постоянная диета с преобладанием углеводов стимулирует высвобождение инсулина, что, в свою очередь, вызывает подъем уровня жира в организме. Искусство в том, чтобы найти верное соотношение между их типом и временем приема, так как не все углеводы одинаковы. Потребление большого количества “неправильных” углеводов в “неверное” время дня может превратить даже генетически одаренного атлета в подобие заплывшего жиром эндоморфа. Попробуем предложить эффективный метод употребления углеводов, легко вписывающийся в определенного типа углеводов в определенное время. Такая стратегия позволит добиться максимальной “сухой” мышечной массы при минимальном количестве жира.
Углеводы – питательные вещества с энергетической ценностью 4,1 килокалории на грамм. То есть именно это количество энергии освобождается при расщеплении в организме одного грамма сахара. Зачем нам нужна энергия, я думаю, уже объяснять не надо. Есть у углеводов еще одно довольно важное свойство. Они могут расщепляться и давать энергию даже в отсутствии кислорода.
В общем-то считается доказанным, что избыточное потребление мучного и сладкого связано с появлением избыточного веса. Другими словами, чем больше человек ест углеводов, тем с большей вероятностью он будет иметь лишние килограммы. Но почему? Долгое время механизм развития тучности при злоупотреблении углеводами видели в их принципиальной возможности перестраиваться в организме в жир. Действительно, давно известно, что организм не создает запасов углеводов. Вернее создает, но очень небольшие. Весь запас углеводов исчерпывается 60-80 граммами гликогена (животного крахмала) в печени и примерно таким количеством в мышцах. Это примерно 600 килокалорий – четверть, а то и одна пятая того, что человеку нужно на день. Столько же углеводов, для справки, содержится в 250 г белого хлеба. Казалось очень логичным, что организм, не в силах резервировать большие количества углеводов, перестраивает их избыток в жир и уже в виде жира депонирует. Тем более, повторяю, принципиально такая возможность существует, то есть имеются ферментативные цепочки, которые могут из фрагментов молекул углеводов строить молекулы жира. Выяснилось, что жир из углеводов мы строим только при очень большом одномоментном потреблении последних. Очень большом, порядка 300-500г. Много это или мало? Попробуйте съесть в течении часа полкило сахара, как раз и получится 500 г углеводов. В обычной жизни такого практически не бывает.
Кстати, вопрос, а чем же в повседневной жизни человека регулируется аппетит и потребление пищи, давно уже интересует ученых. В настоящее время наибольшим признанием пользуется гипотеза, что аппетит на прямую связан с содержанием глюкозы в крови и гликогена в печени. Когда уровень сахара в крови снижается, появляется голод, когда повышается – чувство сытости. После употребления сахара уровень глюкозы в крови повышается до максимума в течении получаса-часа. Вот почему сладкое, принятое за 20 минут до еды может существенно повлиять на аппетит.
Оказалось, что потребление углеводов в данный день существенно зависит от того, сколько их было съедено на кануне. Если в предыдущий день вы съели много мучного и сладкого, запасы гликогена в вашем организме значительные и, логично, что сегодня углеводов вы не сможете съесть много, да и не захотите.
А куда деваются углеводы, содержащиеся в пище. Большей частью они идут на окисление, то есть на образование энергии. Если в пище углеводов все-таки много, то и горение это усиливается. Многим из вас знакомо чувство тепла, охватывающее нас после обильной и сытной еды. Это "горят" углеводы.
Бич неправильно информированных людей, сидящих на диете, углеводы, на самом деле являются главным поставщиком энергии для нашего организма. Во время пищеварения основные виды углеводов, крахмалы и сахара, распадаются на глюкозу, более известную как сахар
крови. Глюкоза крови обеспечивает необходимой энергией наш мозг и центральную нервную систему.
Углеводы необходимы в ежедневном рационе, чтобы белок, нужный для построения тканей, не растрачивался в качестве источника энергии, там где он нужен для восстановления. У них такая же калорийность, как и у белка. Если вы употребляете слишком много углеводов, больше, чем может преобразоваться в глюкозу или гликоген (который откладывается в печени и мышцах), то в результате, как нам всем слишком хорошо известно, образуется жир. Когда телу нужно больше топлива, жир преобразуется обратно в глюкозу, и вес тела снижается.
Не относитесь к углеводам слишком пренебрежительно. Они в такой же степени необходимы для здоровья, как и остальные питательные вещества, и в грамме углеводов содержатся те же 4 калории, что и в грамме белка. Хотя не существует официальных норм потребления углеводов, рекомендуется минимум в 50 г в день, чтобы избежать кетоза, кислого состояния крови, которое может развиться, если для образования энергии используются преимущественно запасы жира.
| Задание: | Опыт 1. Действие аммиачного раствора оксида серебра на глюкозу. Что наблюдается? Какая форма глюкозы (открытая или циклическая) даёт реакцию «серебряного зеркала»? Напишите уравнение реакции. В пробирку, содержащую 1-2 мл раствора глюкозы в воде, прилейте 1-2 мл аммиачного раствора оксида серебра и нагрейте пробирку на кипящей бане Опыт 2. Действие гидроксида меди (II) на глюкозу без нагревания В пробирку прилейте 0,5 мл раствора глюкозы и 2мл раствора гидроксида натрия. К полученной смеси добавьте 1 мл раствора медного купороса. Опыт 3. Действие гидроксида меди (II) на глюкозу при нагревании К полученному в опыте 2 раствору аккуратно прилейте 1 мл воды и нагрейте на пламени спиртовки, укрепив её наклонно так, чтобы нагревалась только верхняя часть раствора. Прекратите нагревание, как только начнётся изменение цвета Почему образовавшийся вначале осадок гидроксида меди (II) растворяется с образованием прозрачного синего раствора? Наличием каких функциональных групп в глюкозе обусловлена эта реакция? Напишите уравнение реакции. Почему при нагревании происходит изменение цвета реакционной смеси с синего на оранжево – желтый? Что представляет собой желто – красный осадок? Наличие какой функциональной группы в глюкозе является причиной данной реакции? Напишите уравнение реакции. Опыт 4. Действие аммиачного раствора оксида серебра на сахарозу. В пробирку, содержащую 1-2 мл раствора сахарозы в воде, прилейте 1-2 мл аммиачного раствора оксида серебра и нагрейте пробирку на кипящей водяной бане. В пробирку, содержащую 1-2 мл раствора сахарозы в воде, добавьте несколько капель разбавленной серной кислоты и нагрейте на кипящей водяной бане в течение 5-10 минут. Затем охлаждённый раствор доведите до слабощелочной реакции (проба на лакмус), добавив в пробирку раствор щелочи. К полученному раствору добавьте 1-2 мл аммиачного раствора оксида серебра и нагрейте пробирку на кипящей водяной бане. Почему сахароза не даёт реакцию «серебряного зеркала»? Какие процессы происходят с сахарозой при нагревании её раствора с кислотой? Почему после нагревания проба с аммиачным раствором оксида серебра даёт положительный результат? Напишите уравнение гидролиза сахарозы. 2. Составьте (оформите) отчет по работе Заполнить таблицу |
| Содержание отчета: |
3. Подготовьтесь к защите работы 1. Номер опыта , его название и цели, материальное обеспечение 2. Что делали? – записывается кратко, вместо словесного описания последовательности действий используется рисунок. 3. Наблюдения – рисунок ил и схема поясняются обозначениями: - образование осадка ↓ - цвет осадка, и его характер (мучнистость, творожистость, студенистый) - Выделение газа ↑; указать цвет, запах, как горит (яркость пламени) 4. Уравнения реакции – записывается уравнение реакции 5. Выводы по проделанной работе |
Методические указания по выполнению работы:
1. Повторите материал по данной теме по конспекту или учебнику
2. Оформите отчет по работе (заполните таблицу, номер работы, ее название и цели, материальное обеспечение)
3. Выпишите исходные данные
4. Подготовьтесь к защите работы
Тематика контрольных вопросов:
1. С помощью каких реакций можно доказать наличие в глюкозе альдегидной и гидроксильных групп?
2. В двух пробирках без этикеток находятся растворы и глюкозы и этиленгликоля. С помощью каких химических реакций можно различить эти вещества?
3. В чём заключаются различия в строении молекул моносахаридов и дисахаридов?
4. С помощью какого реагента можно различить водные растворы глюкозы и сахарозы?
Практическая работа № 15
Образование солей глицина. Получение медной соли глицина. Денатурация белка. Цветные реакции белков
Цель работы: Ознакомиться с наиболее характерными свойствами аминов, аминокислот и качественными реакциями на них. Правила техники безопасности.
Оборудование и реактивы: конспект лекций, методические указания по выполнению работы, инструкции по технике безопасности; спиртовка, держатель для пробирок, пробирки, раствор гидроксида натрия (10-12 %), раствор сульфата меди (II) (0,5 моль/л), концентрированная соляная кислота, концентрированная серная кислота, насыщенный раствор сульфата аммония, этиловый спирт, концентрированный раствор гидроксида натрия, концентрированный раствор аммиака.
Общие теоретические сведения:
Амины – это органические производные аммиака, в молекулах которого один, два или все три атома водорода замещены углеводородным радикалом.
Амины, которых аминогруппа связана непосредственно с ароматическим кольцом, называются ароматическими аминами. Простейшим представителем этих соединений является анилин:
Молекулярная формула анилина: С6H5NH2
Структурная формула анилина
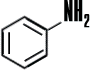 Химические свойства
Химические свойства
1. Анилин реагирует с сильными кислотами, образуя соли фениламмония C6H5NH3+, которые хорошо растворимы в воде, но нерастворимы в неполярных органических растворителях:
С6Н5NН2 + HCl → С6Н5NН3Сl.
2. Анилин легко бромируется даже под действием бромной воды, давая белый осадок 2,4,6-триброманилина:

С концентрированной азотной кислотой анилин реагирует со взрывом, поэтому непосредственное нитрование осуществить не удается.
3. При реакции анилина с азотистой кислотой образуются диазосоединения — соли диазония C6H5N2+:
C6H5NH2 + NaNO2 + 2HCl → [C6H5-N≡N]+Cl— + NaCl + 2H2O.
Диазосоединения можно выделить в виде кристаллических, легко взрывающихся веществ. Благодаря способности диазониевой группы легко замещаться на другие функциональные группы, эти соединения широко используются в органических синтезах. Во многих случаях можно не выделять диазосоединения в кристаллическом виде, а использовать их свежеприготовленные растворы.
4. Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении. При действии хлорной извести Са(Сl)ОСl на водный раствор анилина появляется интенсивное фиолетовое окрашивание. Это — качественная реакция на анилин.
Применение. Основная область применения анилина — синтез красителей и лекарственных средств.
Аминокислоты являются основными элементами, из которых строятся молекулы белка. Животные организмы получают их при гидролизе белков, а также при непосредственном введении в организм в случае возникновения различных заболеваний.
Аминокислоты играют важную роль не только в построении белковых молекул, но и в азотистом обмене – образовании аммиака, мочевины и многочисленных азотсодержащих соединений, при этом выделяется энергия, необходимая организму для процессов жизнедеятельности.
Некоторые синтетические волокна также построены из аминокислот, например, капрон, построен из остатков -аминокапроновой кислоты. Аминокислоты — это органические амфотерные соединения. Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами. Аминокислоты реагируют как с кислотами, так и с основаниями:
Н2N-СН2-СООН + HCl→ Сl[Н3N-СН2-СООН],
Н2N-СН2-СООН + NaOH → H2N-CH2-COONa + Н2О.
При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион:
H2N-CH2—СООН ![]() +Н3N-СН2—СОO—.
+Н3N-СН2—СОO—.
Кислотно-основные превращения аминокислот в различных средах можно изобразить следующей общей схемой:
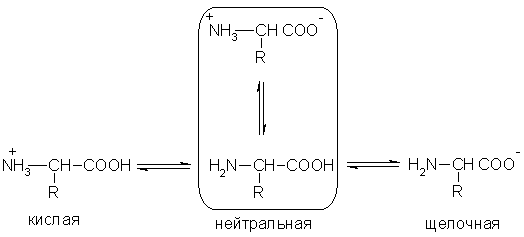
Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп. Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин — щелочной (одна группа -СООН, две -NH2).
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота — в гидроксикислоту:
H2N-CH(R)-COOH + HNO2 → HO-CH(R)-COOH + N2↑+ H2O
Измерение объема выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка).
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир (точнее, в хлороводородную соль эфира):
H2N-CH(R)-COOH + R’OH ![]() H2N-CH(R)-COOR’ + Н2О.
H2N-CH(R)-COOR’ + Н2О.
| Задание: | Опыт 1. Образование солей анилина В пробирку прилейте 0,5 мл анилина и 3 мл воды. Взболтайте. Что наблюдаете? В пробирку добавьте соляной кислоты до полного растворения анилина в воде. К раствору добавьте 1-2 мл раствора щелочи. Что наблюдаете? Опыт 2. Получение медной соли глицина В пробирку, содержащую 2 мл раствора глицина, добавьте 1г порошка оксида меди (II) и нагревайте до кипения. Чем обусловлено появление голубой окраски раствора? Каково строение образующейся соли? 2. Составьте (оформите) отчет по работе Заполнить таблицу |
| Содержание отчета: |
3. Подготовьтесь к защите работы 1. Номер опыта , его название и цели, материальное обеспечение 2. Что делали? – записывается кратко, вместо словесного описания последовательности действий используется рисунок. 3. Наблюдения – рисунок ил и схема поясняются обозначениями: - образование осадка ↓ - цвет осадка, и его характер (мучнистость, творожистость, студенистый) - Выделение газа ↑; указать цвет, запах, как горит (яркость пламени) 4. Уравнения реакции – записывается уравнение реакции 5. Выводы по проделанной работе |
Методические указания по выполнению работы:
1. Повторите материал по данной теме по конспекту или учебнику
2. Оформите отчет по работе (заполните таблицу, номер работы, ее название и цели, материальное обеспечение)
3. Выпишите исходные данные
4. Подготовьтесь к защите работы
Тематика контрольных вопросов:
Почему амины называют органическими основаниями?
Какие правила техники безопасности следует соблюдать при работе с анилиновыми красителями?
Решить задачу.
При восстановлении 492г. Нитробензола получили 282г анилина. рассчитайте выход продукта реакции от теоретически возможного.
Полезное для учителя


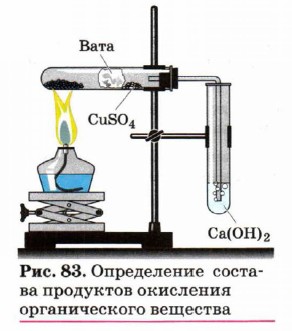








 проса.
проса.