Решение задач на вывод молекулярных формул органических веществ.
С задачами на вывод химической формулы вещества учащиеся встречаются при прохождении программы химии с 8 по 11 классы. К тому же, данный тип задач довольно часто встречается в олимпиадных заданиях, контрольно – измерительных материалах ЕРЭ. Диапазон сложности данных задач достаточно широк. Как показывает опыт, у школьников часто возникают затруднения уже на первых этапах решения при выводе молярной массы вещества.
УСТАНОВЛЕНИЕ ФОРМУЛЫ ВЕЩЕСТВА
Для веществ немолекулярного строения выводят эмпирическую формулу, для веществ молекулярного строения – эмпирическую и молекулярную. Эмпирическая формула показывает наименьшее соотношение атомов в соединении. Молекулярная формула отражает реальный качественный и количественный состав. Между эмпирической и молекулярной формулами могут быть такие отношения:
- эмпирическая совпадает с молекулярной;
- эмпирической формуле соответствует одна, не совпадающая с ней молекулярная формула, например, эмпирической формуле CH3 соответствует только C2H6;
- эмпирической формуле соответствует несколько молекулярных, например, эмпирическую формулу CH имеют C2H2, С6H6.
В органической химии молекулярная формула, как правило, устанавливается на основании эмпирической. Для этого необходимо знать молярную массу неизвестного вещества. Это можно сделать исходя из:
а) относительной плотности вещества или его паров по водороду, воздуху:
DH2 = Mвещ / M(H2) Dвозд = Мвещ / Мвозд
Мвещ = 2 DH2 (г/моль) Мвещ = Dвозд × 29 (г/моль)
б) уравнения Клапейрона-Менделеева:
ρV = m / M × RT M = RT × m / ρV
в) плотности газа при н.у:
ρ = M / Vm ;
M = ρ × Vm
Пример 1) Определите молекулярную формулу предельного углеводорода, если
а) относительная плотность по водороду равна 43;
б ) относительная плотность по кислороду равна 4,44
) относительная плотность по кислороду равна 4,44
Дано: Решение:
DН2 (CxHу) = 43 1.Найдём молярную массу:
СnH2n+2 М (CxHу) = D Н2 (CxHу) · М(Н2)

X -? У- ? n-?
М(Н2) = 2 г/моль (CxHу) = 43·2=86 г/моль
2. Найдём количество атомов, составив уравнение.
М (СnH2n+2) =86 (Вместо С и Н подставим числовые значения их относительных атомных масс
и придём к математическому уравнению): 12n + 2n + 2 = 86 14n = 86 – 2; 14n = 84;
n = 6 = C6H14 Ответ: C6H14
2)Вывести химическую формулу алкена, если его плотность равна 3,125 г/л.
3)Вывести химическую формулу алкина, если 1 литр его весит 3,04г.
4)Вывести химическую формулу альдегида, если его относительная плотность по воздуху равна 2.
5)Вывести химическую формулу карбоновой одноосновной кислоты, если плотность паров равна 3,93 г/л.
6)Вывести химическую формулу однозамещённого хлорпроизводного предельного углеводорода, если его относительная плотность по воздуху равна 2,224.
7) Какой газообразный алкан имеет при нормальных условиях плотность 1,339 г/л?
8) Алкан имеет плотность паров по воздуху 4,414. Определить формулу алкана.
9)Молекула алкана содержит 26 электронов. Установите его формулу.
10)При бромировании углеводорода было получено бромпроизводное, имеющее относительную плотность по кислороду, равную 5,094. Определите возможное строение углеводорода, предложите способ его получения из неорганических реагентов.
11)Приведите структурные формулы циклоалканов, в молекулах которых находится по 40 электронов.
12) Алкен имеет молекулярную массу – 84. Определите его молекулярную формулу.
13)Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху
14)Молекулярная масса алкина – 96. Что это за алкин?
15)Определить формулу ароматического углеводорода с относительной молекулярной массой 92.
16)Относительная плотность паров циклоалкана по кислороду равна 3,5. Выведите молекулярную формулу циклоалкана.
17)Относительная плотность паров алкадиена по кислороду равна 3. Выведите молекулярную формулу алкадиена.
18)Относительная плотность паров предельного одноатомного спирта по водороду равна 37. Выведите молекулярную формулу спирта.
19)Относительная плотность паров предельного альдегида по кислороду равна 1,8125. Выведите молекулярную формулу альдегида.
20)Относительная плотность паров предельной двухосновной карбоновой кислоты по воздуху равна 4,07. Выведите молекулярную формулу карбоновой кислоты.
21)Относительная плотность паров предельного амина по кислороду равна 1,844. Выведите молекулярную формулу амина.
22)Относительная плотность паров ароматического амина по метану равна 6,75. Выведите его молекулярную формулу.
Пример 2) Углеводород (относительная плотность по водороду равна 39) содержит 92,31 % углерода и 7,69% водорода. Найдите его молекулярную формулу.

Дано: Решение:
W% (С) = 92, 31 1.Найдём молярную массу
W% (Н) = 7, 69 М (CxHу) = 39 · 2 = 78 г/моль
DН2(CxHу) = 39
_________________
х : у = ?
Пусть масса неизвестного вещества m(CxHу) = 100 г, тогда m(С) = 92,31 г; m(Н) = 7, 69 г
2. Найдём отношение количество атомов х и у по формуле:
х : у = n(C) : n(H), где n = m/M;
n(С) = 92, 31/12 = 7,69 моль n(Н) = 7,69/1 = 7,69 моль
х : у = 7,69 : 7,69 = 1:1 = СН
3. Убедимся, истинная это формула или простейшая. Для этого найдём молярную массу (СН); М(СН) = 12 + 1 = 13г/моль , а у нас 78 г/моль = нашли простейшую формулу. Чтобы вывести истинную формулу вещества нужно узнать во сколько раз 13 меньше 78, именно во столько нужно будет увеличить количество атомов в простейшей формуле.
78: 13 = 6 = С6Н6
Ответ: С6Н6
2)Относительная плотность углеводорода по водороду, имеющего состав: w(С) = 85,7 %; w (Н) = 14,3 %, равна 21. Выведите молекулярную формулу углеводорода.
3) Массовая доля углерода в соединении равна 39,97 %, водорода 6, 73 %, кислорода 53,30 %. Масса 300 мл. (н.у.) этого соединения равна 2,41 г. Выведите молекулярную формулу этого вещества.
4)Определите формулу углеводорода, массовая доля углерода в котором 82,2 %, а плотность этого вещества составляет 2,59 г/л.
5)Определите формулу красителя-анилина. По данным анилина массовая доля углерода в нем 77,4%, водорода — 7,5 %, азота — 15,1 %. Относительная плотность паров этого вещества по воздуху равна 3,21.
6)Относительная молекулярная масса исследуемого вещества равна 237, массовая доля углерода в нем составляет 10,1%, а хлора – 89,9%. Установите формулу этого хлорзамещенного углеводорода.
7)Углеводород содержит в массовых долях 0,8889 или 88,89 % углерод. Его плотность по воздуху равна 1,852. Найдите молекулярную формулу этого углеводорода.
8)Органическое вещество содержит 84,21% углерода и 15,79% водорода. Плотность паров вещества по воздуху 3,93. Определить формулу вещества.
9)Дано: углерода – 92,3 %, водорода – 7,7 %, масса 1 л газа при н.у. 1,16 г. Определить молекулярную формулу.
10)Углеводород содержит 82,76% углерода и 17,24% водорода (по массе). При монохлорировании этот углеводород образует два изомерных алкилхлорида – первичный и третичный. Определить строение исходного углеводорода.
11)Относительная плотность паров органического соединения по азоту равна 4,5. Массовая доля углерода в этом веществе равна 57,14%, массовая доля водорода равна 4,76%, массовая доля кислорода равна 38,10%. Выведите молекулярную формулу этого соединения.
Вывод формул по продуктам сгорания
Пример 3). При сжигании органического вещества массой 0,46 г, было получено 0,88 г оксида углерода (IV) и 0,54 г воды. Плотность паров вещества по водороду равна 23. Определите его молекулярную формулу
Решение.
Обозначить формулу вещества с помощью индексов х, у, z и т. д. по числу элементов в молекуле. Если продуктами горения являются СО2 и Н2О, то вещество может содержать 3 элемента (Cx HуOz). Частный случай: продуктом горения кроме СО2 и Н2О является азот (N2) для азотсодержащих веществ (Cx HуOz Nm).
1. Истинную относительную молярную массу вещества вычисляем по его плотности по водороду: М(в-ва) = Dн2 ∙ М(н2) = 23 · 2 = 46г/моль
2. Составим уравнение реакции горения вещества: CxHy Oz +О2 = х CO2+�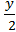 � H2O
� H2O
3.Найдем массы углерода и водорода в веществе:
х г 0,88 г
С → CO2 х = 0,24 г
12 г 44 г
у г 0,54 г
2Н → H2O у = 0,06 г
2 г 18 г
4. Определим массу кислорода в веществе:
m(O) = m(в-ва) – (m(С) + m(Н))= 0,46 г – (0,24 г + 0,06 г) = 0,16 г
5. Вычислим количества вещества атомов углерода, водорода, кислорода:
n(C) = m/M = 0,24/12 = 0,02 моль
n(Н) = m/M = 0,06/1 = 0,06 моль
n(О) = m/M = 0,16/16 = 0,01 моль
6. Найдем отношение индексов х:y:z
х:y:z = n(C) : n(Н) : n(O) = 0,02 : 0,06 : 0,01 = 2: 6 : 1
Эмпирическая (простейшая) формула вещества С2Н6О
7. По дополнительному условию задачи определим истинную формулу вещества. Молярная масса простейшей формулы: М(С2Н6О) = 12 · 2 + 1 ∙ 6 + 16 · 1 = 46г/моль. Следовательно, найденная эмпирическая формула вещества является истинной.
Ответ: С2Н6О.
2)Какова молекулярная формула углеводорода, имеющего плотность 1,97 г/л, если при сгорании 4,4 г. его в кислороде образовалось 6,72 л. СО2 и 7,2 г. Н2О.
3)При сгорании 3г. углеводорода было получено 8,8 г углекислого газа, 5,4 г. воды. Относительная плотность углеводорода по воздуху равна 1,03. Определите молекулярную формулу углеводорода
4)При сгорании 1,84г органического вещества образовалось 2,64г углекислого газа и 1,44 г воды. Плотность горючего газа по кислороду равна 2,875. Определите молекулярную формулу вещества.
5)При сгорании 6,8 г газообразного неорганического вещества было получено 3,6 г воды и 12,8 г сернистого газа. Плотность горючего газа по кислороду равна 1,06. Определите молекулярную формулу вещества.
6)При сжигании 2,5 г вещества образовалось 3,42 г Н20 и 5,57 СО2. В состав вещества, кроме водорода и углерода, входит азот (23 %). Какова молекулярная формула.
7)При сжигании 5,4 г паров неорганического вещества было получено 2,8 г. азота, 8,8 г углекислого газа и 1,8 г воды. Один литр паров этого вещества весит 1,205 г. Определите молекулярную формулу.
8)При сгорании газообразного органического вещества выделилось 6,72 л (н.у.) углекислого газа, 5,4 г воды, 3,65 г хлороводорода. Установите молекулярную формулу сгоревшего вещества, рассчитайте его массу и приведите одно из возможных его названий.
9)При сгорании бескислородного органического вещества выделилось 4,48 л (н.у.) CO2, 3,6 г H2O и 3,65 г хлороводорода. Установите молекулярную формулу сгоревшего соединения, рассчитайте его объем и массу.
10)При сжигании органического вещества массой 1,78 г в избытке кислорода получили 0,28 г азота, 1,344 л (н.у.) СО2 и 1,26 г воды. Определите молекулярную формулу вещества, зная, что в указанной навеске вещества содержится 1,204∙1022 молекул.






 ) относительная плотность по кислороду равна 4,44
) относительная плотность по кислороду равна 4,44


















