Методическая разработка урока по химии для учащихся 9 класса.
Тема урока: «Общая характеристика металлов».
Тип урока: урок - семинар.
Образовательные результаты урока:
Предметные:
Углубить и обобщить знания обучащихся о металлах: положение металлов в периодической системе, строение простых веществ - металлов, нахождение в природе, способы получения металлов.
Метапредметные:
Продолжить формирование познавательного интереса к химии, выстраивание связей: состав → строение ® свойства ® применение. Формирование целостной естественно - научной картины мира путём интеграции науки химии с биологией, географией, физикой. Показать прикладное значение изучаемых вопросов.
Продолжить формирование таких общеучебных умений и навыков, как умение выдвигать гипотезу, наблюдать, сравнивать, обобщать, анализировать, строить умозаключения, т.е. привитие учащимся исследовательских навыков; умений самостоятельно работать с учебной литературой и составлять конспект по заданной теме.
Личностные:
Развитие коммуникативных качеств учащихся, чувства взаимопомощи, умения работать в условиях соревнования, способствовать обучению специфическим умениям коллективной деятельности.
Оборудование, оформление кабинета
Подготовлена слайдовая презентация по металлам; на доске нарисована заготовка - «будущий» конспект по теме «Металлы».
На столе учителя: цветные жетоны
На столах учащихся: листы с учебной информацией, периодические системы, конспекты – заготовки с «пробелами», сигнальные карточки с № 1-4 для проведения экспресс-теста.
Ход урока:
I этап. Вступительное слово учителя:
Сегодня на уроке речь будет идти о хорошо знакомых вам элементах и простых веществах. Каких именно – постарайтесь догадаться сами. Я предлагаю вам по данным в слайдах подсказках «узнать» элемент и обосновать свою гипотезу. В ходе работы можно заработать жетоны, которые в конце урока переведем в оценки. По подсказкам на слайдах учащиеся догадываются, что речь идет об элементах и простых веществах: железо, алюминий, медь, натрий, серебро.
Каким одним словом можно объединить угаданные элементы? Все они металлы.
Учитель предлагает учащимся найти на парте металлические предметы и просит одного из учеников их перечислить, а также объяснить, каким образом он разделил предметы на металлические и неметаллические. Выясняется, что все металлы имеют сходные физические свойства: металлический блеск, электро- и теплопроводность, они пластичные, ковкие.
Причина сходства физических свойств металлов, видимо, кроется в их строении. Делается акцент на то, что самым важным умением, приобретенным на уроке, является умение выстраивать связь: состав → строение → свойства → применение металлов.
II этап. Перед каждым учащимся лежит заготовка – «будущий» конспект с большим количеством пробелов, которые надо будет заполнить. Предлагается в течение 5 минут поработать с текстом, заполнить пробелы в своем блоке и быть готовым рассказать одноклассникам о своем блоке учебного материала. Микрогруппы учащихся самостоятельно работают над следующими вопросами темы:
1) Положение металлов в Периодической системе, особенности строения атомов металлов;
2) Химическая связь, кристаллическая решетка у металлов и сплавов;
3) Классификация металлов;
4) Нахождение металлов в природе;
5) Получение металлов.
Представителям микрогрупп предлагается «поделиться» ключевой информацией по своему блоку с одноклассниками; одновременно заполняются пробелы в конспекте.
III этап. Учитель предлагает учащимся ответить на вопросы экспресс-теста по теме «Металлы» при помощи сигнальных карточек с № ответов 1-4.
А) У большинства металлов на внешнем уровне число электронов:
1) 4-8; 2) 1-3; 3) 5; 4) 0.
Б) В металлах и сплавах кристаллическая решетка:
1) ионная; 2) атомная; 3) металлическая; 4) молекулярная.
В) В каком виде можно обнаружить в природе серебро?
1) в виде самородков и в виде соединений; например, сульфидов;
2) исключительно в виде солей;
3) в виде оксида и гидроксида серебра;
4) в виде соединения – нитрата серебра.
Г) Каким промышленным способом получают металлический натрий?
1) электролизом раствора NaCl;
2) электролизом расплава NaCl;
3) пирометаллургическим способом;
4) гидрометаллургическим способом.
Д) Какое физическое свойство не характерно для металлов:
1) пластичность; 2) электропроводность; 3) теплопроводность; 4) хрупкость.
Учитель просит поднять руки тех, кто дал 4 или 5 правильных ответов. Эти учащиеся успешно усвоили учебный материал. Тем, кто дал 3 и менее правильных ответа, советует еще раз вернуться к повторению данной темы.
Учитель отмечает самых активных учащихся, заработавших наибольшее количество жетонов, подводит итог урока, благодарит учащихся за работу. Подчеркивает, что полученные учащимися умения необходимы для научно-исследовательской деятельности.
В финале урока можно сделать мини-фейерверк, поджигая пропитанные солями различных металлов и высушенные комочки ваты, объяснив, что цвет пламени зависит от иона металла, входящего в состав соли.
Заключительное слово учителя:
Сегодня на уроке я вам выдавала жетоны, а теперь попрошу вас оставить мне на память жетоны, они будут отражать ваше состояние на уроке.
- жетон красного цвета – активность;
- жетон жёлтого цвета – интересно;
- жетон зелёного цвета – полезно;
- жетон серого цвета – скучно.
Можно воспользоваться жетонами разных цветов.
Приложения (листы с учебной информацией, заданиями)
ПРОСТЫЕ ВЕЩЕСТВА - МЕТАЛЛЫ
Задание:
Разделите имеющиеся перед вами предметы на 2 группы: металлические и неметаллические. По каким признакам вы их разделили? Попытайтесь на основе наблюдений и жизненного опыта охарактеризовать физические свойства металлов.
Внимательно изучите нижеприведённый материал, описывающий строение металлов.
Простые вещества – металлы образованы посредством металлической химической связи.
Металлы имеют различные кристаллические решётки. Примеры приведены ниже.
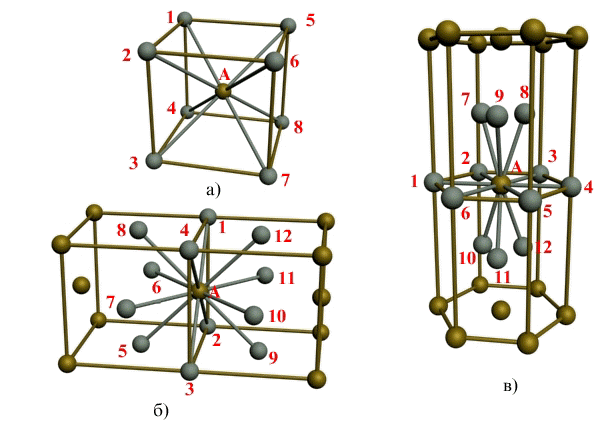
Рис.1. Типы металлических кристаллических решёток: а - кубическая объёмно-центрированная решётка; б - кубическая гранецентрированная решётка; в - гексагональная решётка.
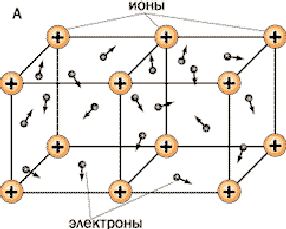 Что находится в узлах кристаллической решётки?
Что находится в узлах кристаллической решётки?
Металлы относительно легко отдают электроны, при этом протекает
процесс  .В узлах кристаллической решётки находятся
.В узлах кристаллической решётки находятся
ионы или атомы, а освободившиеся электроны принадлежат сразу всем
ионам и атомам металла, т.е. являются обобществлёнными; их ещё
называют «электронный газ» ( см. рис.2).
Такую кристаллическую решётку имеют металлы, сплавы, карбиды
металлов.
Рис.2. Фрагмент
кубической объёмно-центрированной решётки.
Найдите объяснение таким физическим свойствам металлов, как пластичность, металлический
блеск, высокая тепло- и электропроводность, исходя из строения их кристаллических решёток.
МЕТАЛЛЫ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ Д.И.МЕНДЕЛЕЕВА.
Задание: приготовьте на 2-3 минуты рассказ на заданную тему, исходя из ответов на следующие вопросы. Для ответа на вопрос используйте материал учебника Х-9, параграф 38 (В.В.Еремин и др)
Чем металлы отличаются от неметаллов по строению атомов? (вспомните, в каких случаях атом будет отдавать электроны, а в каких - принимать).
Вспомните, как изменяются восстановительные свойства вдоль групп, периодов.
Будут ли являться металлами d и f- элементы? Объясните большое разнообразие степеней окисления у d-элементов.
Сделайте предположение о том, где в периодической системе Д.И.Менделеева находятся металлы.
МЕТАЛЛЫ В ПРИРОДЕ
Задание:
Подумайте, от чего зависит, в каком состоянии (свободном или связанном) металл будет находиться в природе. Приготовьте на 2 минуты рассказ с конкретными примерами. (Можно воспользоваться материалом учебника Х-9, параграф 38 (авторы: В.В.Еремин и др.).
КЛАССИФИКАЦИЯ МЕТАЛЛОВ
Задание: приготовьте рассказ, исходя из приведённого ниже материала.
В основу классификации металлов можно положить различные параметры. В технике металлы принято делить на группы по следующим признакам:
по цвету металлы


чёрные цветные
(Fe,Сr,Mn и их) (Zn,Сu,Ni и др.)
сплавы
по плотности металлы


лёгкие тяжёлые
( p
 5 г/см3) (p 5 г/см3)
5 г/см3) (p 5 г/см3)
Li, K,Ca, Al и др. Sn, Pb, Fe, Hg,Оs
самый лёгкий - самый тяжёлый -
Li ( p = 0,53 г/см3 ) Оs ( p = 22,5 г/см3 )
по твёрдости металлы


мягкие твёрдые
(щелочные, щелочно-) ( Cr,W, Оs )
земельные металлы
по температуре плавления металлы


легкоплавкие тугоплавкие
( 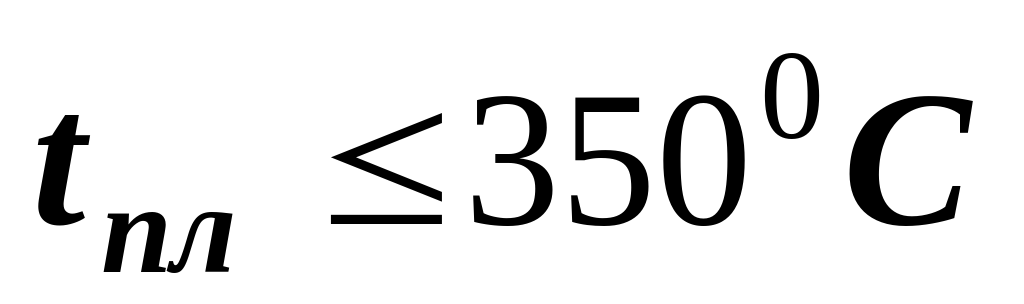 ) (
) (  )
)

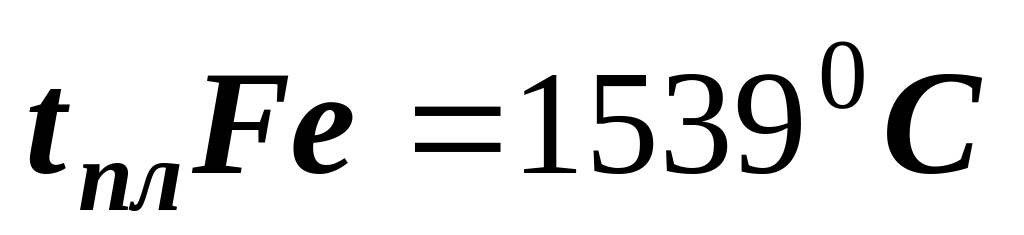
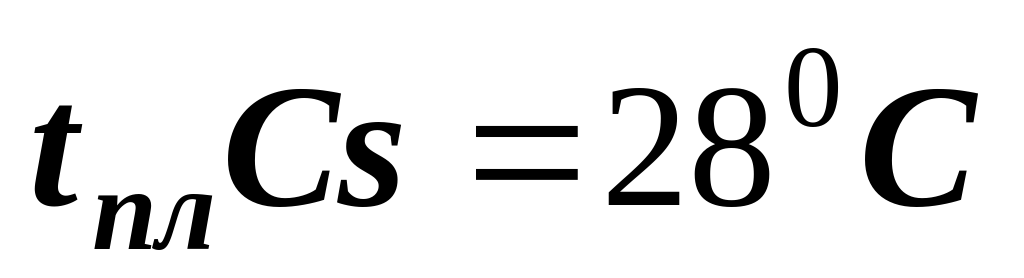
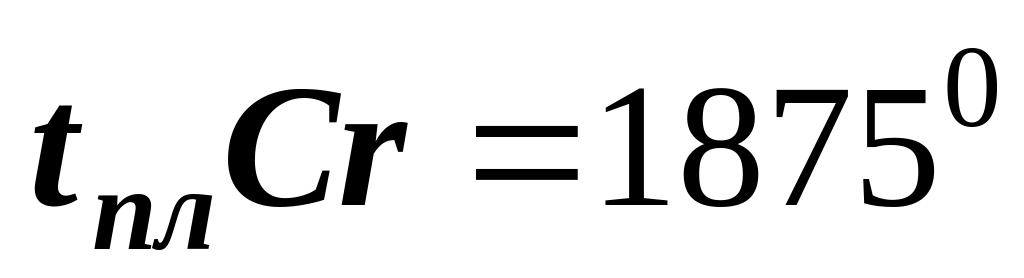
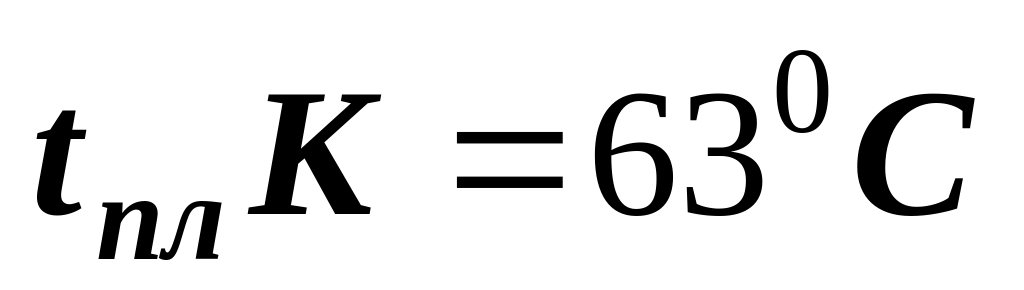

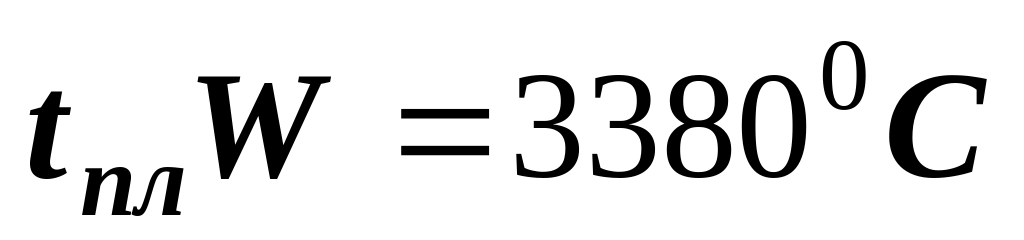
 (самый тугоплавкий)
(самый тугоплавкий)
по электропроводности. Наибольшую электропроводность имеют Ag, затем Cu, Au, Сr, Al, Мg.
Ответьте на вопрос: где находит применение большая электропроводность Сu ?
Из механических свойств для металлов характерны:
- пластичность ( свойство металла деформироваться без трещин под действием определённой нагрузки);
- ковкость (свойство металла деформироваться без трещин под влиянием сжатия при температурах ниже температуры плавления);
- тягучесть (способность металла вытягиваться в нить).
Наибольшей пластичностью, ковкостью и тягучестью обладает золото: из него можно изготовить пластинки толщиной 0,003 мм и вытягивать в проволоку, невидимую невооружённым глазом.
Ответьте на вопрос: с каким свойством алюминия связано изготовление из него алюминиевой фольги, обёрток для конфет, пакетов для цветов?
ПОЛУЧЕНИЕ МЕТАЛЛОВ
Большинство металлов в природе встречаются в виде соединений. Значит, для получения металлов из их природных соединений нужно восстановить ионы металлов: 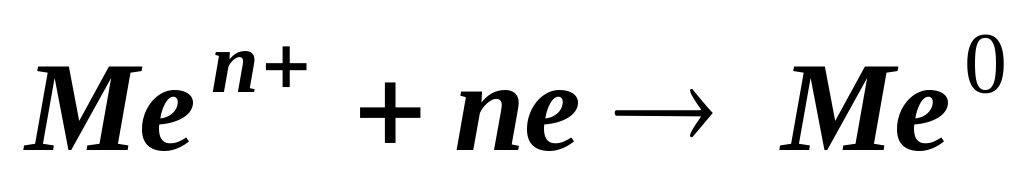 . Реализация этого процесса в промышленности может быть разной. В качестве восстановителей могут быть использованы С, СО, другой металл, электрический ток, водород; причём применяемые для восстановления вещества не должны взаимодействовать с образующимися в процессе реакции металлами. Существует несколько способов получения металлов, в соответствии с этим отрасли металлургии делят на пирометаллургию, металлотермию, электрометаллотермию и гидрометаллургию.
. Реализация этого процесса в промышленности может быть разной. В качестве восстановителей могут быть использованы С, СО, другой металл, электрический ток, водород; причём применяемые для восстановления вещества не должны взаимодействовать с образующимися в процессе реакции металлами. Существует несколько способов получения металлов, в соответствии с этим отрасли металлургии делят на пирометаллургию, металлотермию, электрометаллотермию и гидрометаллургию.
ГИДРОМЕТАЛЛУРГИЯ
В настоящее время получил широкое распространение гидрометаллургический способ получения металлов из их солей. Такие растворы образуются при обработке руд, содержащих, например, оксиды металлов, кислотами. При этом могут протекать следующие превращения:
 .
.
Из раствора соли металл выделяют действием более активного металла или с помощью электрического тока. Таким способом получают 25% всей добываемой меди, а также Ag, Zn, Cd и другие металлы. Он имеет большое будущее, т.к. не требует извлечения руды на поверхность и даёт возможность перерабатывать бедные руды.
ПИРОМЕТАЛЛУРГИЯ
Если природная руда содержит сульфиды металлов, то их обычно обжигают на воздухе.
Задание: напишите на доске уравнения протекающих при этом химических реакций на примерах сульфидов и : 1)
Ответьте на вопрос: в каком производстве можно использовать полученный оксид серы (IV)?
В дальнейшем для получения металла используют какой - либо сравнительно недорогой восстановитель. Углём восстанавливают те металлы, которые не образуют прочных карбидов ( и др.). Примером может служить следующая реакция: .
А, например, таким способом получать нельзя, т.к. протекает реакция с образованием карбида:
.
МЕТАЛЛОТЕРМИЯ
Это способ восстановления металлов другими металлами; его применяют, если нет возможности получить металлы с помощью дешёвых восстановителей и . Особенно распространена алюмотермия - получение металлов при помощи алюминия. Примером могут служить следующие реакции: 1) ; 2) .
Щелочные и щелочноземельные металлы таким способом получать не рекомендуется, т.к. требуется дорогая аппаратура, изолирующая их от кислорода воздуха.
ЭЛЕКТРОМЕТАЛЛУРГИЯ
Щелочные и щелочноземельные металлы получают электролизом расплавов их солей, чаще всего хлоридов. Примером могут служить следующие реакции:





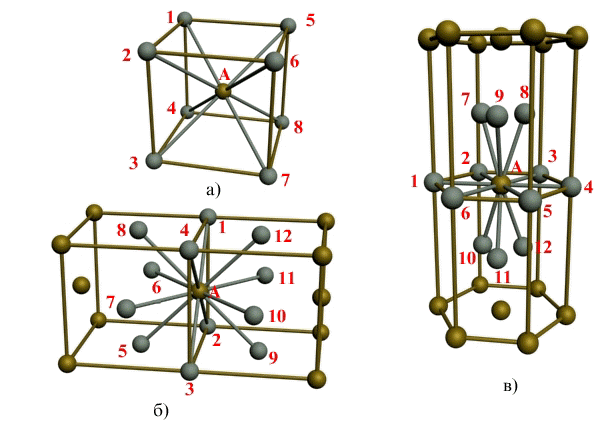
 Что находится в узлах кристаллической решётки?
Что находится в узлах кристаллической решётки? 





















