Алюминий и его соединения (9 класс)
ЦЕЛЬ УРОКА: формирование системы знаний о строении и свойствах алюминия.
ЗАДАЧИ УРОКА:
Обучающие:
рассмотреть строение атома алюминия.
изучить нахождение алюминия в природе, способы получения и открытие этого элемента, физические и химические свойства, а также применение.
Развивающие:
развивать коммуникативные навыки через коллективный способ обучения; развивать навыки самостоятельной работы;
развивать устную и письменную речь учащихся;
привить любовь к предмету, желание познать новое.
продолжить формирование умений обрабатывать и анализировать экспериментальные данные, делать выводы о свойствах вещества.
Воспитывающие:
воспитывать культуру умственного труда;
воспитывать информационную культуру;
воспитывать потребность добиваться успехов в приобретении знаний;
воспитание навыков самоконтроля и взаимоконтроля, развитие самостоятельности и творчества.
СРЕДСТВА ОБУЧЕНИЯ:
компьютерная презентация, таблица растворимости,
электрохимический ряд напряжения металлов,
периодическая система Д. И. Менделеева,
химическое оборудование и реактивы ( алюминий металлический, раствор щелочи, кислоты, сульфата меди, штатив с пробирками)
ТИП УРОКА: комбинированный урок с демонстрационными опытами, направлен на изучение нового материала.
ФОРМА ОБУЧЕНИЯ : индивидуальная, фронтальная работа.
Методы и приемы обучения: проблемный, демонстрационный химический эксперимент, устные ответы у доски, самостоятельная работа с текстами, самоконтроль.
Структура урока:
I этап. Организационный момент.
II этап. Актуализация знаний учащихся
III этап. Изучение нового материала.
IV этап. Закрепление изученного материала и подведение итогов урока
V этап. Домашнее задание.
VI этап. Заключительное слово.
I этап. Организационный момент (2 мин).
Вступительное слово учителя. Сообщение целей и темы урока.
Здравствуйте ребята. Продолжим изучение общих свойств металлов. И сегодня нам предстоит познакомиться с металлом хорошо знакомым вам с детства.
"Однажды к римскому императору Тиберию пришёл незнакомец. В дар императору он принёс изготовленную им чашу из блестящего, как серебро, но чрезвычайно лёгкого металла. Мастер поведал, что получил этот металл из "глинистой земли". Но император, боясь, что обесценятся его золото и серебро, велел отрубить мастеру голову, а его мастерскую разрушить". О каком металле идёт речь? О алюминии Верно.
Итак, именно о этом металле сегодня пойдет речь. Запишем тему урока «Алюминий и его соединения»
Записывают тему урока
II этап. Актуализация знаний учащихся (3 мин)
Фронтальная беседа с учащимися по вопросам
Давайте вспомним и обобщим изученные ранее нами свойства металлов:
1) Какие особенности строения имеют атомы металлов?
1) 1-3 e на внешнем уровне, большие радиусы атомов;
2)Перечислите общие физические свойства металлов?
2) металлический блеск, пластичность, высокие тепло- и электропроводность и т.д.;
3)Назовите общие химические свойства металлов?
3)взаимодействуют с простыми веществами: кислородом и другими неметаллами; со сложными веществами: водой, кислотами, солями и оксидами менее активных металлов;
III этап. Изучение нового материала (29 мин)
Строение атома алюминия 4 мин
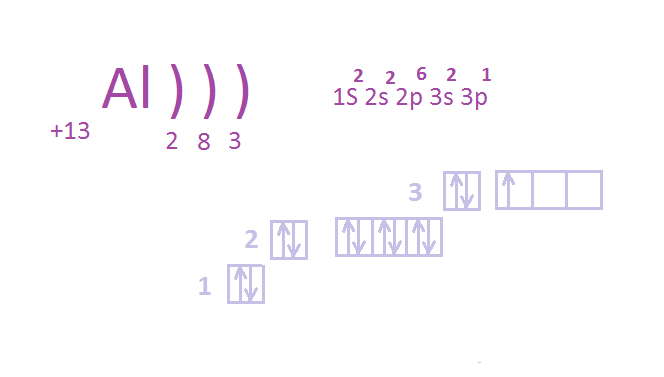
Схема составлена правильно. Сколько у атома алюминия на внешнем уровне электронов и какую соответственно проявляет валентность и степень окисления? На внешнем уровне у атома алюминия 3 электрона (2s и 1p), следовательно, алюминий проявляет валентность III и степень окисления +3, 0.
Физические свойства алюминия
Беседа с учащимися по вопросам
1. В каком агрегатном состоянии находится алюминий при данных условиях? (твердый).
2. Какого цвета алюминий? Имеет ли блеск? (серебристо-белый с металлическим блеском)
3. Имеет ли алюминий запах? (без запаха).
Пластичный. В воде нерастворим. Температура плавления алюминия 660 С. Плотность 2,7 г/см3. Алюминий обладает теплопроводностью и электропроводностью
Химические свойства 6 мин
А) взаимодействие с простыми веществами: кислород, хлор.
4Al + 3O2 = 2Al2O3
Восст-ль Al0- 3е = Al+3 4 окисление
Окис- ль O20 + 4е =2O-2 3 восстан-е
Если порошок алюминия или тонкую алюминиевую фольгу сильно нагреть, то они воспламеняются и сгорают ослепительным пламенем. Происходит окисление. Запишите в тетрадях уравнение реакции окисления алюминия. (один ученик пишет уравнение).
С какими еще веществами будет взаимодействовать алюминий? При обычных условиях алюминий реагирует лишь с хлором и бромом, с остальными неметаллами реакции протекают при нагревании. Запишите уравнение реакции алюминия с хлором в тетради.
4Al + Cl2 = 2AlCl3 хлорид алюминия
Алюминий также взаимодействует и с другими простыми веществами.
2Al + 3S = Al2S3 сульфид алюминия 4Al +3C = 2Al4C3 карбид алюминия
Б) Взаимодействие со сложными веществами 9 мин
С какими сложными веществами взаимодействуют металлы и алюминий в том числе? С водой. Верно, но при условии, что с его поверхности будет удалена оксидная пленка
2Al + 6H2O = 2Al(OH)3 + 3H2
Восст-ль Al0- 3е = Al+3 2
окисление
Окис- ль 2Н+ + 2е =Н20 3
восстан-е
Так почему же с предметами, изготовленными из алюминия, которые мы используем в быту, ничего не происходит? Например, алюминиевая посуда не взаимодействует ни с воздухом, ни с водой.
Потому что поверхность алюминия покрывается очень прочной тонкой оксидной пленкой, которая защищает металл от воздействия воздуха и воды.
С какими еще сложными веществами будет взаимодействовать алюминий? И при каких условиях?
Действительно алюминий взаимодействует с растворами кислот с выделением водорода.
Демонстрационный опыт. Взаимодействие алюминия с кислотой.
Запишите уравнение реакции взаимодействия алюминия с соляной кислотой тетради (один ученик пишет уравнение реакции у доски).
Алюминий будет вытеснять водород, т.к. в ряду напряжения металлов он стоит правее водорода.
2Al + 6HCl = 2AlCl3 + 3H2
А концентрированные серная и азотная кислоты пассивируют поверхность алюминия, образуя на его поверхности прочную оксидную пленку, которая препятствует дальнейшему протеканию реакции. Поэтому эти кислоты перевозят в алюминиевых цистернах.
Основываясь на то, что алюминий - переходный металл, подумайте, с какими еще сложными веществами может взаимодействовать алюминий?
Демонстрационный опыт. Взаимодействие алюминия с щелочами
Запишем уравнение реакции взаимодействия алюминия с раствором гидроксида натрия. Что образуется в результате реакции? (Учитель пишет уравнение реакции на доске)
2Al + 2NaOH + 6H2O = 2Na[Al(OН)4 ] + 3H2
Данная реакция протекает с образованием алюмината натрия и выделением газообразного водорода.
В) с солями
Алюминий вытесняет из растворов солей менее активные металлы
Демонстрационный опыт 2 Al + 3CuSO4=Al2(SO4)3+ 3 Cu
Нахождение в природе 5 мин
Учащиеся самостоятельно составляют схему в каких минералах содержится алюминий
По распространенности в природе среди всех элементов алюминий занимает 3 место, а среди металлов 1 (содержание его в земной коре 7%).
Какой можно сделать вывод о нахождении алюминия в природе? Алюминий в природе встречается только в виде соединений. Алюминий - это активный металл. Т.к. в природе он содержится только в виде соединений и в свободном виде не встречается. В электрохимическом ряду напряжений он находится сразу же после щелочных и щелочноземельных металлов, что говорит о его высокой активности
Получение 5 мин
Оксид алюминия растворяют в расплаве криолита Na3AlF6 c использованием графитовых электродов. Метод энергоемкий поэтому в России заводы по получению алюминия находятся на Урале, Западной и Восточной Сибири вблизи ГЭС или ГРЭС. Это Хакасский, Новокузнецкий, Братский, Красноярский металлургические комбинаты. Чистый алюминий плавится при 2050оС, .не растворяется в воде ввиду наличия оксидной пленки. В результате электролиза температура понижается до 1000оСВ присутствии AlF3получается технический алюминий. Образуется AlF (одновалентный), который легко возгоняется и распадается при 800оС и таким образом получается чистый алюминий.
Применение
1)в электротехнике
2) для производства легких сплавов (дюралюмин, силумин) в самолето– и автомобилестроении
3)для покрытия чугунных и стальных изделий с целью повышения их коррозионной стойкости
4)для термической сварки
Как вы думаете, будет ли протекать следующая реакция?
Al + Fe3O4 = ?
Данная реакция будет протекать, так как алюминий в электрохимическом ряду напряжений стоит правее железа, то есть он будет вытеснять железо из его оксида.
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
Т. к. выделяется большое количество теплоты, этот процесс применяют при сварке стальных изделий.
5)для получения редких металлов в свободном виде
Алюминотермия - это способ восстановления многих металлов из их оксидов с помощью алюминия, если в электрохимическом ряду напряжения металл расположен после алюминия.
6)в строительной промышленности
7) для изготовления контейнеров, фольги и т.п.
IV этап. Закрепление изученного материала и подведение итогов урока (3 мин).
Отлично поработали. Давайте поверим усвоенные нами знания. Что нового сегодня узнали на уроке?
V этап. Домашнее задание (1 мин).
VI этап. Заключительное слово (2 мин).
Вывод: “Алюминий – металл современного технологического мира!”
Учитель благодарит учащихся за сотрудничество, выставляет оценки выступающим у доски
Если осталось время. Задания на слайд.
Часть А.
Закончить уравнения реакции, назвать
Al + Br2
Al + H2SO4 (p-p)
Часть В. *
Написать уравнения реакций для схемы, назвать
Al →Al2O3 → AlCl3
Al →AlCl3 →Al2(SO4)3
Назовите продукты реакций.
Часть С. **
Написать уравнения реакций для схемы, назвать
Al →Al (OH)3 → Na[Al(OH)4]
Al → Al2 O3 →NaAlO2



























