Лабораторная работа № 1
Тема: «Качественное обнаружение углерода и водорода в органических веществах».
Цель: обнаружение углерода и водорода в органических соединениях качественным методом анализа.
Оборудование: металлический штатив с муфтой и лапкой, спиртовка, пробирки, штатив для пробирок, газоотводная трубка с пробкой, спички.
Реактивы: парафин, баритовая или известковая вода, оксид меди (II), безводный сульфат меди (II), дистиллированная вода.
Выполнение работы:
Присутствие углерода в органических соединениях в большинстве случаев можно обнаружить по обугливанию вещества при осторожном его прокаливании.
Наиболее точным методом открытия углерода и одновременно с ним водорода является сжигании органического вещества в смеси с порошком оксида меди (II). Углерод образует с кислородом оксида меди (II) углекислый газ, а водород – воду. Оксид меди (II) восстанавливается до металлической меди, например:
C13H28 + 40CuO 13CO2 + 14H2O + 40Cu
Опыт № 1. Определение углерода и водорода в органическом соединении (парафин).
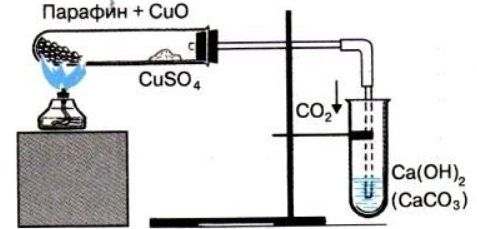
Ход работы:
Смесь 1,0-2,0 г оксида меди (II) и 0,2 г парафина хорошо перемешайте и поместите на дно пробирки. Сверху насыпьте немного оксида меди (II).
В верхнюю часть пробирки поместите тонкий слой белого порошка безводного сульфата меди (II). Закройте пробирку пробкой с газоотводной трубкой.
Укрепите пробирку в лапке штатива. Нижний конец газоотводной трубки должен быть погружен в пробирку с баритовой водой (насыщенный раствор гидроксида бария) или известковой водой (насыщенный раствор гидроксида кальция).
Нагрейте пробирку в пламени спиртовки. Если пробка плотно закрывает пробирку, то через несколько секунд из газоотводной трубки начнут выходить пузырьки газа.
Как только баритовая или известковая вода потемнеет, пробирку с ней следует удалить и продолжать нагревание, пока пары воды не достигнут белого порошка сульфата меди (II) и не вызовут его посинение.
После изменения окраски сульфата меди (II) следует прекратить нагревание.
| Краткая запись работы (уравнение) | Краткое содержание наблюдений |
|
В тетради! |
Вывод:
Лабораторная работа № 2
Тема: Предельные углеводороды. Получение и свойства метана.
Цель работы: Синтез метана и исследование его свойств.
Реактивы: обезвоженный ацетат натрия и натронная известь (смесь Ca(OН)2 и NaOH).
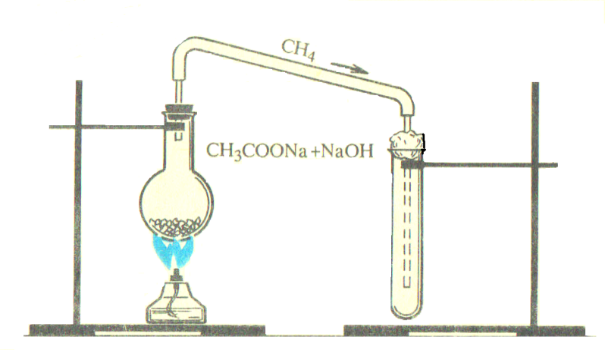
Ход работы:
Соберите прибор, изображенный на рисунке.
Опыт №1. Получение метана.
В пробирку поместите равное количество порошков ацетата и гидроксида натрия (рис. 1). Пробирку закройте пробкой с газоотводной трубкой и закрепите на штативе. Сильно нагревая пробирку со смесью, соберите газ методом вытеснения воды в другую пробирку. Образующийся метан используйте для изучения его физических свойств.
Опыт №2. Горение метана и изучение его физических свойств.
Заполните метаном цилиндр. Обратите внимание на агрегатное состояние метана, цвет, растворимость в воде. Подожгите выделяющийся газ.
Сделайте заключение об агрегатном состоянии метана, определите цвет, растворимость в воде.
Каким пламенем горит метан? Почему? Какие соединения образуются при горении метана? Напишите уравнение реакции горения метана.
Опыт 3. Отношение метана к раствору перманганата калия и бромной воде.
Пропустите метан через раствор перманганата калия и бромной воды.
Как изменяется окраска раствора перманганата калия и бромной воды при пропускании через них метана? Сделайте вывод об отношении метана к окислителям.
Сделайте вывод о реакционной способности метана и предельных углеводородов в целом.
Сделайте вывод о свойствах метана.







 Ход работы:
Ход работы: 
















