Просмотр содержимого документа
«Методическая разработка к теме "Хлор"»

Косаченко Н.А., учитель химии

Хлор (Cl) - элемент VII A группы
Степени окисления
-1,0,+3,+5,
+7

История открытия
В 1774 К. Шееле выделил хлор в свободном виде, нагревая черный минерал пиролюзит с концентрированной соляной кислотой:
4HCl + MnO 2 = Cl 2 + MnCl 2 + 2H 2 O

Распространение в природе
Хлор – активный элемент
В природе он встречается только в виде соединений-хлоридов. Наиболее распространен NaCI-содержится в воде морей, океанов, многих озер
в составе минералов: сильвинита
KCl · NaCl,
карналлита KCl · MgCl 2 · 6Н 2 O,
Входит в состав хлорофилла
Самые большие запасы хлора содержатся в составе солей вод морей и океанов
В организме человека и животных хлор содержится в основном в межклеточных жидкостях (в том числе в крови) и играет важную роль в регуляции осмотических процессов, а также в процессах, связанных с работой нервных клеток.
В природе встречаются 2 стабильных изотопа хлора: с массовым числом 35 и 37.

Физические свойства
Хлор -ядовитый газ желтовато-зелёного цвета, с резким, удушающим запахом, раздражает слизистую оболочку органов дыхания и разрушает легкие.
В 2,5 раз тяжелее воздуха, работать с хлором нужно только в вытяжном шкафу. При повышенном давлении хлор легко сжижается.

Способы получения хлора
А) электролиз раствора хлорида натрия
2NaCl + 2H 2 O = 2NaOH + H 2 + Cl 2
Б ) электролиз расплава хлорида натрия
2NaCl = 2Na + Cl 2

Способы получения хлора
Хлор получают нагреванием концентрированной соляной кислоты с сильными окислителями: MnO 2 , KMnO 4 , K 2 Cr 2 O 7 и др.:
16HCl + 2KMnO 4 = 5Cl 2 + 2MnCl 2 + 2KCl + 8H 2 O.

Химические свойства хлора
- Взаимодействие с простыми веществами:
1. С металлами:
- 2 К+ С l 2 =2 KCl (при нагревании)
- 2Fe+3Cl 2 =2FeCl 3 (при нагревании )
- При незначительном нагревании хлор окисляет даже золото:
2 А u+3Cl 2 =2AuCl 3

Химические свойства хлора
- Взаимодействие с водородом:
- Н 2 +С l 2 =2HCL
- Взаимодействие с другими неметаллами
- 5Cl 2 + 2 P= 2PCl 5
- Cl 2 +S=SCl 2
Исключения : нет реакции с O 2 , C , N 2 ,благородными газами.

Химические свойства хлора со сложными веществами
- 1. С водой (образуется смесь соляной и хлорноватистой кислоты)
- Хлорную воду хранят в темноте на холоде, в хорошо закрытой склянке, т.к. хлорноватистая кислота не устойчива и разлагается:
- HClO= HCl+ O ( на свету)
- O+O=O 2
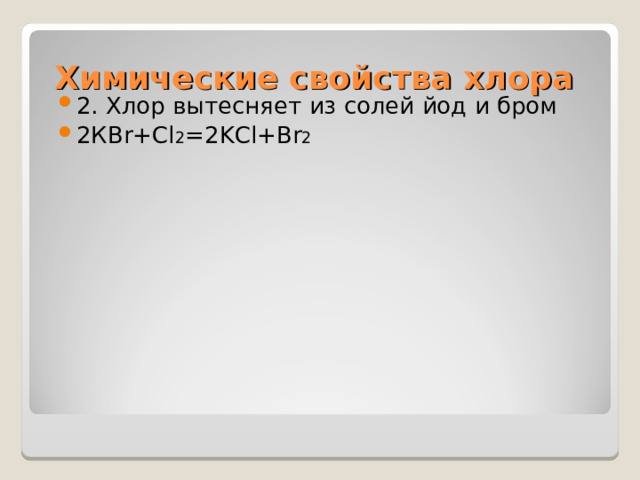
Химические свойства хлора
- 2. Хлор вытесняет из солей йод и бром
- 2 К Br+Cl 2 =2KCl+Br 2

Применения хлора
- 1. Получение брома и йода;
- 2.Производство хлороводорода и соляной кислоты;
- 3.Получение хлорной извести, используемой для дезинфекции, беления тканей, бумаги;
- 4.хлорирование воды;
- 5.Получение хладагентов ( рабочее вещество холодильной машины, которое при кипении отнимает теплоту от охлаждаемого объекта и затем после сжатия передаёт её охлаждающей среде за счёт конденсации (воде, воздуху и т. п.).





































