
Элементтер химиясы. Дәріс
VI Б-топша элементтерінің жалпы сипаттамасы. Хром
VI Б - топша элементтері
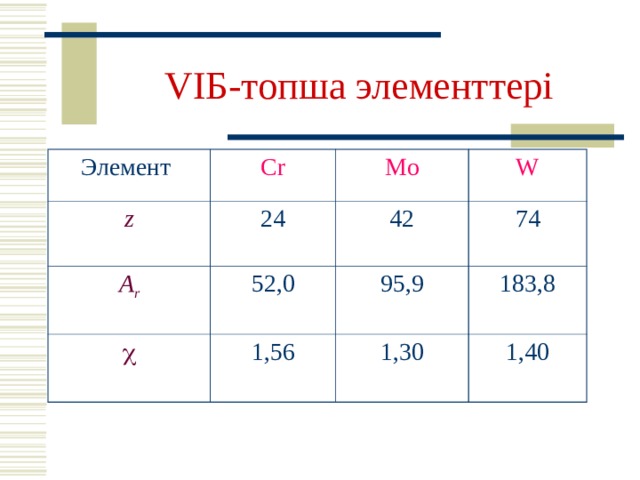
Элемент
Cr
z
24
Mo
A r
W
42
5 2 , 0
1,56
74
95,9
183,8
1,30
1,40
![Электрондық құрылысы Cr : […] 4 s 1 3 d 5 4 p 0 Mo: […] 5 s 1 4 d 5 5 p 0 W: […] 6 s 2 4 f 14 5 d 4 6 p 0 Cr, Mo: np 0 ( n – 1) d 5 ns 1 Валенттілік (КС): Cr 6; Mo 6, 8; W 6, 8, 9; Тотығу дәрежесі : 0, +II, +III , +IV, +VI ( Cr ); 0, +IV, + VI ( Mo, W )](https://fsd.multiurok.ru/html/2020/12/21/s_5fe047898586a/img2.jpg)
Электрондық құрылысы
- Cr : […] 4 s 1 3 d 5 4 p 0
- Mo: […] 5 s 1 4 d 5 5 p 0
- W: […] 6 s 2 4 f 14 5 d 4 6 p 0
Cr, Mo:
np 0
( n – 1) d 5
ns 1
- Валенттілік (КС): Cr 6; Mo 6, 8; W 6, 8, 9;
- Тотығу дәрежесі : 0, +II, +III , +IV, +VI ( Cr ); 0, +IV, + VI ( Mo, W )
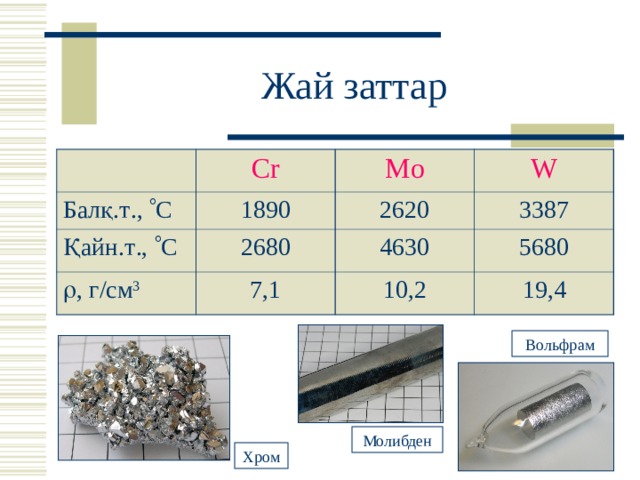
Жай заттар
Cr
Балқ.т ., С
1890
Mo
Қайн.т ., С
, г/см 3
W
2620
2680
3387
7,1
4630
5680
10,2
19, 4
Вольфрам
Молибден
Хром
![Жай заттар Cr , В – 0, 70 ( Cr 3+ /С r ) үшін – 0,85 для ( Cr 2+ /С r ) Mo W 0,00 ( MoO 3 /Mo) үшін – 0,09 ( WO 3 / W ) үшін Cr + 2H 3 O + + 4H 2 O = [Cr(H 2 O) 6 ] 2+ + H 2 Mo(W) + H 3 O + ](https://fsd.multiurok.ru/html/2020/12/21/s_5fe047898586a/img4.jpg)
Жай заттар
Cr
, В
– 0, 70 ( Cr 3+ /С r )
үшін
– 0,85 для ( Cr 2+ /С r )
Mo
W
0,00
( MoO 3 /Mo) үшін
– 0,09 ( WO 3 / W ) үшін
Cr + 2H 3 O + + 4H 2 O = [Cr(H 2 O) 6 ] 2+ + H 2
Mo(W) + H 3 O +
![Жай заттар Тотықтырғыш қышқылдар (суықта пассивтену): Э VI Б + HNO 3 ( конц ), H 2 SO 4 ( конц ) Э ( Mo,W ) + 2HNO 3 + 8HF = = Н 2 [ Э VI F 8 ] + 2NO + 4H 2 O Э + 8 HF – 6 e – = [ Э F 8 ] 2– + 2 H + NO 3 – + 4H + + 3 e – = NO + 2 H 2 O Э ( Cr,Mo,W ) + 3NaNO 3 + 2NaOH = = Na 2 Э VI O 4 + 3NaNO 2 + H 2 O Cr + NaOH ( р) ](https://fsd.multiurok.ru/html/2020/12/21/s_5fe047898586a/img5.jpg)
Жай заттар
- Тотықтырғыш қышқылдар (суықта пассивтену): Э VI Б + HNO 3 ( конц ), H 2 SO 4 ( конц )
- Э ( Mo,W ) + 2HNO 3 + 8HF =
= Н 2 [ Э VI F 8 ] + 2NO + 4H 2 O
Э + 8 HF – 6 e – = [ Э F 8 ] 2– + 2 H +
NO 3 – + 4H + + 3 e – = NO + 2 H 2 O
- Э ( Cr,Mo,W ) + 3NaNO 3 + 2NaOH =
= Na 2 Э VI O 4 + 3NaNO 2 + H 2 O

Металдар
Электролиттік хром
Вольфрам қыл
Вольфрам монокристалл
Молибден сым, престелген молибден
Усиление кислотных свойств
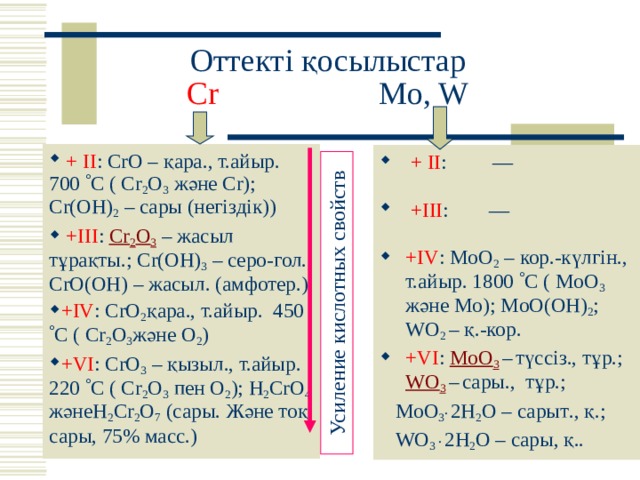
Оттекті қосылыстар Cr Mo, W
- + II : CrO – қара . , т.айыр. 700 C ( Cr 2 O 3 және Cr ) ; Cr ( OH ) 2 – сары (негіздік) )
- +III : Cr 2 O 3 – жасыл тұрақты . ; Cr ( OH ) 3 – серо- гол. ; CrO ( OH ) – жасыл . (амфотер.)
- + IV : CrO 2 қара ., т.айыр. 450 C ( Cr 2 O 3 және O 2 )
- +VI : CrO 3 – қызыл . , т.айыр. 220 C ( Cr 2 O 3 пен O 2 ) ; H 2 CrO 4 және H 2 Cr 2 O 7 (сары . Және тоқ сары, 75% масс.)
- +IV : MoO 2 – кор . -күлгін . , т.айыр. 1800 C ( MoO 3 және Mo ) ; MoO ( OH ) 2 ; WO 2 – қ . -кор .
- +VI : MoO 3 – түссіз., тұр. ; WO 3 – сары . , тұр. ;
MoO 3 . 2H 2 O – сарыт . , қ. ;
WO 3 . 2 H 2 O – сары, қ..
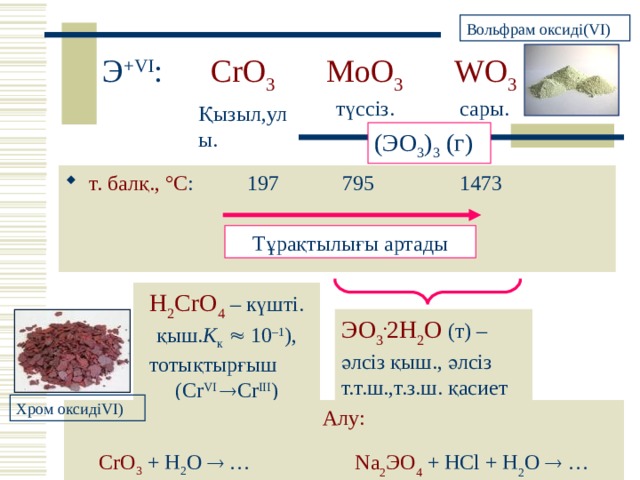
Вольфрам оксиді (VI)
Э +VI : CrO 3 MoO 3 WO 3
түссіз.
сары .
Қызыл,улы .
(Э O 3 ) 3 ( г)
- т. балқ., ° С : 197 795 1473
Тұрақтылығы артады
H 2 CrO 4 – күшті . қыш. K к 10 – 1 ) , тотықтырғыш ( Cr VI Cr III )
ЭО 3 . 2Н 2 О ( т ) – әлсіз қыш., әлсіз т.т.ш.,т.з.ш. қасиет
Хром оксиді VI)
Алу:
CrO 3 + H 2 O … Na 2 Э O 4 + HCl + H 2 O …
![Комплексті қосылыстар CO Тотығу дәр.0: [ Э 0 (CO) 6 ] [ Cr 0 (CO) 6 ] – гексакарбонилхром : диамагнитті OC CO Cr d 2 sp 3 , октаэдр CO OC CO [ Cr + (CO – /6 ) 6 ] | | = 0,4 e – 1 Cr Cr : : CO 6 CO ](https://fsd.multiurok.ru/html/2020/12/21/s_5fe047898586a/img9.jpg)
Комплексті қосылыстар
CO
- Тотығу дәр.0: [ Э 0 (CO) 6 ]
- [ Cr 0 (CO) 6 ] – гексакарбонилхром : диамагнитті
OC
CO
Cr
d 2 sp 3 , октаэдр
CO
OC
CO
[ Cr + (CO – /6 ) 6 ]
| | = 0,4 e –
1 Cr
Cr :
: CO
6 CO
![Комплексті қосылыстар Cr III CrCl 3 · 6H 2 O [Cr(H 2 O) 4 Cl 2 ]Cl · 2H 2 O жасыл [Cr(H 2 O) 6 ]Cl 3 күлгін [Cr(H 2 O) 4 Cl 2 ] + + 2 H 2 O [Cr(H 2 O) 6 ] 3+ + 2 Cl – + H 2 O, – t ° ( суыту ) – H 2 O, + H 3 O + , + t ° ( қыздыру )](https://fsd.multiurok.ru/html/2020/12/21/s_5fe047898586a/img10.jpg)
Комплексті қосылыстар Cr III
CrCl 3 · 6H 2 O
[Cr(H 2 O) 4 Cl 2 ]Cl · 2H 2 O
жасыл
[Cr(H 2 O) 6 ]Cl 3
күлгін
[Cr(H 2 O) 4 Cl 2 ] + + 2 H 2 O [Cr(H 2 O) 6 ] 3+ + 2 Cl –
+ H 2 O, – t ° ( суыту )
– H 2 O, + H 3 O + , + t ° ( қыздыру )

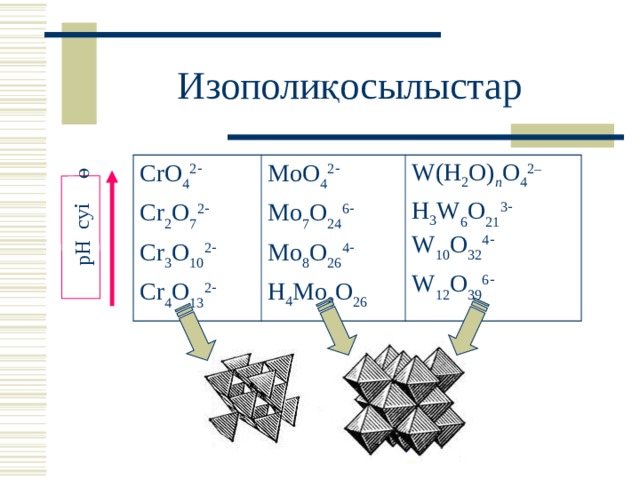
Изополиқосылыстар (т.д.+ VI )
- 2CrO 4 2 + 2H 3 O + Cr 2 O 7 2 + 3H 2 O; K c I 10 14
- 3Cr 2 O 7 2 + 2H 3 O + 2Cr 3 O 10 2 + 3H 2 O
………… .
- Cr 2 O 7 2 + 2OH – 2CrO 4 2 + H 2 O; K c III 10 14
Хромат ион мен дихромат ионның ерітінддегі тепе -теңдігі ( видеофрагмент)
рНөсуі
Изополиқосылыстар
CrO 4 2
Cr 2 O 7 2
Cr 3 O 10 2
Cr 4 O 13 2
MoO 4 2
Mo 7 O 24 6
Mo 8 O 26 4
H 4 Mo 8 O 26
W(H 2 O) n O 4 2–
H 3 W 6 O 21 3 W 10 O 32 4
W 12 O 39 6
![Пероксокомплекстер Cr 2 O 7 2 + 4H 2 O 2 + 2H 3 O + + L = = 2[ Cr VI (L)O(O 2 2 ) 2 ] + 7H 2 O көгілдір түсті (орг.еріткішпен экстракция ) O КС 6; пентагоналды пирамида L – эфир, пиридин … Cr L O O O O](https://fsd.multiurok.ru/html/2020/12/21/s_5fe047898586a/img13.jpg)
Пероксокомплекстер
Cr 2 O 7 2 + 4H 2 O 2 + 2H 3 O + + L =
= 2[ Cr VI (L)O(O 2 2 ) 2 ] + 7H 2 O
көгілдір түсті
(орг.еріткішпен экстракция )
O
- КС 6; пентагоналды пирамида
Cr
L
O
O
O
O

Сирек элемент
Табиғатта таралуы, қосылыстары
Молибденит
- хромит (Cr 2 III Fe II )O 4
- крокоит PbCrO 4
- молибденит MoS 2
- вольфрамит (Mn, Fe)WO 4
- шеелит CaWO 4
- 21 . Cr 0,019% масс .
- 39. Mo 1·10 –3 %
- 27. W 7·10 –3 %
Крокоит
Хромит
Вольфрамит
Шеелит

Минералы
Ферберит
Уваровит
Рубин
- г юбнерит MnWO 4
- п овеллит CaMoO 4
- м олибдошеелит Ca ( W , Mo ) O 4
- ф ерберит FeWO 4
Хром құрамына кіретін минералдар: александрит, рубин, аквамарин, изумруд , уваровит Ca 3 Cr 2 III ( SiO 4 ) 3 гранаттар туыстығы
Повеллит
Гюбнерит
Александрит
Аквамарин

Алу әдісі
Хром
- Cr 2 O 3 + 2Al = 2 Cr + Al 2 O 3 (t°)
- ( Cr 2 III Fe II )O 4 + 4C = Fe + 2Cr + 4CO
феррохром
- W O 3 + 3H 2 = W + 3H 2 O (t°)
- Mo O 3 + 3H 2 = Mo + 3H 2 O (t°)
Молибден қаңылтыр
Вольфрам (ұнтақ, пресстелген)
![Хром химиясы. Cr(II) Cr ( OH ) 2 – негіздік гидроксид, тотықсыздандырғыш Cr II ( OH ) 2 (қ) + O 2 Cr 2 III O 3 · n H 2 O (қ) Cr ( OH ) 2 (қ) + 2 H 3 O + + 2 H 2 O = [Cr II ( H 2 O ) 6 ] 2+ сары ( HClO 4 ) көгілдір Cr II ( OH ) 2 (т) + 2 HCl + 2H 2 O = = [Cr II ( H 2 O ) 4 Cl 2 ] (р)](https://fsd.multiurok.ru/html/2020/12/21/s_5fe047898586a/img17.jpg)
Хром химиясы. Cr(II)
- Cr ( OH ) 2 – негіздік гидроксид, тотықсыздандырғыш
- Cr II ( OH ) 2 (қ) + O 2 Cr 2 III O 3 · n H 2 O (қ)
- Cr ( OH ) 2 (қ) + 2 H 3 O + + 2 H 2 O = [Cr II ( H 2 O ) 6 ] 2+
сары ( HClO 4 ) көгілдір
- Cr II ( OH ) 2 (т) + 2 HCl + 2H 2 O =
= [Cr II ( H 2 O ) 4 Cl 2 ] (р)
![Хром (II) аквакатионы Күшті тотықсыз-ғыш: (Cr 3+ /Cr 2+ ) = –0,41 В 4[Cr II (H 2 O) 6 ] 2+ + O 2 + 4H 3 O + = = 4[Cr III (H 2 O) 6 ] 3+ + 6H 2 O 2[ Cr II ( H 2 O ) 4 Cl 2 ] + [ Sn II Cl 3 ] – = = 2[ Cr III ( H 2 O ) 4 Cl 2 ] + + Sn 0 + 3 Cl – +II т.д тұрақтануы : 2[Cr II ( H 2 O ) 4 Cl 2 ] + 4CH 3 COO – = = [Cr 2 II ( H 2 O ) 2 (CH 3 COO) 4 ] + 4Cl – + 6H 2 O қызыл түсті тұрақты](https://fsd.multiurok.ru/html/2020/12/21/s_5fe047898586a/img18.jpg)
Хром (II) аквакатионы
- Күшті тотықсыз-ғыш: (Cr 3+ /Cr 2+ ) = –0,41 В
- 4[Cr II (H 2 O) 6 ] 2+ + O 2 + 4H 3 O + =
= 4[Cr III (H 2 O) 6 ] 3+ + 6H 2 O
- 2[ Cr II ( H 2 O ) 4 Cl 2 ] + [ Sn II Cl 3 ] – =
= 2[ Cr III ( H 2 O ) 4 Cl 2 ] + + Sn 0 + 3 Cl –
- +II т.д тұрақтануы :
- 2[Cr II ( H 2 O ) 4 Cl 2 ] + 4CH 3 COO – =
= [Cr 2 II ( H 2 O ) 2 (CH 3 COO) 4 ] + 4Cl – + 6H 2 O
қызыл түсті тұрақты
![Хром (II) тұрақты кластерлік комплексі CH 3 Cr Cr C O O CH 3 , -байланыс диамагнитті комплекс тетраацетатодиаквадихром C O H 2 O O Cr Cr OH 2 O O C O O H 3 C C [(H 2 O)Cr(CH 3 COO) 4 Cr(H 2 O)] CH 3](https://fsd.multiurok.ru/html/2020/12/21/s_5fe047898586a/img19.jpg)
Хром (II) тұрақты кластерлік комплексі
CH 3
Cr
Cr
C
O
O
CH 3
- , -байланыс
- диамагнитті комплекс тетраацетатодиаквадихром
C
O
H 2 O
O
Cr
Cr
OH 2
O
O
C
O
O
H 3 C
C
[(H 2 O)Cr(CH 3 COO) 4 Cr(H 2 O)]
CH 3
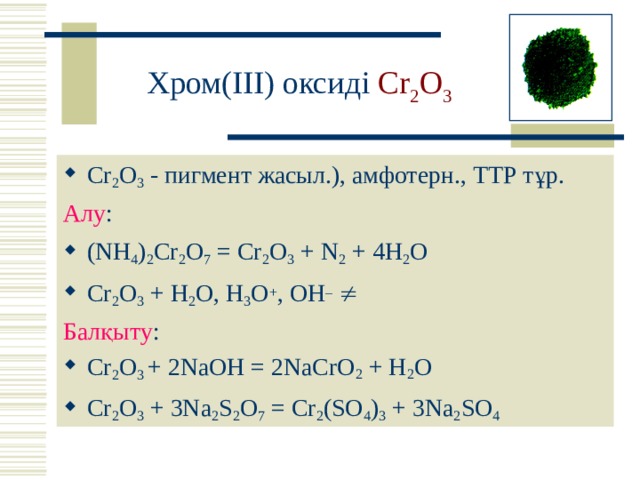
Хром(III) оксиді Cr 2 O 3
- Cr 2 O 3 - пигмент жасыл.), амфотерн., ТТР тұр.
Алу :
- (NH 4 ) 2 Cr 2 O 7 = Cr 2 O 3 + N 2 + 4H 2 O
- Cr 2 O 3 + H 2 O , H 3 O + , OH –
Балқыту :
- Cr 2 O 3 + 2NaOH = 2NaCrO 2 + H 2 O
- Cr 2 O 3 + 3Na 2 S 2 O 7 = Cr 2 (SO 4 ) 3 + 3Na 2 SO 4
 11) d 2 sp 3 – октаэдр., парамагн. [ Cr (H 2 O) 6 ] 3+ + H 2 O [ Cr (H 2 O) 5 OH] 2+ + H 3 O + ; K K = 1,12 · 10 –4 2[ Cr (H 2 O) 5 OH] 2+ [(H 2 O) 5 Cr (OH) 2 Cr (H 2 O) 5 ] 4+ " width="640"
11) d 2 sp 3 – октаэдр., парамагн. [ Cr (H 2 O) 6 ] 3+ + H 2 O [ Cr (H 2 O) 5 OH] 2+ + H 3 O + ; K K = 1,12 · 10 –4 2[ Cr (H 2 O) 5 OH] 2+ [(H 2 O) 5 Cr (OH) 2 Cr (H 2 O) 5 ] 4+ " width="640"
[ Cr (H 2 O) 6 ] 3+ + 3 NH 3 · H 2 O Cr 2 O 3 · n H 2 O (т) + … сұр-жасыл гель
Cr(OH) 3 , CrO(OH) – жасыл. крист.
H 3 O +
OH –
[Cr(H 2 O) 6 ] 3+ күлгін. ( рН
[Cr( OH ) 6 ] 3– жасыл.(рН 11)
d 2 sp 3 – октаэдр., парамагн.
- [ Cr (H 2 O) 6 ] 3+ + H 2 O [ Cr (H 2 O) 5 OH] 2+ + H 3 O + ;
K K = 1,12 · 10 –4
- 2[ Cr (H 2 O) 5 OH] 2+ [(H 2 O) 5 Cr (OH) 2 Cr (H 2 O) 5 ] 4+
 6 K K = 3,2·10 –7 2HCrO 4 – Cr 2 O 7 2 + H 2 O; pH 2 6; K Т 1,6·10 2 Cr 2 O 7 2 + 2 OH 2CrO 4 2 + H 2 O ; K Т III 10 14 pH 7 " width="640"
6 K K = 3,2·10 –7 2HCrO 4 – Cr 2 O 7 2 + H 2 O; pH 2 6; K Т 1,6·10 2 Cr 2 O 7 2 + 2 OH 2CrO 4 2 + H 2 O ; K Т III 10 14 pH 7 " width="640"
Cr ( VI )
- H 2 CrO 4 + H 2 O = HCrO 4 + H 3 O +
( H 2 CrO 4 – күшті қ-л)
- HCrO 4 – + H 2 O CrO 4 2 + H 3 O + ; pH 6
K K = 3,2·10 –7
- 2HCrO 4 – Cr 2 O 7 2 + H 2 O; pH 2 6; K Т 1,6·10 2
- Cr 2 O 7 2 + 2 OH 2CrO 4 2 + H 2 O ; K Т III 10 14
pH 7
 7 : CrO 4 2 + 4H 2 O + 3 e = [Cr(OH) 6 ] 3 + 2 OH ; = – 0,16 В Тотықтырғыш қасиеті қышқ. ортада күшті K 2 CrO 4 K 2 Cr 2 O 7 " width="640"
7 : CrO 4 2 + 4H 2 O + 3 e = [Cr(OH) 6 ] 3 + 2 OH ; = – 0,16 В Тотықтырғыш қасиеті қышқ. ортада күшті K 2 CrO 4 K 2 Cr 2 O 7 " width="640"
Тотықтырғыш тотықсыздандырғыш қасиеті
рН
- Cr 2 O 7 2 + 14H 3 O + + 6 e = 2[Cr(H 2 O) 6 ] 3+ + 9H 2 O;
= +1,33 В
рН 7 :
- CrO 4 2 + 4H 2 O + 3 e = [Cr(OH) 6 ] 3 + 2 OH ;
= – 0,16 В
Тотықтырғыш қасиеті қышқ. ортада күшті
K 2 CrO 4
K 2 Cr 2 O 7
![Cr(VI) Cr(III) Cr(II) K 2 Cr 2 O 7 ( т ) + 14 HCl( конц. ) + H 2 O = = 2[Cr III (H 2 O) 4 Cl 2 ]Cl (р) + 3 Cl 2 + 2 KCl жасыл Zn + 2 HCl = ZnCl 2 + H 2 2[Cr III (H 2 O) 4 Cl 2 ]Cl (р) + Zn = = 2[Cr II (H 2 O) 4 Cl 2 ] (р) + ZnCl 2 көгілдір](https://fsd.multiurok.ru/html/2020/12/21/s_5fe047898586a/img24.jpg)
Cr(VI) Cr(III) Cr(II)
- K 2 Cr 2 O 7 ( т ) + 14 HCl( конц. ) + H 2 O =
= 2[Cr III (H 2 O) 4 Cl 2 ]Cl (р) + 3 Cl 2 + 2 KCl
жасыл
- Zn + 2 HCl = ZnCl 2 + H 2
- 2[Cr III (H 2 O) 4 Cl 2 ]Cl (р) + Zn =
= 2[Cr II (H 2 O) 4 Cl 2 ] (р) + ZnCl 2
көгілдір

Аммоний дихроматы айырылуы
- (NH 4 ) 2 Cr 2 O 7 = Cr 2 O 3 + N 2 + 4H 2 O
«Дихроматты вулкан» ( видеофрагмент )
![Cr ( VI ) Хром( VI) оксиді CrO 3 ( т ) + 2 HCl (г) = CrCl 2 O 2 ( ж ) + H 2 O( г ); + t ° Хром диоксид-дихлориді (бинарлы қосылыс) Алу : K 2 Cr 2 O 7 + NaCl + H 2 SO 4 ( конц. ) CrCl 2 O 2 + … Гидролиз : CrCl 2 O 2 + 2 H 2 O = H 2 CrO 4 + 2 HCl аз. H 2 O : H 2 CrO 4 артық. H 2 O , рН 2 6: 2HCrO 4 – , Cr 2 O 7 2– [CrO 3 (OH)] – + Cl – + H 3 O + [CrO 3 Cl] – + 2 H 2 O](https://fsd.multiurok.ru/html/2020/12/21/s_5fe047898586a/img26.jpg)
Cr ( VI )
Хром( VI) оксиді
- CrO 3 ( т ) + 2 HCl (г) = CrCl 2 O 2 ( ж ) + H 2 O( г ); + t °
Хром диоксид-дихлориді (бинарлы қосылыс)
Алу :
- K 2 Cr 2 O 7 + NaCl + H 2 SO 4 ( конц. ) CrCl 2 O 2 + …
- Гидролиз : CrCl 2 O 2 + 2 H 2 O = H 2 CrO 4 + 2 HCl
аз. H 2 O : H 2 CrO 4
артық. H 2 O , рН 2 6: 2HCrO 4 – , Cr 2 O 7 2–
- [CrO 3 (OH)] – + Cl – + H 3 O + [CrO 3 Cl] – + 2 H 2 O








![Электрондық құрылысы Cr : […] 4 s 1 3 d 5 4 p 0 Mo: […] 5 s 1 4 d 5 5 p 0 W: […] 6 s 2 4 f 14 5 d 4 6 p 0 Cr, Mo: np 0 ( n – 1) d 5 ns 1 Валенттілік (КС): Cr 6; Mo 6, 8; W 6, 8, 9; Тотығу дәрежесі : 0, +II, +III , +IV, +VI ( Cr ); 0, +IV, + VI ( Mo, W )](https://fsd.multiurok.ru/html/2020/12/21/s_5fe047898586a/img2.jpg)

![Жай заттар Cr , В – 0, 70 ( Cr 3+ /С r ) үшін – 0,85 для ( Cr 2+ /С r ) Mo W 0,00 ( MoO 3 /Mo) үшін – 0,09 ( WO 3 / W ) үшін Cr + 2H 3 O + + 4H 2 O = [Cr(H 2 O) 6 ] 2+ + H 2 Mo(W) + H 3 O + ](https://fsd.multiurok.ru/html/2020/12/21/s_5fe047898586a/img4.jpg)
![Жай заттар Тотықтырғыш қышқылдар (суықта пассивтену): Э VI Б + HNO 3 ( конц ), H 2 SO 4 ( конц ) Э ( Mo,W ) + 2HNO 3 + 8HF = = Н 2 [ Э VI F 8 ] + 2NO + 4H 2 O Э + 8 HF – 6 e – = [ Э F 8 ] 2– + 2 H + NO 3 – + 4H + + 3 e – = NO + 2 H 2 O Э ( Cr,Mo,W ) + 3NaNO 3 + 2NaOH = = Na 2 Э VI O 4 + 3NaNO 2 + H 2 O Cr + NaOH ( р) ](https://fsd.multiurok.ru/html/2020/12/21/s_5fe047898586a/img5.jpg)



![Комплексті қосылыстар CO Тотығу дәр.0: [ Э 0 (CO) 6 ] [ Cr 0 (CO) 6 ] – гексакарбонилхром : диамагнитті OC CO Cr d 2 sp 3 , октаэдр CO OC CO [ Cr + (CO – /6 ) 6 ] | | = 0,4 e – 1 Cr Cr : : CO 6 CO ](https://fsd.multiurok.ru/html/2020/12/21/s_5fe047898586a/img9.jpg)
![Комплексті қосылыстар Cr III CrCl 3 · 6H 2 O [Cr(H 2 O) 4 Cl 2 ]Cl · 2H 2 O жасыл [Cr(H 2 O) 6 ]Cl 3 күлгін [Cr(H 2 O) 4 Cl 2 ] + + 2 H 2 O [Cr(H 2 O) 6 ] 3+ + 2 Cl – + H 2 O, – t ° ( суыту ) – H 2 O, + H 3 O + , + t ° ( қыздыру )](https://fsd.multiurok.ru/html/2020/12/21/s_5fe047898586a/img10.jpg)


![Пероксокомплекстер Cr 2 O 7 2 + 4H 2 O 2 + 2H 3 O + + L = = 2[ Cr VI (L)O(O 2 2 ) 2 ] + 7H 2 O көгілдір түсті (орг.еріткішпен экстракция ) O КС 6; пентагоналды пирамида L – эфир, пиридин … Cr L O O O O](https://fsd.multiurok.ru/html/2020/12/21/s_5fe047898586a/img13.jpg)



![Хром химиясы. Cr(II) Cr ( OH ) 2 – негіздік гидроксид, тотықсыздандырғыш Cr II ( OH ) 2 (қ) + O 2 Cr 2 III O 3 · n H 2 O (қ) Cr ( OH ) 2 (қ) + 2 H 3 O + + 2 H 2 O = [Cr II ( H 2 O ) 6 ] 2+ сары ( HClO 4 ) көгілдір Cr II ( OH ) 2 (т) + 2 HCl + 2H 2 O = = [Cr II ( H 2 O ) 4 Cl 2 ] (р)](https://fsd.multiurok.ru/html/2020/12/21/s_5fe047898586a/img17.jpg)
![Хром (II) аквакатионы Күшті тотықсыз-ғыш: (Cr 3+ /Cr 2+ ) = –0,41 В 4[Cr II (H 2 O) 6 ] 2+ + O 2 + 4H 3 O + = = 4[Cr III (H 2 O) 6 ] 3+ + 6H 2 O 2[ Cr II ( H 2 O ) 4 Cl 2 ] + [ Sn II Cl 3 ] – = = 2[ Cr III ( H 2 O ) 4 Cl 2 ] + + Sn 0 + 3 Cl – +II т.д тұрақтануы : 2[Cr II ( H 2 O ) 4 Cl 2 ] + 4CH 3 COO – = = [Cr 2 II ( H 2 O ) 2 (CH 3 COO) 4 ] + 4Cl – + 6H 2 O қызыл түсті тұрақты](https://fsd.multiurok.ru/html/2020/12/21/s_5fe047898586a/img18.jpg)
![Хром (II) тұрақты кластерлік комплексі CH 3 Cr Cr C O O CH 3 , -байланыс диамагнитті комплекс тетраацетатодиаквадихром C O H 2 O O Cr Cr OH 2 O O C O O H 3 C C [(H 2 O)Cr(CH 3 COO) 4 Cr(H 2 O)] CH 3](https://fsd.multiurok.ru/html/2020/12/21/s_5fe047898586a/img19.jpg)

 11) d 2 sp 3 – октаэдр., парамагн. [ Cr (H 2 O) 6 ] 3+ + H 2 O [ Cr (H 2 O) 5 OH] 2+ + H 3 O + ; K K = 1,12 · 10 –4 2[ Cr (H 2 O) 5 OH] 2+ [(H 2 O) 5 Cr (OH) 2 Cr (H 2 O) 5 ] 4+ " width="640"
11) d 2 sp 3 – октаэдр., парамагн. [ Cr (H 2 O) 6 ] 3+ + H 2 O [ Cr (H 2 O) 5 OH] 2+ + H 3 O + ; K K = 1,12 · 10 –4 2[ Cr (H 2 O) 5 OH] 2+ [(H 2 O) 5 Cr (OH) 2 Cr (H 2 O) 5 ] 4+ " width="640"
 6 K K = 3,2·10 –7 2HCrO 4 – Cr 2 O 7 2 + H 2 O; pH 2 6; K Т 1,6·10 2 Cr 2 O 7 2 + 2 OH 2CrO 4 2 + H 2 O ; K Т III 10 14 pH 7 " width="640"
6 K K = 3,2·10 –7 2HCrO 4 – Cr 2 O 7 2 + H 2 O; pH 2 6; K Т 1,6·10 2 Cr 2 O 7 2 + 2 OH 2CrO 4 2 + H 2 O ; K Т III 10 14 pH 7 " width="640"
 7 : CrO 4 2 + 4H 2 O + 3 e = [Cr(OH) 6 ] 3 + 2 OH ; = – 0,16 В Тотықтырғыш қасиеті қышқ. ортада күшті K 2 CrO 4 K 2 Cr 2 O 7 " width="640"
7 : CrO 4 2 + 4H 2 O + 3 e = [Cr(OH) 6 ] 3 + 2 OH ; = – 0,16 В Тотықтырғыш қасиеті қышқ. ортада күшті K 2 CrO 4 K 2 Cr 2 O 7 " width="640"
![Cr(VI) Cr(III) Cr(II) K 2 Cr 2 O 7 ( т ) + 14 HCl( конц. ) + H 2 O = = 2[Cr III (H 2 O) 4 Cl 2 ]Cl (р) + 3 Cl 2 + 2 KCl жасыл Zn + 2 HCl = ZnCl 2 + H 2 2[Cr III (H 2 O) 4 Cl 2 ]Cl (р) + Zn = = 2[Cr II (H 2 O) 4 Cl 2 ] (р) + ZnCl 2 көгілдір](https://fsd.multiurok.ru/html/2020/12/21/s_5fe047898586a/img24.jpg)

![Cr ( VI ) Хром( VI) оксиді CrO 3 ( т ) + 2 HCl (г) = CrCl 2 O 2 ( ж ) + H 2 O( г ); + t ° Хром диоксид-дихлориді (бинарлы қосылыс) Алу : K 2 Cr 2 O 7 + NaCl + H 2 SO 4 ( конц. ) CrCl 2 O 2 + … Гидролиз : CrCl 2 O 2 + 2 H 2 O = H 2 CrO 4 + 2 HCl аз. H 2 O : H 2 CrO 4 артық. H 2 O , рН 2 6: 2HCrO 4 – , Cr 2 O 7 2– [CrO 3 (OH)] – + Cl – + H 3 O + [CrO 3 Cl] – + 2 H 2 O](https://fsd.multiurok.ru/html/2020/12/21/s_5fe047898586a/img26.jpg)

















