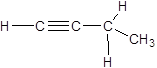Лекция
Алкины (ацетиленовые углеводороды) – углеводороды, молекулы которых содержат тройную связь углерод-углерод. Общая формула алкинов – CnH2n-2.
Номенклатура алкинов
Тройную связь обозначают суффиксом -ин.
|  | 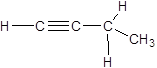 |
| ацетилен (этин) | бутин-1 |
Главная цепь должна включать в себя тройные связи, а нумерация проводится так, чтобы они получили наименьшие номера.

3,6-диметилгептадиин-1,4

Рис. 1. Шаростержневая модель ацетилена
Строение алкинов
Атомы углерода тройной связи находятся в состоянии sp-гибридизации. Сигма-связи, образуемые sp-гибридными атомами углерода, расположены под углом 180о друг к другу.
Тройная связь короче и прочнее двойной связи. Она образована тремя парами электронов и включает одну σ- и две π-связи. Две π-связи лежат во взаимно перпендикулярных плоскостях. Рис. 2.

Рис. 2. Образование тройной связи в молекуле ацетилена
3. Изомерия алкинов
1. Изомерия скелета
2. Изомерия положения тройной связи
| 
|  |
| бутин-1 | бутин-2 |
3. Межклассовая изомерия. Алкинам изомерны, например, алкадиены и циклоалкены.
|  |  | 
|
| бутин-1 | бутадиен-1,3 | циклобутен |
Алкины не обладают геометрической изомерией.
4. Физические свойства и получение алкинов
Ацетилен, пропин и бутин-1 при комнатной температуре – бесцветные газы, остальные алкины – жидкости или твердые вещества.
Ацетилен немного растворим в воде, хорошо растворяется в ацетоне. Это используют для его хранения и транспортировки. Ацетилен нельзя хранить в баллонах в сжатом состоянии, т.к. под давлением он разлагается со взрывом. В баллон помещают пористый материал, пропитанный ацетоном, а в нем растворяют ацетилен.
Получение алкинов
1. В промышленности ацетилен получают термическим разложением (пиролизом) метана: 2СН4 С2Н2 + 3Н2.
С2Н2 + 3Н2.
2. Для получения ацетилена в лаборатории и в технических целях используют взаимодействие карбида кальция с водой:
СаC2 + 2Н2О → Сa(OH)2 + C2H2.
Этот опыт можно посмотреть здесь: https://youtu.be/gOoY6m7RwDs
3. Другие алкины в лаборатории получают взаимодействием дигалогеналканов, содержащих атомы галогенов у одного или у соседних атомов углерода, со спиртовым раствором щелочи при нагревании:

Арены (ароматические углеводороды) – органические соединения, имеющие общую формулу СnH2n –6, а в составе молекулы бензольное кольцо (ядро).
Бензольное кольцо – это цикличная группа шести атомов углерода; структуру в виде кольца предложил Ф. А. Кекуле в 1865 г.
Простейшим представителем аренов является бензол С6Н6. Среди других представителей можно отметить, например, кумол (изопропилбензол) C6H5CH(CH3)2.
Формулы бензола
| Полная структурная (формула, предложенная Ф.А. Кекуле) | 
|
| Сокращенная структурная (формула, предложенная Ф.А. Кекуле) | 
|
| Сокращенная структурная с сопряженными связями | 
|
Бензол – первый представитель класса аренов (ароматических углеводородов). Каждый атом углерода в молекуле бензола С6Н6 имеет 4 валентных электрона: s1p3. Тип гибридизации атомов углерода в бензольном кольце молекулы аренов, как и у алкенов, – sp2.
sp2 гибридизация – это смешивание одного s и двух p электронных облаков и образование трёх одинаковых (гибридных). Гибридные облака участвуют в образовании 3 δ-связей, лежащих на плоскости. Оставшееся у каждого из шести атомов углерода негибридизованное третье p-облако имеет форму гантели. Шесть p-облаков, перекрываясь с соседними над и под плоскостью δ-связей, участвует в образовании общего 6-электронного облака, которое является общим для всех атомов углерода.
О строении бензола можно посмотреть здесь https://youtu.be/GuAB5bMCYNY
Свойства бензола и других ароматических соединений и их обусловленность электронным строением молекулы бензола.
Физические и химические свойства бензола и его гомологов
Физические свойства бензола
Бензол – бесцветная жидкость с характерным запахом, которая кипит при 80,1 °С, ρ = 0,876 г/cм3. Бензол очень огнеопасен!
Бензол является хорошим растворителем. В пробирку нальем 1 мл дистиллированной воды и добавим несколько капель масла. Масло не растворяется в воде даже после перемешивания содержимого. Во вторую пробирку нальем 1 мл бензола. Перемешаем содержимое. Масло растворяется в бензоле. Однако ввиду высокой токсичности, использование бензола в качестве растворителя нежелательно.
Сопряжение π-связей в молекуле бензола
Образование пи-связей в молекуле бензола обусловлено тем, что негрибридизованные облака образуют общие электронные плотности в виде колец над и под плоскостью молекулы бензола. Обратите внимание, что в результате образуется общее пи-электронное облако, а все связи между атомами углерода в молекуле бензола оказываются одинаковыми (их еще называют полуторными). Именно пи-электронные облака являются объяснением того факта, что – в отличие от первоначального варианта представления молекулярной формулы бензола с чередованием одинарных и двойных связей – бензол не проявляет выраженных свойств алкенов.
Химические свойства бензола.
Химические свойства можно посмотреть здесь: https://youtu.be/EUomMnnMdZE
| Реакции замещения (как алканы) | Галогенирование | Реакция происходит в присутствии катализатора (соли FeBr3, AlCl3, AlBr3): 
|
| Нитрование | 
|
| Алкилирование | 
|
| Реакции присоединения (как алкены) | Каталитическое гидрирование | 
|
| Радикальное хлорирование | 
|
| Окисление | Горение | 2С6Н6 + 15О2→ 12СО2 + 6Н2О |
| Взаимодействие с перманганатом калия | Не обесцвечивает раствор перманганата калия (реакция не идёт) |
Горение бензола
Бензол горит жёлтым коптящим пламенем, если внести в пламя стекло, на нем быстро оседает слой копоти.
Электрофилы – это положительно заряженные частицы, имеющие свободную орбиталь на внешнем электронном уровне и способные образовывать новые ковалентные связи за счёт пары электронов другой молекулы. К электрофилам относятся молекулы галогенов, SO3 и молекулы с сильнополяризованной связью (HCOO-Br+).
Электрофильное замещение в ароматических соединениях можно представить реакцией присоединения-отщепления. Эта реакция проходит в несколько стадий.

При инициации реакции молекула хлора распадается на два иона. Катализатор, например, AlCl3, присоединяя ион хлора Cl−, приобретает отрицательный заряд. Оставшийся ион хлора Cl+, который является электрофилом, присоединяется к образовавшемуся на катализаторе отрицательному иону AlCl4−.Образованное соединение называется π-комплексом. Этот комплекс вступает в реакцию с молекулой бензола, обеспечивая присоединение ионов хлора Cl+ к атомам углерода.
Сравнение свойств бензола и толуола
Бензол
| Отношение к раствору KMnO4 | Не окисляется |
| Горение на воздухе | 2С6Н6 + 15О2 → 12СО2 + 6Н2О |
| Реакция гидрирования | 
|
| Присоединение хлора (галогена) | 
|
| Замещение водорода хлором (галогеном) | 
|
| Нитрование | 
|
Толуол
| Отношение к раствору KMnO4 | Окисление боковых цепей (в присутствии H2SO4 или KMnO4) |
| Горение на воздухе | C6H5–CH3 + 9O2 → 7CO2 + 4H2O |
| Реакция гидрирования | |
| Присоединение хлора (галогена) | |
| Замещение водорода хлором (галогеном) | |
| Нитрование | |
Перепишите в тетрадь!!!!!
Решение задачи о свойствах толуола
В результате взаимодействия 2,5 моль толуола с бромом образовалось 700 г трибромтолуола. Найдите практический выход реакции (%) от теоретически возможного. Ответ округлите до целого числа.
Ответ: 86 %.
Решение.
1. Запишем уравнение реакции.
| С6Н5СН3 + 3Br2 → | С6Н2СН3Br3 + | 3НBr |
| Толуол | Трибромтолуол |
|
2. Рассчитаем молярную массу трибромтолуола.
М (С6Н2СН3Br3) = 329 г/моль
3. Рассчитаем теоретический выход (г) трибромтолуола.
| 2,5 моль | х г |
|
| С6Н5СН3 + 3Br2 → | С6Н2СН3Br3 + | 3НBr |
| 1 моль | 1 моль · 329 г/моль |
|
2,5 моль / 1 моль = х г / 1 моль · М (С6Н2СН3Br3)
х = 2,5 · 329 / 1 = 815 (г).
4. Рассчитаем теоретический выход (%) трибромтолуола.
Составляем пропорцию:
815 г составляет 100 %
700 г – х %.
Отсюда:
х = 700 · 100 / 815 = 85,88 ≈ 86 (%).
Подведение итога урока
На этом уроке вы изучили тему «Алкины. Арены». В ходе урока вы узнали о том, что представляют собой алкины – ациклические углеводороды, содержащие в молекуле одну тройную связь. Познакомились с физическими свойствами алкинов, особенностями их строения. Познакомились с Аренами и их строением и физическими и химическимим свойствами.
Домашнее задание
Как образуется тройная связь в молекуле ацетилена?
Почему ацетилен горит коптящим пламенем?
Объясните, что такое бензольное кольцо, как оно образуется?
Какие химические свойства может проявлять бензол? Ответом может быть таблица химические свойства бензола.