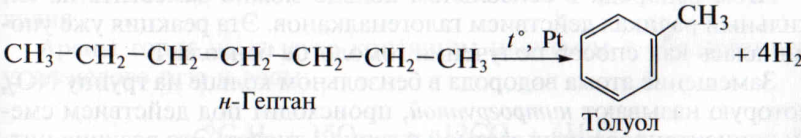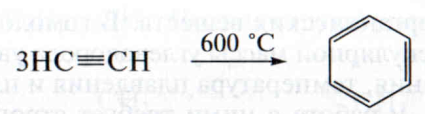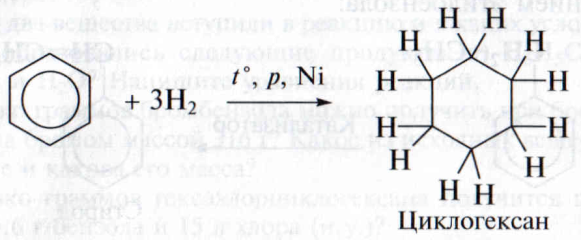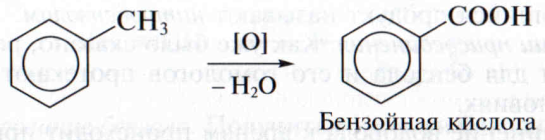Лекция № ___
Тема: Арены
План:
Понятия «Арены»
Строение молекулы бензола. Общая реакционная способность аренов
Гомологический ряд, номенклатура, изомерия аренов
Физические свойства аренов
Химические свойства
В 1825 г. М. Фарадей впервые выделил из светильного газа 3г вещества состава С6Н6, названного бензолом. В дальнейшем выяснилось, что многие известные соединения являются производными бензола и могут быть превращены в него. С тех пор бензол и его производные стали называть ароматическими соединениями. Происхождение названия объясняется тем, что среди производных бензола много приятно пахнущих веществ, например всем известный ванилин, используемый в кулинарии.
Состав молекулы бензола указывает на его значительный непредельный характер. Однако химические свойства бензола резко отличаются от свойств углеводородов с двойными и тройными связями. Каково же строение молекулы этого вещества?
Электронное и пространственное строение молекулы бензола. В 1865г. немецким химиком Ф. Кекуле была предложена первая структурная формула бензола, представлявшая собой цикл из шести углеродных атомов с чередующимися одинарными и двойными связями. Эту формулу широко используют химики и сейчас:
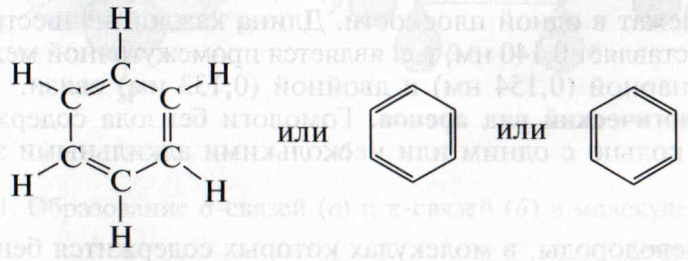
Она, верно, отражает равноценность всех атомов углерода и водорода в молекуле бензола, но не объясняет ряда его специфических свойств. Эти особенности удалось обосновать только после разработки современной теории химических связей.
Каковы же современные представления о строении молекулы бензола? Все шесть атомов углерода в бензоле находятся в состоянии sр2-гибридизации. За счет двух гибридных sр2-орбиталей каждый атом образует -связи с двумя соседними углеродными атомами, за счет третьей sр2-орбитали – -связь с атомом водорода.
У каждого углеродного атома цикла остается по одной негибридизованной р-орбитали. Оси этих орбиталей параллельны, и каждая из них перекрывается с двумя соседними, образуя единые электронные облака над и под плоскостью кольца.
каждого углеродного атома цикла остается по одной негибридизованной р-орбитали. Оси этих орбиталей параллельны, и каждая из них перекрывается с двумя соседними, образуя единые электронные облака над и под плоскостью кольца.
Таким образом, нельзя говорить о чередовании одинарных и двойных связей в цикле, π-электронные облака делокализованы по всему кольцу и обеспечивают равноценность всех связей С – С. Они являются полуторными или, как говорят, носят ароматический характер (рис. 5.1.)
С учетом равноценности углерод-углеродных связей в молекуле бензола его формулу принято изображать в виде правильного шестиугольника со вписанной окружностью, символизирующей делокализацию электронной плотности:
Атомы водорода можно не изображать, подразумевая их наличие и четырехвалентное состояние углерода.
Электронное строение молекулы бензола обусловливает его пространственное строение (рис. 5.2). Центры ядер всех двенадцати атомов лежат в одной плоскости. Длина каждой из шести связей С – С составляет 0,140нм, т.е. является промежуточной между длиной одинарной (0,154нм) и двойной (0,134нм) связи.


Рис. 5.2. Модель молекулы бензола
Рис. 5.1. Образование -связей (а) и
π-связей (6) в молекуле бензола
Гомологический ряд аренов. Гомологи бензола содержат бензольное кольцо с одним или несколькими алкильными заместителями.
Углеводороды, в молекулах которых содержится бензольное кольцо, называют ароматическими углеводородами, или аренами.
Следующим за бензолом ароматическим углеводородом гомологического ряда аренов является метилбензол, тривиальное название которого толуол. Его молекулярная формула С7Н8. Молекулу толуола можно представить как радикал бензола состава C6H5 (его называют фенилом), связанный с метильной группой СН3. Эту особенность строения отражает сокращенная структурная формула толуола C6H5 – СН3. Полная структурная формула толуола имеет вид:

Структурная изомерия аренов. Она связана со строением углеводородных заместителей и их взаимным расположением в бензольном кольце. Изомерия возможна с третьего члена гомологического ряда. Углеводороду состава С8Н10 отвечают четыре соединения:

Номенклатура аренов. В основе названия аренов – бензол; все гомологи рассматривают как его производные.
Взаимное положение двух заместителей удобно обозначать специальными терминами. Так, 1,2-изомер называют орто-изомером (0-); 1,3-изомер – мета-изомером (м-); 1,4-изомер – пара-изомером (п-). В соответствии с этим изомерные формы диметилбензола называют: орто-ксилол, мета-ксилол и пара-ксилол.
Физические свойства аренов. Первые члены гомологического ряда бензола – бесцветные летучие жидкости с характерным запахом; в воде не растворяются, однако сами являются хорошими растворителями органических веществ. В гомологическом ряду с увеличением молекулярной массы углеводорода увеличиваются его температура кипения, температура плавления и плотность. Арены весьма токсичны, и работа с ними требует строгого соблюдения мер безопасности.
Получение и химические свойства аренов
Получение аренов. Значительное количество ароматических углеводородов выделяют из природных источников: нефти и продуктов переработки каменного угля. Кроме того, разработано несколько синтетических способов.
1. Дегидрирование алканов. Это основной промышленный способ получения аренов. Предельные углеводороды (гексан, гептан и др.) при пропускании над нагретым до 3000С платиновым катализатором отщепляют водород, происходит замыкание шестичленного цикла:
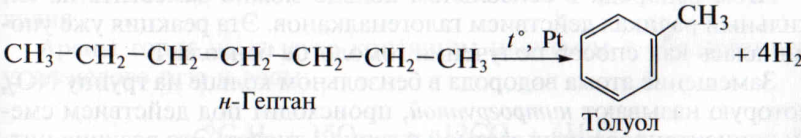
В качестве катализатора можно использовать более дешевый оксид xpoма (III). Таким способом получают первые представители гомологического ряда аренов: бензол, толуол, ксилолы.
2. Тримеризация ацетилена. При пропускании ацетилена над раскаленным углем образуется бензол (реакция Зелинского):
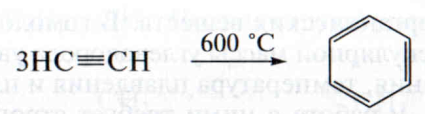
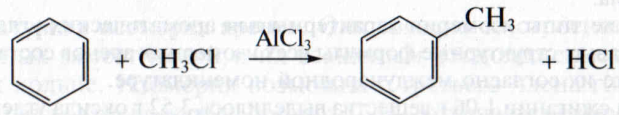
3. Алкилирование бензола. Получить гомологи бензола можно из самого бензола действием галогеналканов в присутствии галогенида алюминия. Например, при взаимодействии бензола с хлорметаном атом водорода замещается на метильную группу, образуется толуол:
Химические свойства аренов. Бензол и его гомологи существенно отличаются по химическим свойствам как от предельных, так и от непредельных углеводородов. Характерной чертой непредельных углеводородов является их склонность к реакциям присоединения и окисления. Арены же с трудом окисляются и восстанавливаются. Будучи формально ненасыщенными соединениями они не склонны к присоединению; характерными для них являются реакции замещения.
1. Реакции замещения. Важнейшими реакциями замещения аренов являются галогенирование, алкилирование, нитрование.
Бензол и его гомологи взаимодействуют с хлором и бромом с образованием моногалогензамещенных производных (реакция галогенирования):
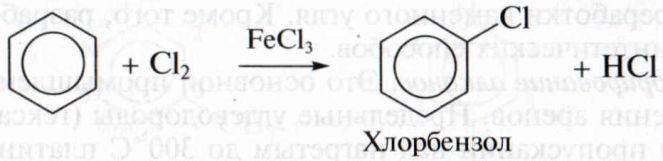
Реакция протекает в присутствии катализаторов – безводных галогенидов алюминия, железа(III) или цинка.
Атом водорода в бензольном кольце можно заместить на алкильный радикал действием галогеналканов. Эта реакция уже упоминалась как способ получения гомологов бензола.
Замещение атома водорода в бензольном кольце на группу NО2, которую называют нитрогруппой, происходит под действием смеси концентрированных азотной и серной кислот. Это реакция нитрования бензола:
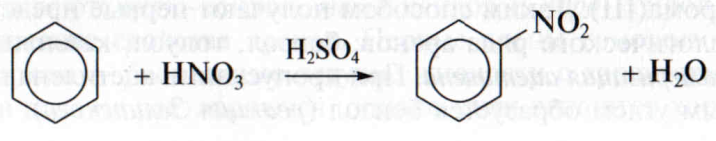
Образующийся продукт называют нитробензолом.
2. Реакции присоединения. Как уже было сказано, реакции присоединения для бензола и его гомологов протекают с трудом в жестких условиях.
Присоединение водорода к аренам происходит при повышенных значениях температуры, давления в присутствии катализаторов гидрирования (Ni, Pt, Pd):
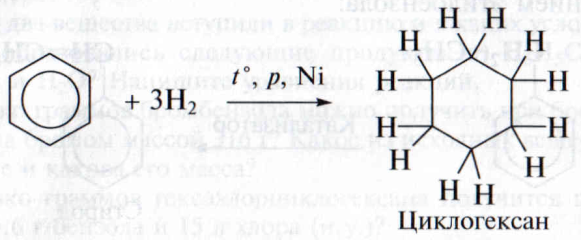
В результате образуется циклический углеводород, не содержащий характерной для бензола шестиэлектронной системы –с циклогексан С6Н12.
Присоединение хлора к бензолу протекает при облучении реагентов ультрафиолетовым светом. Образуется продукт состава C6H6Cl6 – гексахлорциклогексан (гексахлоран); его раньше применяли в сельском хозяйстве для борьбы с саранчой и клещами:
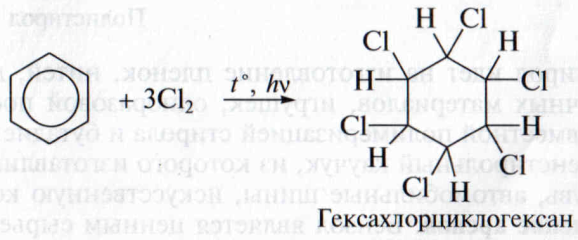
3. Реакции окисления. Бензольное кольцо устойчиво к действию окислителей. Бензол при обычных условиях не окисляется кислородом воздуха, не обесцвечивает водный раствор перманганата калия.
Арены горят на воздухе коптящим пламенем с образованием углекислого газа и воды:

Толуол в отличие от бензола при нагревании окисляется водным раствором перманганата калия. Ароматическое кольцо при этом не затрагивается, окислению подвергается метильный заместитель. В качестве продукта реакции образуется бензойная кислота:
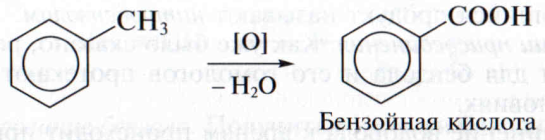
4. Реакции дегидрирования. Одно из важнейших производных бензола – винилбензол, или стирол – получают каталитическим дегидрированием этилбензола:

Стирол является исходным веществом (мономером) для получения важного полимера – полистирола:
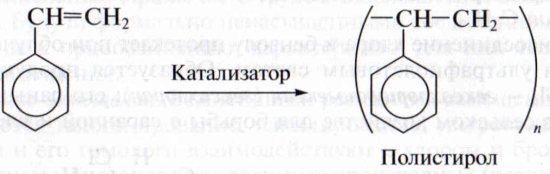
Полистирол идет на изготовление пленок, нитей, декоративно-отделочных материалов, игрушек, одноразовой посуды, упаковки. Совместной полимеризацией стирола и бутадиена получают бутадиенстирольный каучук, из которого изготавливают резиновую обувь, автомобильные шины, искусственную кожу.
Применение аренов. Бензол является ценным сырьем химической промышленности. Из него получают фенол, анилин, ядохимикаты, лекарственные вещества. Сам бензол часто используют в качестве растворителя. Толуол идет на получение взрывчатых веществ и бензойной кислоты; из этилбензола получают стирол, а из него, в свою очередь – полистирол.
Контрольные вопросы:
Какие углеводороды называют ароматическими? Какова их общая формула?
Расскажите об электронном и пространственном строении молекулы бензола.
Какие типы изомерии характерны для ароматических углеводородов? Составьте структурные формулы всех изомерных аренов состава С9Н12 и назовите их согласно международной номенклатуре.
При сжигании 1,06г вещества выделилось 3,52г оксида углерода(IV) и 0,90г воды. Масса 1л паров этого вещества при нормальных условиях 4,73г. Определите молекулярную формулу вещества и напишите структурные формулы всех изомеров.
Углеводород, плотность паров которого по водороду равна 39, содержит 92,31% углерода. Определите его молекулярную формулу.
Какие из перечисленных свойств присущи бензолу: а) бесцветная жидкость; б) кристаллы синего цвета; в) без запаха; г) растворим в воде; д) является хорошим растворителем?
Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:

Укажите вещества Х и Y и условия проведения синтеза.
При сжигании 2,12г вещества выделилось 7,04г оксида углерода(IV) и 1,80г воды. Масса 1л паров этого вещества при нормальных условиях 4,73г. Определите молекулярную формулу вещества и напишите структурные формулы возможных изомеров.
Сколько миллилитров бензола (плотность 0,9г/мл) потребуется для получения 30,75г нитробензола, если массовая доля выхода продукта составляет 90%?
Какие два вещества вступили в реакцию, и в каких условиях, если в результате образовались следующие продукты: а) С6Н5С2Н5 и НВг; б) C6H5NО2 и Н2О? Напишите уравнения реакций.
Сколько граммов бромбензола можно получить при бромировании 117г бензола бромом массой 316г? Какое из исходных веществ останется в избытке и какова его масса?
Сколько граммов гексахлорциклогексана получится при взаимодействии 15,6г бензола и 15л хлора (н.у.)?
Какой объем воздуха при нормальных условиях потребуется для сжигания 5,3г о-ксилола, если объемную долю кислорода в воздухе считать равной 21%?
Используемая литература:
Габриелян О,С. Химия: учеб для студ. Сред. Проф. Учеб. Заведений/ О.С. Габриелян, И.Г. Остроумов. – 6-е изд., стер. – М.: Издательский центр «Академия, 2009. – 336с.
Габриелян О,С. Химия для профессий и специальностей технического профиля: учебник/ О.С. Габриелян, И.Г. Остроумов. – М.: Издательский центр «Академия, 2009. – 256с







 каждого углеродного атома цикла остается по одной негибридизованной р-орбитали. Оси этих орбиталей параллельны, и каждая из них перекрывается с двумя соседними, образуя единые электронные облака над и под плоскостью кольца.
каждого углеродного атома цикла остается по одной негибридизованной р-орбитали. Оси этих орбиталей параллельны, и каждая из них перекрывается с двумя соседними, образуя единые электронные облака над и под плоскостью кольца.