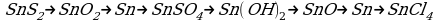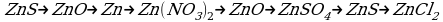Лабораторные работы № 33-34.
«Взаимодействие цинка или алюминия с растворами кислот и щелочей. Окрашивание пламени катионами щелочных и щелочноземельных металлов»
Цель работы: Изучить действие кислот и щелочей на амфотерные металлы. Наблюдать амфотерность гидроксида цинка. Ознакомиться с некоторыми нерастворимыми соединениями цинка и их свойствами. Наблюдать образование гидроксида алюминия и его амфотерность. Изучить взаимодействие алюминия с водой, солями и кислотами. Ознакомиться на практике с амфотерностью гидроксидов олова и свинца. Наблюдать различную окраску нерастворимых солей свинца. Изучить восстановительные свойства солей олова (II), окислительные свойства диоксида свинца (IV).
Оборудование и реактивы: Пробирки, газовая горелка, гранулы цинка, Al металлический, серная кислота разбавленная и концентрированная, азотная кислота разбавленная и концентрированная, соляная кислота разбавленная и концентрированная, фосфорная кислота раствор, уксусная кислота раствор, раствор нитрата меди, аммиак разбавленный раствор, гидроксид натрия (NaOH, 0,1 н раствор, 6н раствор), сульфид натрия свежеприготовленный раствор, карбонат натрия раствор, хлорид натрия раствор, хромат калия раствор, йодид калия раствор, перманганат калия раствор, дихромат калия раствор, гексациано-(III)феррат калия раствор, хлорид цинка 2 н раствор, хлорид алюминия раствор, нитрат меди, ацетат свинца раствор, диоксид свинца (IV) кристаллический, хлорид олова ( II) раствор, хлорид железа(III) раствор.
Теоретическое сведения
Алюминий. Входит в главную подгруппу III группы Периодической системы элементов. Серебристо-белого цвета, с высокой тепло- и электропроводностью, стойкий к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия. Алюминий – амфотерный металл. Оксид и гидроксид алюминия в реациях могут проявлять как основные, так и кислотные свойства. Реагируя с кислотами и кислотными оксидами, образуют соль, в которой алюминий является катионом Al3+.
2Al(OH)3 + 3SO3 = Al2(SO4)3 + 3H2O
Al2О3 + 3H2SO4 = Al2(SO4)3 + 3H2O
Реагирую с основными оксидами и гидроксидами проявляют свойства кислотных соединений, образуя соль, в которой атом алюминия AlIII входит в состав аниона (кислотного остатка) AlО2−.
2Al(OH)3 + Na2O = 2NaAlO2 + 3H2O (в расплаве)
Al2О3 + 2NaOH(т) = 2NaAlO2 + H2O (в расплаве)
Цинк. Элемент побочнной подгруппы II группы Периодической системы элементов. Цинк является мало активным, трудно окисляется и проявляет слабые металлические свойства. В образующихся соединениях степень окисления цинка равна двум. Типичный пример металла, образующего амфотерные соединения. Амфотерными являются соединения цинка ZnO и Zn(OH)2. Оксид цинка не растворяется в воде, поэтому гидроксид этого элемента может быть получен только косвенным путем – при действии щелочи на растворы солей цинка. Гидроксид цинка малорастворим в воде, но хорошо растворяется в растворах кислот и щелочей. Цинк имеет склонность к образованию комплексных соединений.
Ход работы
Опыт 1. Действие кислот и щелочей на цинк
В 5 пробирок поместить по грануле цинка. В первую прилить щелочь. Какой газ выделяется? Почему выделение газа произошло не сразу, а через некоторое время? Во вторую – концентрированную серную кислоту (при необходимости подогреть, затем – прокипятить). В третью – разбавленную серную кислоту, в четвертую – сильно разбавленную азотную кислоту, в пятую – концентрированную азотную кислоту Записать наблюдения. Написать уравнения реакций, уравнять методом электронного баланса следующие химические реакции:
растворения цинка в щелочи;
растворения окисной пленки цинка в щелочи;
растворения окисной пленки цинка в серной кислоте;
растворения цинка в концентрированной серной кислоте;
растворения цинка в концентрированной серной кислоте при нагревании;
растворения цинка в концентрированной серной кислоте при кипячении;
растворения цинка в разбавленной серной кислоте;
растворения цинка в предельно разбавленной азотной кислоте;
растворения цинка в концентрированной азотной кислоте.
Опыт 2. Получение гидроксида цинка и изучение его амфотерности
В две пробирки налить раствор хлорида цинка. В обе добавить по 1 – 2 капли щелочи. Осадок какого соединения образуется? В первую пробирку налить избыток щелочи, во вторую – соляной кислоты. Почему в обеих пробирках осадок исчез? Написать уравнения реакций:
получения гидроксида цинка из хлорида цинка и гидроксида натрия;
растворения гидроксида цинка в избытке гидроксида натрия;
растворения гидроксида цинка в соляной кислоте
Опыт 3. Нерастворимые соли цинка, их свойства
В три пробирки налить раствор хлорида цинка. В первую пробирку добавить раствор сульфида натрия, во вторую – раствор карбоната натрия, в третью – раствор фосфорной кислоты. Осадки каких соединений и какого цвета выпали? Написать уравнения реакций, учитывая, что во второй пробирке образовавшаяся соль тут же гидролизуется до основного карбоната Zn2(ОН)2СО3. Проверить его на растворимость в соляной кислоте. Осадок, полученный в третьей пробирке проверить на растворимость в NаОН, растворе аммиака, в уксусной кислоте.Написать уравнения реакций:
взаимодействия хлорида цинка и сульфида натрия;
взаимодействия хлорида цинка и карбоната натрия;
гидролиза карбоната цинка до Zn2(ОН)3СО3;
растворения Zn2(ОН)2СО3 в соляной кислоте ;
взаимодействия хлорида цинка и фосфорной кислоты;
растворения фосфата цинка в гидроксиде натрия;
растворения фосфата цинка в растворе аммиака;
растворения фосфата цинка в уксусной кислоте.
Опыт 4. Получение гидроксида алюминия. Изучение его амфотерности
В две пробирки налить раствор хлорида алюминия, добавить в каждую по две капли щелочи. Осадок какого соединения выпал? В одну пробирку добавить щелочь, в другую – разбавленную соляную кислоту. Почему в обеих пробирках осадки растворились? Написать уравнения реакций:
взаимодействия хлорида алюминия со щелочью;
растворения осадка в щелочи;
растворения осадка в кислоте.
Опыт 5. Взаимодействие алюминия с водой, солями и кислотами
Приготовить 6 пробирок. Налить: в первую – разбавленную соляную кислоту, во вторую – разбавленную серную кислоту, в третью – разбавленную азотную кислоту, в четвертую – концентрированную азотную кислоту, в пятую – дистиллированную воду, в шестую – раствор нитрата меди.
В каждую пробирку добавить по 1-2 стружки алюминия ( предварительно очистить алюминий от оксидной пленки). В каком случае не протекает химическая реакция? Почему? Какие газы выделяются из 1-ой, 2-ой, 5-ой пробирок? Какой из 3-ей? Что выделяется в 6-ой пробирке? Записать наблюдения, уравнения соответствующих химических реакций.
Опыт 6. Получение гидроксидов олова и свинца, изучение их амфотерных свойств
В две пробирки налить раствор хлорида олова (II), в две другие – раствор ацетата свинца. Во все добавить по 2 капли щелочи. Осадки каких соединений образуются? В первую и третью пробирки налить избыток щелочи, во вторую и четвертую пробирки - азотную кислоту. Объяснить растворение осадков во всех пробирках. Написать уравнения реакций:
взаимодействия хлорида олова (II) со щелочью;
взаимодействия ацетата свинца (II) со щелочью;
растворения осадка из первой пробирки в щелочи;
растворения осадка из первой пробирки в кислоте;
растворения осадка из второй пробирки в щелочи;
растворения осадка из второй пробирки в кислоте.
Опыт 7. Труднорастворимые соли свинца и их окраска
Приготовить 5 пробирок. Налить: в первую – раствор хлорида натрия, во вторую – разбавленную серную кислоту, в третью – раствор хромата калия, в четвертую – раствор иодида калия, в пятую – раствор сульфида натрия. Во все пробирки добавить раствор ацетата свинца (II). Отметить цвет выпадающих осадков. После отстаивания осадка PbI2 раствор из пробирки слить, добавить к осадку немного воды и нагреть пламенем горелки до его растворения. Раствор охладить.Наблюдать выделение золотисто-желтых кристаллов PbI2. Записать наблюдения и уравнения реакций взаимодействия в молекулярной и ионной формах:
хлорида натрия с ацетатом свинца;
хромата калия с ацетатом свинца;
иодида калия с ацетатом свинца;
сульфида натрия с ацетатом свинца
Опыт 8. Восстановительные свойства солей олова (II )
а) Восстановление железа (III). В две пробирки налить раствор хлорида железа (III), раствор гексациано-феррата(III) калия K3[Fe(CN)6] и несколько капель воды. Отметить окраску полученного раствора. Одну пробирку сохранить в качестве контрольной. В другую пробирку добавить раствор хлорида олова (II).
Как изменилась окраска по сравнению с первоначальной? Чем это объяснить? Гексацианоферрат(III) калия K3[Fe(CN)6] является реактивом на Fe2+, с которым дает комплексное соединение Fe3[Fe(CN)6]2 синего цвета).Написать уравнения реакций:
восстановления хлорида железа (III) хлоридом олова (II);
взаимодействия образовавшегося хлорида железа (II) с K3[Fe(CN)6].
б) Восстановление перманганата калия и дихромата калия. Налить в пробирку раствор хлорида олова (II), подкислить его cоляной кислотой и прилить раствор KMnO4. Наблюдать изменение окраски раствора вследствие восстановления ионов MnO4-.
Опыт повторить, взяв в качестве окислителя раствор K2Cr2O7. Наблюдать появление в растворе зеленой окраски, характерной для иона Cr+3. Написать уравнения реакций взаимодействия:
хлорида олова (II) с KMnO4 в кислой среде;
хлорида олова (II) с K2Cr2O7 в кислой среде.
Опыт 9. Окислительные свойства оксида свинца (IV) В пробирку налить несколько капель серной кислоты и иодида калия. Добавить немного оксида свинца (IV). Нагреть пламенем газовой горелки. Как изменится цвет раствора (после отстаивания осадка), почему? Написать уравнение реакции, расставить коэффициенты с помощью метода электронного баланса.
Контрольные вопросы
Написать уравнения реакций в молекулярной и ионной формах.

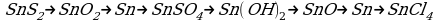
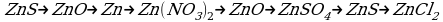
При взаимодействии сульфида свинца с алюминием образуется свинец и сульфид алюминия. Слоставьте уравнение этой реакции и укажите, какой элемент в этой реакции окисляется, а какой восстанавливается.
При растворении 18,6 г технического цинка в избытке раствора соляной кислоты выделилось 5,7 л водовода (н.у.) Определить массовую долю примесей в этом образце цинка.
Алюминиц массой 17 грамм растворили в избытке соляной кислоты. Рассчитайте количество вещества выделяющегося водорода и образовавшегося хлорида цинка.
Сформулируйте вывод по работе.