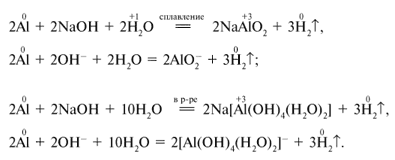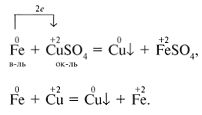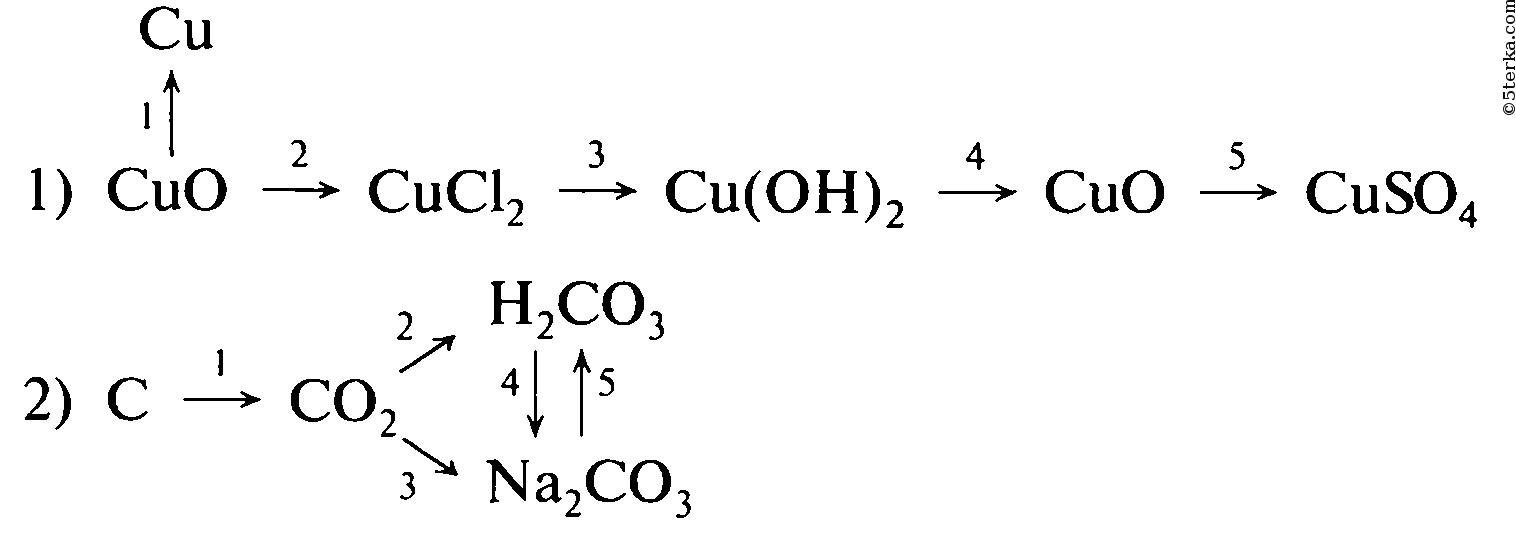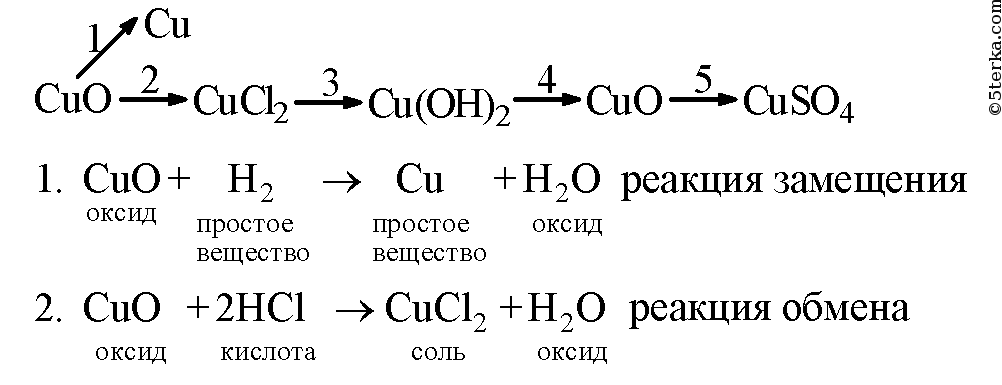Лабораторная работа:
«Взаимодействие металлов с растворами кислот и солей»
Учебная цель: обобщить знания о металлах и их свойствах.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Обучающийся должен знать:
- понятие металлов;
- строение атомов металлов и неметаллов, как это отражается на их окислительно-восстановительных свойства;
- понятие металлической связи; типы кристаллических решеток разных металлов;
- зависимость физических свойств металлов от их строения;
- распространенность металлов в природе в зависимости от их активности.
Обучающийся должен уметь:
- характеризировать металлы малых и больших периодов по их положению в периодической системе Д.И. Менделеева;
- устанавливать связь между строением веществ и их свойствами.
Задачи практического занятия:
Закрепить теоретические знания о свойствах металлов.
Ответить на вопросы для закрепления теоретического материала.
Выполнить практические задачи.
Ответить на вопросы для контроля.
Обеспеченность занятия:
Учебно-методическая литература:
Габриелян О.С. и др. Естествознание. Химия: учебник для студентов профессиональных образовательных организаций, осваивающих профессии и специальности СПО. – М., 2017.
Справочная литература:
Периодическая система химических элементов им. Д.И. Менделеева;
Ряд стандартных электродных потенциалов Е0;
Типы кристаллических решеток металлов.
Ряд напряженности металлов.
Тетрадь для практических и контрольных работ.
Ручка.
Краткие теоретические и учебно-методические материалы по теме практического занятия
Металлы – группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск.
Свойства металлов, обусловлены наличием в их кристаллической решетке большого числа свободных электронов.
Обычно металлы применяют в виде сплавов. Металлический сплав представляет собой вещество, обладающее свойствами металлов и получаемое в результате взаимодействия двух или нескольких элементов.
Все металлы и сплавы можно разделить на черные (железо и сплавы на его основе) и цветные (все остальные металлы и сплавы).
К физическим свойствам металлов относят плотность, температуру плавления, цвет, блеск, непрозрачность, теплопроводность, электропроводность, тепловое расширение. По плотности металлы разделяют на легкие (до 3000 кг/м3) и тяжелые (от 6000 кг/м3 и выше); по температуре плавления – на легкоплавкие (до 973 К) и тугоплавкие (свыше 1173 К). Каждый металл или сплав обладает определенным, присущим ему цветом.
Из химических свойств металлов и их сплавов наиболее важными в производстве художественных изделий являются растворение (взаимодействие с кислотами и щелочами) и окисление (антикоррозийная стойкость, т.е. стойкость к воздействию окружающей среды – газов, воды и т.д.).
Общее химическое свойство, присущее металлам, – способность отдавать свои электроны в химических реакциях:
M – ne = Mn+
Мерой прочности связи электронов в атомах является энергия ионизации. Наименьшая энергия ионизации – у щелочных металлов, являющихся энергичными восстановителями. Восстановительными свойствами металлов обусловлена их способность реагировать с различными окислителями: неметаллами, кислотами, солями менее активных металлов.
По степени легкости отдачи электронов в растворах металлы располагают в ряд – ряд стандартных электродных потенциалов Е0 (приложение 4).
Ряд стандартных электродных потенциалов справедлив для окислительно-восстановительных процессов, происходящих только в водной среде.
Металлы взаимодействуют с неметаллами (обычно при нагревании):
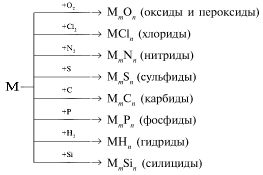
Названия бинарных соединений металлов с неметаллами оканчиваются на -ид. Чем более электроотрицателен элемент, тем он сильнее окисляет металл. Например, железо в реакции соединения с хлором окисляется до степени окисления +3, а с серой до +2.
Важные химические свойства металлов проявляются в их отношении к воде, растворам кислот, щелочам, солям. При рассмотрении взаимодействия металлов с кислотами необходимо учитывать концентрацию кислот и активность металлов.

Щелочи взаимодействуют только с металлами, оксиды которых проявляют амфотерный характер.
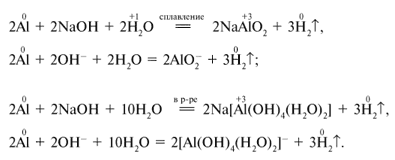
Более активные металлы вытесняют менее активные из растворов их солей.
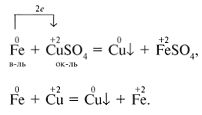
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определённым порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решетка.
Другими словами, кристаллическая решетка – это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Элементарная ячейка – элемент объема из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл.
Элементарная ячейка характеризует особенности строения кристалла.
В металлических материалах, как правило, формируются три типа кристаллических решеток: объемноцентрированная кубическая (ОЦК), гранецентрированная кубическая (ГЦК) и гексагональная плотноупакованная (ГПУ).
Вопросы для закрепления теоретического материала к практическому занятию
Перечислить общие физические свойства металлов.
Что называется кристаллической решеткой, какие типы кристаллических решеток характерны для металлов?
Какие способы получения металлов Вы знаете?
Задания для практического занятия:
Решить предложенные задачи.
Правильно оформить их в тетрадь для практических и контрольных работ.
Ответить на вопросы для контроля.
Отчитаться о выполненной работе преподавателю.
Задание 1
| Напишите уравнение реакции взаимодействия металла с кислотой |
| Вариант 1 | Вариант 2 |
| алюминий + серная кислота | железо + соляная кислота |
Образец решения задания № 1
Напишите управление реакции цинка с соляной кислотой.
Алгоритм решения
Известно, что активные металлы, стоящие в ряду напряженности металлов (приложение 6) до водорода вытесняют его из кислоты, поэтому уравнение реакции цинка с соляной кислотой имеет вид:
Zn + 2HCl ZnCl2 + H2
В результате реакции выделяется газ (H2) водород.
Задание 2
| Напишите уравнение реакции замещения при взаимодействии металла с солью другого металла |
| Вариант 1 | Вариант 2 |
| алюминий + железный купорос | железо + медный купорос |
Образец решения задания № 2
Напишите уравнение реакции замещения при взаимодействии цинка с медным купоросом.
Алгоритм решения
Известно, что активные металлы, стоящие в ряду напряженности металлов (приложение 6) левее вытесняют металлы из их солей, которые стоят правее, поэтому уравнение реакции цинка с медным купоросом имеет вид:
Zn + CuSO4 ZnSO4 + Cu
В результате реакции выделяется металлическая медь (красный осадок).
Задание 3
| Напишите уравнения реакции, с помощью которых можно осуществить следующие превращения. Укажите тип каждой реакции и под формулой каждого вещества подпишите, к какому классу оно относится. |
| Вариант 1 | Вариант 2 |
| Магний оксид магния хлорид магния гидроксид магния сульфат магния Mg MgO MgCl2 Mg(OH)2 MgSO4 | Медь оксид меди сульфат меди гидроксид меди оксид меди Cu CuO CuSO4 Cu(OH)2 CuO |
Образец решения задания № 3
Напишите уравнения реакции, с помощью которых можно осуществить следующие превращения. Укажите тип каждой реакции и под формулой каждого вещества подпишите, к какому классу оно относится.
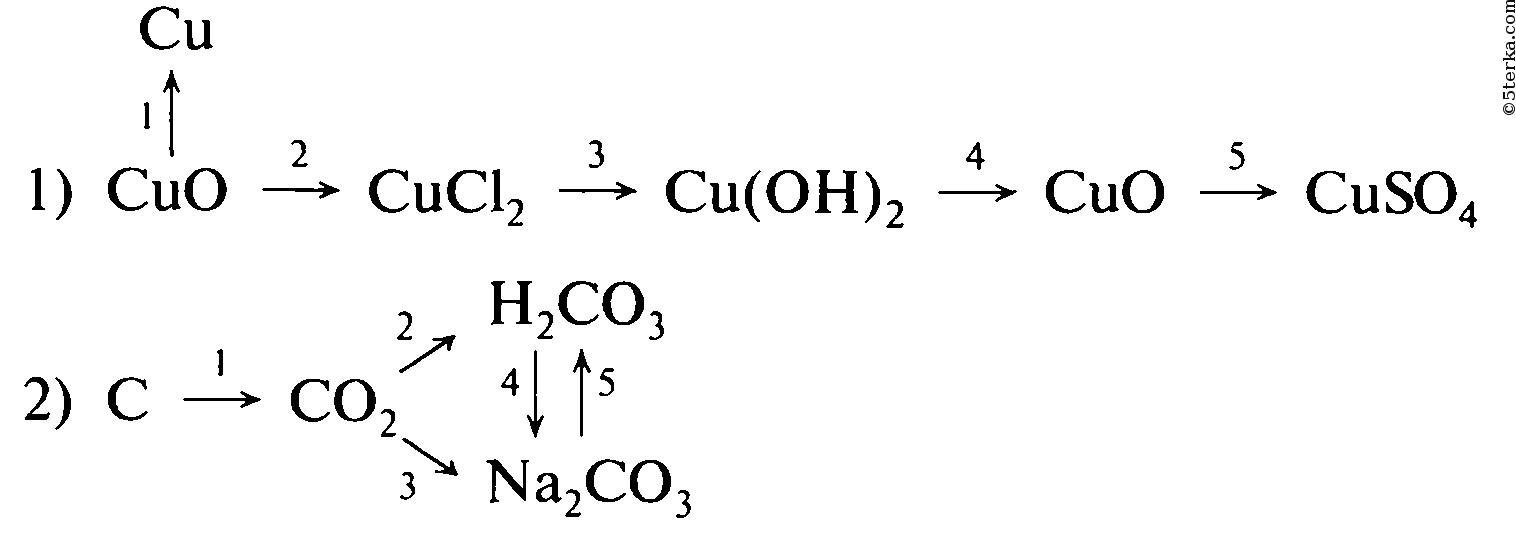
Алгоритм решения
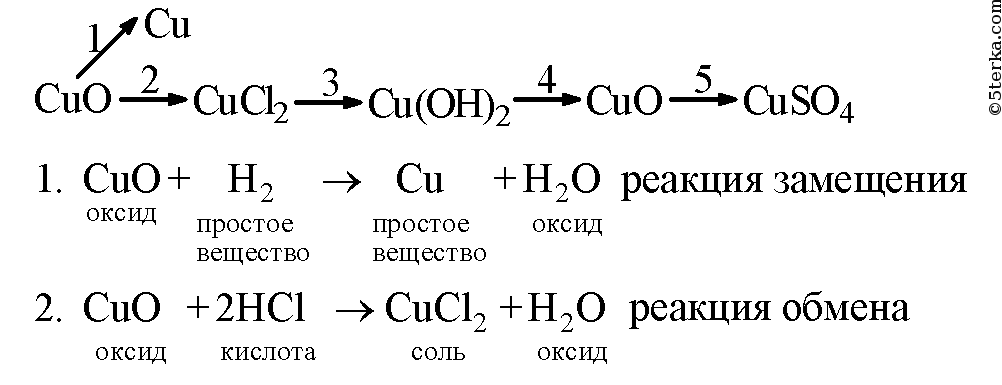
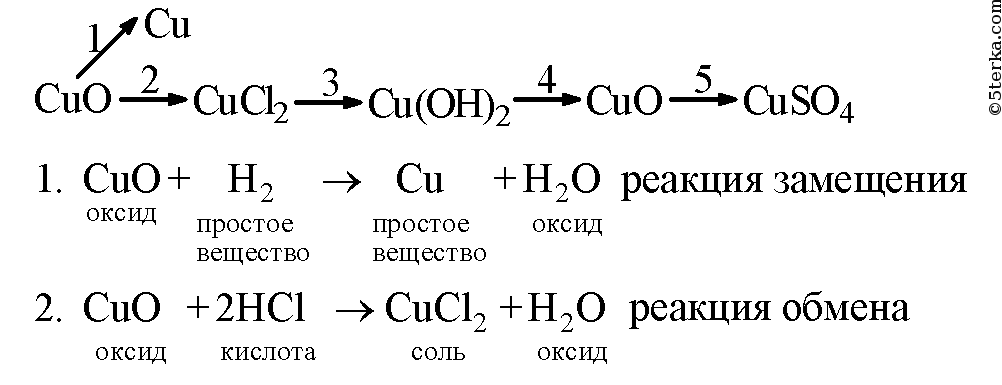

Вопросы для контроля
Перечислите основные химические свойства металлов?
Какую валентность проявляют металлы: натрий, цинк, серебро, медь, кальций, магний, железо, хром?
Запишите, где в вашей профессии и в жизни применяются металлы.
Форма контроля выполнения практического задания:
Выполненная работа представляется преподавателю в тетради для выполнения практических и контрольных работ по дисциплине «Естествознание».
5