Просмотр содержимого документа
«Күкүрт кислотасы жана сульфаттар»

№ 11 В.В.Терешкова атындагы мектеп-интернаты
Химия мугалими: Кимсанова Максуда
Күкүрт кислотасы жана сульфаттар

Физикалык касиеттери
- Күкүрт кислотасы , Н2SО4 - күчтүү эки негиздүү Май сымал бул суюктук жытсыз жана түссүз болуп, суудан дээрлик эки эсе оор. Сууда жакшы эрийт.
- Суусуз күкүрт кислотасы 10,4°С кристаллдаша турган түссүз май сыяктуу суюктук. Күкүрт кислотасы сууда эригенде өтө көп сандагы жылуулук бөлүп чыгуу менен гидрат пайда болот. Күкүрт кислотасы суунун буусун абдан тездик менен синирип алгандыктан газдар кургатууда колдонулат.

Химиялык касиеттери
- Концентрацияланган күкүрт кислотасы (өзгөчө ысык кислота) күчтүү окистендиргич. Ал НI жана, НВr (НС1 эмес) эркин галогенге, көмүрдү СО2, күкүрттү SО2 чейин окистенет. С + 2H 2 SO 4 = CO 2 ↑ + 2SO 2 ↑ + 2H 2 O S + 2H 2 SO 4 = 3SO 2 ↑ + 2H 2 O
- Күкүрт кислотасы металлдар менен өз ара аракеттениши анын концентрациясына жараша ар түрдүү өтөт. Суюлтулган күкүрт кислотасы өзүнүн иону менен суутекти окистендирет. Ошондуктан ал чыналуу катарында суутектен мурун турган металддар менен гана өз ара аракеттенишет. Мисалы. Zn+H2SO4 =ZnSO4+H
- Концентрацияланган күкүрт кислотасы окистендиргич күкүрт (VI) оксиди болуп саналат жана чыңалуу катарында күмүштөн мурда турган металлды гана окистендирет. Калыбына келтирүү продуктусу металл активдүүлүгүнө жана шартка жараша (кислотанын концентрациясы, температура) ар түрдүү болушу мүмкүн.

Металлдар менен аракеттенишүүсү
- Активдүүлүгү начар металл менен өз ара аракеттенишкенде мисалы, жез менен кислота SО2 чейин калыбына келет:
- Сu + 2Н2SO4 = СuSО4 + SО2 + 2Н2O
- Активдүү металл менен аракеттенишкенде калыбына келүүнүн продуктусу SО2 же эркин күкүрт жана суутек сульфиди болушу мүмкүн, мисалы.,
- Zn + Н2SО4 = ZnSО4 + SО2 + 2Н2O
- 3Zn + 4Н2SО4 = 3ZnSО4 + S¯ + 4Н2О
- 4Zn + 5Н2SО4 = 4ZnSО4 + Н2S + 4Н2О

Диссоцация баскычтары
- Күкүрт кислотасы эки баскыч менен диссоциацияланат. Концентрациясы анчалык жогору эмес эритмеде 1-баскычында ал бүт бойдон диссоциацияланат: Н2SО4 Н++ НSО42-
- экинчи баскычында диссоциация начар жүрөт: НSО4- Н+ +SО42-
- Экинчи баскыч боюнча күкүрт кислотасынын диссоциация константасы К2 =10 -2 барабар.
- Эки негиздүү кислота катарында күкүрт кислотасы эки түрдүү тузду пайда кылат: орто жана кычкыл. Күкүрт кислотасынын орто туздары сульфаттар деп, ал эми кычкыл туздары гидросульфаттар деп аталат.
- Күкүрт кислотасынын көпчүлүк туздары сууда жакшы эрийт. Практикалык жактан эрибей турган туздары: ВаSО4, SnSО4, РbSО4. Кальций сульфаты СаSО4 начар эрийт. Барий эрибей турган туздары сульфат иону үчүн реактив болуп саналат.

Алынышы
- Кислотаны алууда күкүрттүн жаратылыштагы кен байлыктары колдонулат. Сырьё катары эркин абалдагы күкүрт, сульфид жана сульфат кендери, пирит FeS2, ондүрүш калдыктары пайдаланылат. Күкүрт кислотасы негизинен өнөр жайда гана алынат. Ал эми сульфит кислотасын лабораториялык шартта алууга болот.
- Өнөр жайларында күкүрт кислотасы күкүрт (IV) оксидин SО2 күкүрт (VI) оксидине чейин окистендирип, андан кийин SО3 суу менен аракеттендирүүдөн алынат
- Алынган кислота концентрациясы 91- 94% чейин, ал эми тыгыздыгы 1,825-1,84 г/см3 жетет. Күкүрт. кислотасы химиялык өнөр жайларында эң маанилүү продуктусу болуп саналат.
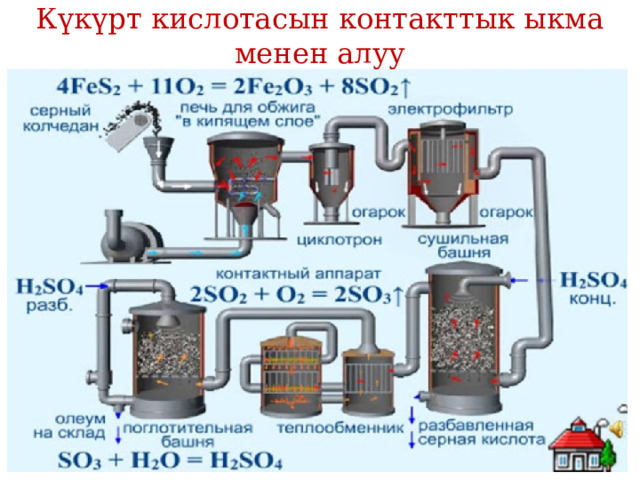
Күкүрт кислотасын контакттык ыкма менен алуу

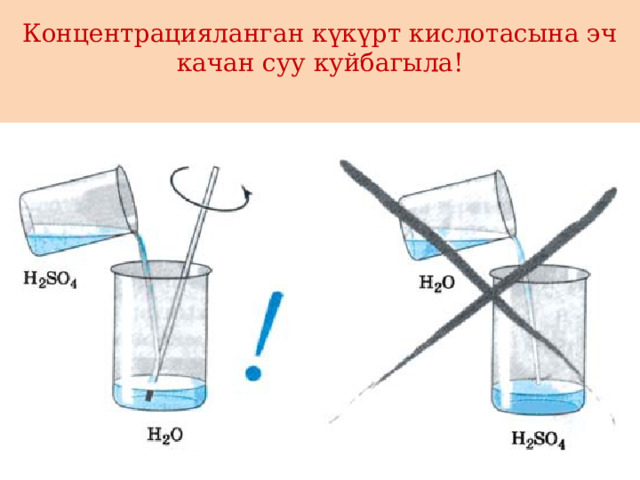
Концентрацияланган күкүрт кислотасына эч качан суу куйбагыла!

Күкүрт кислотасынын колдонулушу
- Минералдык жер семирткичтерди өндүрүүдө
- Муңайзат продуктыларын тазалоодо
- Хлор өндүрүүдө
- Ар түрдүү туздарды жана кислоталарды, дары-дармектерди алууда
- Жарылуучу заттарды даярдоодо
- Боекторду алууда
- Целлюлоза өндүрүүдо
- Кислоталуу аккумляторлорду даярдоодо
- Кара металлдарды өндүрүү сыяктуу тармактарда кеңири колдонулат.
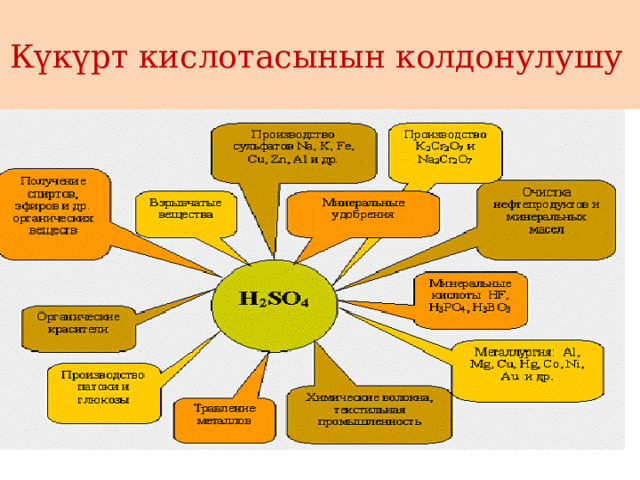
Күкүрт кислотасынын колдонулушу

Сульфаттар
- Күкүрт кислотасынын орто туздары-сульфаттар, ал эми кычкыл туздары гидросульфаттар деп аталат.
- Кристаллдарында суусу бар сульфаттар –купоростор-ачуу таштар деген ат менен белгилүү .
VSO 4 ·7H 2 O -ванадий купоросу
FeSO 4 ·7H 2 O - темир купоросу
CoSO 4 ·7H 2 O -кобальт купоросу
CuSO 4 ·5H 2 O - жез купоросу
NiSO 4 ·7H 2 O - никель купоросу
PbSO 4 - коргошун купоросу
CrSO 4 ·7H 2 O -хром купоросу
ZnSO 4 ·7H 2 O - цинк купоросу
MnSO 4 ·5H 2 O - марганец купорос у
![Кош туздар Кош туздар –купоростор Кош туздар эки бөлөк орто туздардын аралашмасынан келип чыгат. Мында тиешелүү индекстер экиге кыскартылып алынды. Мисалы: K2SO4+Al2(SO4)=KАl(SO4)2 Кош туздар — эки металл жана бир кислотадан пайда болгон туздар. Бир металл жана эки кислотадан пайда болгон туздар аралашма туздар деп аталат. Кош туздарга алюминий калий ачыкташы же калий-алюминий сульфаты мисал боло алат. К[А1(SО 4)2], К2 [РtСl 6] Алюминий калий ачыкташы анчалык туруктуу эмес, анын эритмеси туруктуулугу температурага жана эриткич жаратылышына көз каранды болот. Ошондуктан төмөнкү температурада атайын тандалып алынган эриткичтерде ачыкташтар башка кош туздардай эле туруктуу болушу мүмкүн.](https://fsd.multiurok.ru/html/2022/12/30/s_63af4dc3b3354/img12.jpg)
Кош туздар
- Кош туздар –купоростор
- Кош туздар эки бөлөк орто туздардын аралашмасынан келип чыгат. Мында тиешелүү индекстер экиге кыскартылып алынды. Мисалы:
- K2SO4+Al2(SO4)=KАl(SO4)2
- Кош туздар — эки металл жана бир кислотадан пайда болгон туздар. Бир металл жана эки кислотадан пайда болгон туздар аралашма туздар деп аталат. Кош туздарга алюминий калий ачыкташы же калий-алюминий сульфаты мисал боло алат. К[А1(SО 4)2], К2 [РtСl 6] Алюминий калий ачыкташы анчалык туруктуу эмес, анын эритмеси туруктуулугу температурага жана эриткич жаратылышына көз каранды болот. Ошондуктан төмөнкү температурада атайын тандалып алынган эриткичтерде ачыкташтар башка кош туздардай эле туруктуу болушу мүмкүн.

Таралышы жана колдонулушу
Сульфаттар жаратылышта ар түрдүү минералдар түрүндө көп кездешет жана алар өнөр жайда, айыл чарбасында, медицинада жана башка тармактарда колдонулат. Мисалы, гипс CaSO4x2H2O шор топуракты жакшыртуу үчүн пайдаланылат. Ал эми калий сульфаты K2SO4 жер семирткич, FeSO4x7H2O уулу химикат катары, глаубер тузу Na2SO4x7H2O медицинада, ветеринарияда, сода жана айнек чыгаруучу өнөр жайларда кеңири пайдаланылат.
Натрий тиосульфаты Na2S2O3x5H2O сүрөт чыгарууда пайданалынат. Анын сүрөттү сактап калуу жөндөмдүүлүгү күмүш бромиди AgBr менен татаал бирикмени пайда кылуу жөндөмдүүлүгүнө негизделген. Мындан тышкары натрий тиосульфаты, аналитикалык химияда, иодду аныктоодо жана кездемелерди актоодо ашыкча алынган хлорду сиңирип алууда пайдаланылат.
Na2S2O3+4Cl2+5H2O+2H2SO4+6HCl+2NaCl



















![Кош туздар Кош туздар –купоростор Кош туздар эки бөлөк орто туздардын аралашмасынан келип чыгат. Мында тиешелүү индекстер экиге кыскартылып алынды. Мисалы: K2SO4+Al2(SO4)=KАl(SO4)2 Кош туздар — эки металл жана бир кислотадан пайда болгон туздар. Бир металл жана эки кислотадан пайда болгон туздар аралашма туздар деп аталат. Кош туздарга алюминий калий ачыкташы же калий-алюминий сульфаты мисал боло алат. К[А1(SО 4)2], К2 [РtСl 6] Алюминий калий ачыкташы анчалык туруктуу эмес, анын эритмеси туруктуулугу температурага жана эриткич жаратылышына көз каранды болот. Ошондуктан төмөнкү температурада атайын тандалып алынган эриткичтерде ачыкташтар башка кош туздардай эле туруктуу болушу мүмкүн.](https://fsd.multiurok.ru/html/2022/12/30/s_63af4dc3b3354/img12.jpg)


















