Муниципальное казенное общеобразовательное учреждение
Костромского муниципального района Костромской области
«Чернопенская средняя общеобразовательная школа»
Контрольно-оценочные средства
по химии
(8 класс)
Разработчик:
Яблокова Надежда Николаевна,
учитель химии
МКОУ «Чернопенская СОШ»
2018
Итоговая контрольная работа по предмету ХИМИЯ
1. Кодификатор
Предмет: «ХИМИЯ» 8 класс
Учебник для общеобразовательных учреждений под редакцией О.С.Габриеляна
Вид контроля: итоговый
ТАБЛИЦА 1.
Перечень элементов предметного содержания, проверяемых на контрольной работе
| Код содержательного блока | Код контролируемого элемента | Элементы содержания |
| 1 | Вещество |
| | 1.1. | Строение атома. Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева |
| | 1.2. | Периодический закон и Периодическая система химических элементов Д.И. Менделеева |
| | 1.2.1 | Группы и периоды Периодической системы. Физический смысл порядкового номера химического элемента. |
| | 1.2.2. | Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов Д.И. Менделеева. |
| | 1.3. | Строение веществ. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая. |
| | 1.4. | Валентность химических элементов. Степень окисления химических элементов. |
| | 1.5. | Чистые вещества и смеси. |
| | 1.6. | Атомы и молекулы. Химический элемент. Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических соединений. |
| 2 | Химическая реакция |
| | 2.1. | Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях. |
| | 2.2. | Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ, изменению степеней окисления химических элементов, поглощению и выделению энергии. |
| | 2.3. | Электролиты и неэлектролиты |
| | 2.4. | Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей (средних). |
| | 2.5. | Реакции ионного обмена и условия их осуществления. |
| | 2.6. | Окислительно-восстановительные реакции. Окислитель и восстановитель. |
| 3 | Элементарные основы неорганической химии. Представления об органических веществах |
| | 3.1. | Химические свойства простых веществ. |
| | 3.1.1. | Химические свойства простых веществ-металлов: щелочных и щелочноземельных металлов, алюминия, железа. |
| | 3.1.2. | Химические свойства простых веществ-неметаллов: водорода, кислорода, галогенов, серы, азота, фосфора, углерода, кремния. |
| | 3.2. | Химические свойства сложных веществ. |
| | 3.2.1. | Химические свойства оксидов: основных, амфотерных, кислотных. |
| | 3.2.2. | Химические свойства оснований. |
| | 3.2.3. | Химические свойства кислот. |
| | 3.2.4. | Химические свойства солей (средних). |
| | 3.3. | Взаимосвязь различных классов неорганических веществ. |
| | 3.4. | Первоначальные сведения об органических веществах. |
| | 3.4.1. | Углеводороды предельные и непредельные: метан, этан, этилен, ацетилен. |
| | 3.4.2. | Кислородсодержащие вещества: спирты (метанол, этанол, глицерин), карбоновые кислоты (уксусная и стеариновая). |
| | 3.4.3. | Биологически важные вещества: белки, жиры, углеводы. |
| 4 | Методы познания веществ и химических явлений. Экспериментальные основы химии |
| | 4.1. | Правила безопасной работы в школьной лаборатории. Лабораторная посуда и оборудование. Разделение смесей и очистка веществ. Приготовление растворов. |
| | 4.2. | Определение характера среды раствора кислот и щелочей с помощью индикаторов. Качественные реакции на ионы в растворе (хлорид-, сульфат-, карбонат-ионы, ион аммония). |
| | 4.3. | Получение газообразных веществ. Качественные реакции на газообразные вещества (кислород, водород, углекислый газ, аммиак). |
| | 4.4. | Получение и изучение свойств изученных классов неорганических веществ. |
| | 4.5. | Проведение расчетов на основе формул и уравнений реакций. |
| | 4.5.1. | Вычисления массовой доли химического элемента в веществе. |
| | 4.5.2. | Вычисления массовой доли растворенного вещества в растворе. |
| | 4.5.3. | Вычисление количества вещества, массы или объема вещества по количеству вещества, массе или объему одного из реагентов или продуктов реакции. |
| 5 | Химия и жизнь |
| | 5.1. | Проблемы безопасного использования веществ и химических реакций в повседневной жизни. |
| | 5.2. | Химическое загрязнение окружающей среды и его последствия. |
| | 5.3. | Человек в мире веществ, материалов и химических реакций. |
ТАБЛИЦА 2. Перечень требований к уровню подготовки обучающихся, освоивших общеобразовательные программы основного общего образования по ХИМИИ.
| Код требований | Описание требований к уровню подготовки, |
| 1 | Знать/понимать: |
| 1.1. | химическую символику: знаки химических элементов, формулы химических веществ, уравнения химических реакций; |
| 1.2. | важнейшие химические понятия: вещество, химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, катион, анион, химическая связь, электроотрицательность, валентность, степень окисления, моль, молярная масса, молярный объем, растворы, электролиты и неэлектролиты, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление, тепловой эффект реакции, основные типы реакций в неорганической химии; |
| 1.2.1. | характерные признаки важнейших химических понятий; |
| 1.2.2. | о существовании взаимосвязи между важнейшими химическими понятиями; |
| 1.3. | смысл основных законов и теорий химии: атомно-молекулярная теория; законы сохранения массы веществ, постоянства состава; Периодический закон Д.И. Менделеева. |
| 1.4. | первоначальные сведения о строении органических веществ. |
| 2. | Уметь: |
| 2.1. | Называть: |
| 2.1.1 | химические элементы; |
| 2.1.2 | соединения изученных классов неорганических веществ; |
| 2.1.3 | органические вещества по их формуле: метан, этан, этилен, ацетилен, метанол, этанол, глицерин, уксусная кислота, глюкоза, сахароза |
| 2.2 | Объяснять: |
| 2.2.1 | физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода в Периодической системе Д.И. Менделеева, к которым элемент принадлежит; |
| 2.2.2 | закономерности изменения строения атомов, свойств элементов в пределах малых периодов и главных подгрупп, а также свойства образуемых ими высших оксидов |
| 2.2.3 | сущность процесса электролитической диссоциации и реакций ионного обмена |
| 2.3 | Характеризовать: |
| 2.3.1 | химические элементы (от водорода до кальция) на основе их положения в Периодической системе химических элементов Д.И. Менделеева и особенностей строения их атомов; |
| 2.3.2 | взаимосвязь между составом, строением и свойствами неорганических веществ; |
| 2.3.3 | химические свойства основных классов неорганических веществ (оксидов, кислот, оснований и солей); |
| 2.3.4 | взаимосвязь между составом, строением и свойствами отдельных представителей органических веществ |
| 2.4 | Определять/классифицировать: |
| 2.4.1 | состав веществ по их формулам; |
| 2.4.2 | валентность и степень окисления элемента в соединении; |
| 2.4.3 | вид химической связи в соединениях; |
| 2.4.4 | принадлежность веществ к определенному классу соединений; |
| 2.4.5 | типы химических реакций; |
| 2.4.6 | возможность протекания реакций ионного обмена; |
| 2.4.7 | возможность протекания реакций некоторых представителей органических веществ: с кислородом, водородом, металлами, водой, основаниями, кислотами, солями. |
| 2.5 | Составлять: |
| 2.5.1 | схемы строения атомов первых 20 элементов Периодической системы Д.И. Менделеева; |
| 2.5.2 | формулы неорганических соединений изученных классов; |
| 2.5.3 | уравнения химических реакций. |
| 2.6 | Обращаться: с химической посудой и лабораторным оборудованием. |
| 2.7 | Проводить опыты / распознавать опытным путем: |
| 2.7.1 | подтверждающие химические свойства изученных классов неорганических веществ; |
| 2.7.2 | по получению, собиранию и изучению химических свойств неорганических веществ; |
| 2.7.3 | газообразные вещества: кислород, водород, углекислый газ, аммиак; |
| 2.7.4 | растворы кислот и щелочей по изменению окраски индикатора; |
| 2.7.5 | кислоты, щелочи и соли по наличию в их растворах хлорид-, сульфат-, карбонат-ионов и иона аммония. |
| 2.8 | Вычислять: |
| 2.8.1 | массовую долю химического элемента по формуле соединения; |
| 2.8.2 | массовую долю вещества в растворе; |
| 2.8.3 | количество вещества, объем или массу вещества по количеству вещества, объему или массе реагентов или продуктов реакции. |
| 2.9 | Использовать приобретенные знания и умения в практической деятельности и повседневной жизни для: |
| 2.9.1 | безопасного обращения с веществами и материалами в повседневной жизни и грамотного оказания первой помощи при ожогах кислотами и щелочами; |
| 2.9.2 | массовую долю вещества в растворе; |
| 2.9.3 | количество вещества, объем или массу вещества по количеству вещества, объему или массе реагентов или продуктов реакции. |
Раздел 3. Перечень элементов метапредметного содержания, проверяемых при проведении промежуточной аттестации и тематических контрольных работ по ХИМИИ учащихся 8 (9) классов
| Код эле- мента | Описание элементов метапредметного содержания |
| 3.1 | Умение соотносить данные (познавательное УУД) |
| 3.2 | Умение структурировать знания (познавательное УУД) |
| 3.3 | Умение определять понятия (познавательное УУД) |
| 3.4 | Умение работать со знаково-символическими средствами (познавательное УУД) |
| 3.5 | Умение классифицировать (логическое УУД) |
| 3.6 | Умение устанавливать причинно-следственные связи (познавательное УУД) |
| 3.7 | Умение устанавливать аналогии (логическое УУД) |
| 3.8 | Умение строить логические рассуждения, умозаключения и делать выводы |
| 3.9 | Умение использовать общий приём решения задач (логическое УУД) |
| 3.10 | Умение производить вычислительные действия (логическое УУД) |
| 3.11 | Умение оценивать правильность выполнения учебной задачи (регулятивное УУД) |
| 3.12 | Умение выражать свои мысли в соответствии с задачами и условиями коммуникации (коммуникативное УУД) |
Спецификация контрольных измерительных материалов для проведения
промежуточной аттестации и тематических контрольных работ по ХИМИИ
учащихся 8 (9) классов (основная школа) (на 45 минут)
Предмет: «ХИМИЯ» 8 класс
Учебник для общеобразовательных учреждений под редакцией О.С.Габриеляна.
Вид контроля: итоговый.
Тема: «Итоговая контрольная работа за курс 8 класса».
Назначение контрольной работы:
- проверить успешность в освоении содержания курса химии 8 класса,
- выявить успешность в освоении предметных умений.
Дополнительное оборудование контрольных измерительных заданий:
- таблица растворимости солей, кислот и оснований в воде,
- электрохимический ряд напряжений металлов,
- периодическая система химических элементов Д.И.Менделеева.
Характеристика структуры и содержания работы
Подходы к отбору содержания контрольной работы:
Разработка заданий осуществлялась с учетом следующих общих положений.
-Ориентированы на проверку усвоения системы знаний, которая рассматривается в качестве инвариантного ядра содержания действующих программ по химии для основной школы.
-Призваны обеспечивать возможность дифференцированной оценки. В этих целях проверка усвоения основных элементов содержания курса химии осуществляется на трех уровнях сложности: базовом, повышенном и высоком.
Каждый вариант контрольной работы состоит из __2__ частей.
Часть 1 содержит ___10________ заданий базового и повышенного уровня сложности
Часть 2 содержит ___2_____ задания высокого уровня сложности, с развернутым ответом.
Задания расположены по принципу постепенного нарастания уровня их сложности.
Таблица
Распределение заданий по уровням сложности, проверяемым элементам предметного, содержания, уровню подготовки, типам заданий и времени выполнения.
| № задания | уровень | Что проверяется | Примерное время выполнения задания |
| Коды проверяемых элементов содержания | Коды проверяемых требований к уровню подготовки учащихся |
| 1 | базовый | 1.1 | 1.1 2.3.1 2.5.1 | 1 мин. |
| 2 | базовый | 1.1 1.2 | 2.2.1 2.5.1 | 1 мин. |
| 3 | базовый | 1.3 | 2.4.3 | 1 мин. |
| 4 | базовый | 1.4 | 1.2 2.4.2 | 1 мин. |
| 5 | базовый | 1.6 | 2.4.1 2.4.4 | 1 мин. |
| 6 | базовый | 1.6 | 2.4.1 2.4.4 | 1 мин. |
| 7 | базовый | 3.2 | 2.3.3 | 1 мин. |
| 8 | базовый | 2.5 | 2.4.6 2.5.3 | 1 мин. |
| 9 | повышенный | 1.6 | 2.4.1 2.4.4 | 4 мин. |
| 10 | повышенный | 2.1 2.5 3.1 3.2.1 3.2.2 3.2.4 | 1.1 2.2.3 2.3.3 2.4.6 2.5.3 | 9 мин. |
| 11 | высокий | 2.6 | 2.4 | 9 мин |
| 12 | высокий | 4.5.2 4.5.3 | 2.8.2 2.8.3 3.10 3.12 | 15 мин |
Распределение заданий по уровням сложности
| № п/п | Уровни | № заданий | Количество заданий | % от общего количества |
| 1 | Базовый | 1-8 | 8 | 80% |
| 2 | Повышенный | 9-10 | 2 | 10% |
| 3 | Высокий | 11-12 | 2 | 10% |
Контрольная работа составляется в 2 вариантах.
Задания в контрольной работе оцениваются в зависимости от сложности задания разным количеством баллов.
Таблица.
Критерии оценивания
| № задания | Количество баллов |
| 1 | 1 |
| 2 | 1 |
| 3 | 1 |
| 4 | 1 |
| 5 | 1 |
| 6 | 1 |
| 7 | 1 |
| 8 | 1 |
| 9 | 2 |
| 10 | 4 Ошибок нет – 4 балла Допущена 1 ошибка – 3 балла Допущено 2 ошибки – 2 балла Допущено 3 ошибки –1 балл Допущено 4 ошибки –0балл |
| 11 | 3 |
| 12 | 4 |
| Итого | 21 балл |
Таблица.
Перевод баллов к 5-балльной отметке
| Баллы | Отметка |
| 16-21балла | Отметка «5» |
| 12-15 баллов | Отметка «4» |
| 7-11 баллов | Отметка «3» |
| 0-6 баллов | Отметка «2» |
Итоговая работа за курс VIII класса
Инструкция по выполнению работы
На выполнение работы по химии отводится 45 минут. Работа состоит из двух частей и включает в себя 12 заданий.
Ответы к заданиям 1 – 8 записываются в виде одной цифры, которая соответствует
номеру правильного ответа.
Ответы к заданиям 9 записываются в виде последовательности цифр в поле
ответа в тексте работы.
В случае записи неверного ответа зачеркните его и запишите рядом новый.
На задания 10-12 следует дать полный развёрнутый ответ, включающий необходимые уравнения реакций и расчёты.
Советуем выполнять задания в том порядке, в котором они даны. В целях экономии
времени пропускайте задание, которое не удаётся выполнить сразу, и переходите к следующему. Если после выполнения всей работы у вас останется время, то вы сможете вернуться к пропущенным заданиям. Постарайтесь выполнить как можно больше заданий.
Желаем успеха!
I вариант
| При выполнении заданий 1–8 в поле ответа запишите одну цифру, которая соответствует номеру правильного ответа. |
Часть 1
1. Три энергетических уровня содержит электронная оболочка атома:
а) кремния
б) бериллия
в) калия
г) гелия
2.Четыре электронов находятся на внешнем энергетическом уровне атома:
а) золота
б) углерода
в) хром
г) кислорода
3. Выберите соединение с ковалентной полярной связью:
а) O2
б) HCl
в) NaCl
г) N2
4. Выберите формулу соединения серы, в котором она проявляет степень окисления -2
а) SO2
б) SO3
в) H2S
г) SF6
5. Выберите формулу оксида железа (III):
а) FeO
б) FeCl3
в) Fe2O3
г) ОF2
6. Выберите ряд формул, в котором все вещества являются основаниями:
а) Fe2O3, ZnO, Cu(OH)2
б) Ba(NO3)2, Ba(OН)2, Н2SO4
в) КОН, Fe(OH)3, NaОН
г) Zn(OН)2, НCl, H2O
7. Оксид кальция СаО реагирует с:
а) HNO3
б) Li2O
в) Cu
г)MgSO4
8. Выберите краткое ионное уравнение для реакции 2КОН + Н2SO4= К2SO4 + 2Н2O
а) ОН- + Н+= Н2O
б) 2КОН + 2 Н+= 2К+ + 2Н2O
в) 2ОН- + 2Н+= 2Н2O
г) 2К+ + 2ОН- + 2 Н+ + SO42- = 2К+ +SO42- +2H2O
| При выполнении заданий 9 к каждому элементу первого столбца подберите соответствующий элемент из второго столбца. Выбранные цифры запишите под соответствующими буквами таблицы. Цифры в ответе могут повторяться. |
9. Установите соответствие между формулой вещества и его принадлежностью к определенному классу неорганических соединений.
Класс веществ: Формула вещества:
1. оксиды а) HNO2
2. основания б) P2O5
3. кислоты в) Fe(OH)3
4. соли г) Mg(NO3)2
Часть 2
10. Напишите уравнения практически осуществимых химических реакций. Выберите реакцию обмена и запишите ее в молекулярном и ионном виде.
1. Cu + O2 =
2. CuO + H2O =
3. CuO + H2SO4 =
4. CuSO4 + NaOH =
| Ответы на задания 11, 12 записывайте чётко и разборчиво. |
11. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой:
HJ + H2SO4 = J2 + H2S + H2O
Определите окислитель и восстановитель.
12. Через 40 г раствора с массовой долей гидроксида натрия 8% пропустили сернистый газ. При этом образовался сульфит натрия. Вычислите объём (н. у.) вступившего в реакцию газа.
Итоговая работа за курс VIII класса
Инструкция по выполнению работы
На выполнение работы по химии отводится 45 минут. Работа состоит из двух частей и включает в себя 12 заданий.
Ответы к заданиям 1 – 8 записываются в виде одной цифры, которая соответствует
номеру правильного ответа.
Ответы к заданиям 9 записываются в виде последовательности цифр в поле
ответа в тексте работы.
В случае записи неверного ответа зачеркните его и запишите рядом новый.
На задания 10-12 следует дать полный развёрнутый ответ, включающий необходимые уравнения реакций и расчёты.
Советуем выполнять задания в том порядке, в котором они даны. В целях экономии
времени пропускайте задание, которое не удаётся выполнить сразу, и переходите к следующему. Если после выполнения всей работы у вас останется время, то вы сможете вернуться к пропущенным заданиям. Постарайтесь выполнить как можно больше заданий.
Желаем успеха!
II вариант
| При выполнении заданий 1–8 в поле ответа запишите одну цифру, которая соответствует номеру правильного ответа. |
Часть 1
1. Пять энергетических уровней содержит электронная оболочка атома:
а) калия
б) золота
в) серебра
г) гелия
2. Три электрона находятся на внешнем энергетическом уровне атома:
а) золота
б) алюминий
в) хлор
г) кислорода
3. Выберите соединение с ковалентной неполярной связью:
а) O2
б) H2S
в) H2O
г) NaCl
4. Вещество, в котором сера проявляет степень окисления +4, имеет формулу:
а) H2S
б) SO2
в) SO3
г) Na2S
5. Вещество, имеющее формулу NaNO3, называется:
а) карбонат натрия
б) нитрит натрия
в) хлорид натрия
г) нитрат натрия
6. Ряд формул, в котором все вещества являются оксидами:
а) ZnO, ZnCl2 , HCl
б) SO3, MgO, CuO
в) KOH, K 2O, MgO
г) HNO3 , P2O5, NaCl
7. Соляная кислота реагирует с:
а) HNO3
б) СO2
в) Zn
г) MgCl
8. Какое краткое ионное уравнение отображает сущность процесса
NaOH + HCl = NaCl + H2O
а) H+ + OH- = H 2O
б) NaOH + H+ = Na+ + H 2O
в) 2H++ 2OH- = 2 H2 O
г) OH- + HCl = Cl- + H 2O
| При выполнении заданий 9 к каждому элементу первого столбца подберите соответствующий элемент из второго столбца. Выбранные цифры запишите под соответствующими буквами таблицы. Цифры в ответе могут повторяться. |
9. Установите соответствие между формулой вещества и его принадлежностью к определенному классу неорганических соединений.
Класс веществ: Формула вещества:
1) оксиды а) NaOH г) NaNO3
2) основания б) HCl д) H2
3) кислоты в) CaO
4) соли
Часть 2
10. Напишите уравнения практически осуществимых химических реакций. Выберите реакцию обмена и запишите ее в молекулярном и ионном виде.
1. Mg + O2 =
2. MgO + H2SO4 =
3. MgSO4 + NaOH =
4. Cu + HCl =
| Ответы на задания 11, 12 записывайте чётко и разборчиво. |
11. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой:
HNO3 + FeO = Fe(NO3)3 + NO + H2O
Определите окислитель и восстановитель.
12. К раствору карбоната калия массой 110,4 г и массовой долей 5% прилили избыток раствора нитрата кальция. Вычислите массу образовавшегося осадка.
Ответы по итоговой работе
Часть 1
| Номер задания | Вариант I | Вариант II |
| 1 | в | в |
| 2 | б | б |
| 3 | б | а |
| 4 | в | б |
| 5 | в | г |
| 6 | в | б |
| 7 | а | в |
| 8 | в | а |
| 9 | 1б, 2в, 3а, 4г | 1в, 2а, 3б, 4г |
Часть 2
1 вариант
Задание 10
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
|  2Cu + O2 = 2CuO 2Cu + O2 = 2CuO
| 1 |
| CuO + H 2SO4= CuSO4 +H 2O | 1 |
| CuSO4 + 2NaOH = Na 2SO4 + Cu(OH)2↓ Cu 2+ + SO42- + 2Na+ + 2OH- = 2Na+ + SO42- + Cu(OH)2↓ Cu2+ + 2OH- = Cu(OH)2↓ | 2 |
| Максимальный балл | 4 |
2 вариант
| Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысл) | Баллы |
| 2Mg + O2 = 2MgO | 1 |
| MgO + Н 2SО4 = MgSО4 + Н 2O | 1 |
| MgSО4 + 2NaOH = Mg(OH)2↓ + Na2SО4 Mg2+ + SO42- + 2Na+ + 2OH- = Mg(OH)2↓+2Na+ + SO42- Mg2+ + 2OH- = Mg(OH)2↓ | 2 |
| Максимальный балл | 4 |
Критерии оценивания выполнения заданий с развёрнутым ответом.
I вариант
11. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой:
HJ + H2SO4 = J2 + H2S + H2O
Определите окислитель и восстановитель.
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла). | Баллы |
| 1) Составлен электронный баланс: 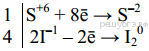 2) Расставлены коэффициенты в уравнении реакции: 8HJ + H2SO4 = 4 J2 + H2S + 4 H2O 3) Указано, что сера в степени окисления +6 является окислителем, а иод в степени окисления −1 — восстановителем.
|
|
| Ответ правильный и полный, включает все названные элементы | 3 |
| В ответе допущена ошибка только в одном из названных элементов | 2 |
| В ответе допущены ошибки в двух из названных элементов | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
|
|
|
II вариант
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой:
HNO3 + FeO = Fe(NO3)3 + NO + H2O
Определите окислитель и восстановитель.
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла). | Баллы |
|
1) Составлен электронный баланс: 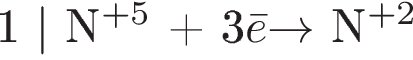 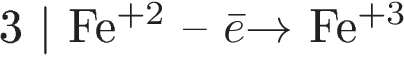
2) Определены коэффициенты, и составлено уравнение реакции:

3) Указаны окислитель и восстановитель: окислитель —  восстановитель — восстановитель — 
|
|
| Ответ правильный и полный, включает все названные элементы | 3 |
| В ответе допущена ошибка только в одном из названных элементов | 2 |
| В ответе допущены ошибки в двух из названных элементов | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
|
|
|
I вариант.
12. Через 40 г раствора с массовой долей гидроксида натрия 8% пропустили сернистый газ. При этом образовался сульфит натрия. Вычислите объём (н. у.) вступившего в реакцию газа.
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
| 1) Составим уравнение реакции: 
2) Рассчитаем массу и количество вещества гидроксида натрия, содержащегося в растворе: 
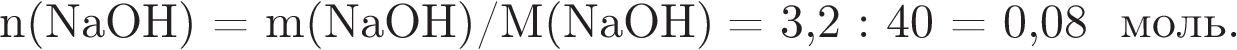
3) Определим объём сернистого газа, вступившего в реакцию: по уравнению реакции  
Ответ: 0,896 л. |
|
| Ответ правильный и полный, включает все названные выше элементы | 4 |
| Правильно записаны три первых элемента ответа | 3 |
| Правильно записаны два первых элемента ответа | 2 |
| Правильно записан один элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 4 |
II вариант
12. К раствору карбоната калия массой 110,4 г и массовой долей 5% прилили избыток раствора нитрата кальция. Вычислите массу образовавшегося осадка.
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
| 1) Составлено уравнение реакции: 
2) Рассчитаны масса и количество вещества карбоната калия, содержащегося в растворе: 
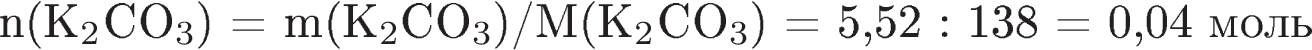
3) Определена масса осадка: по уравнению реакции  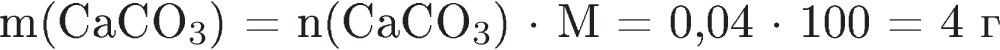 . .
Ответ: 4 г. |
|
| Ответ правильный и полный, включает все названные выше элементы | 4 |
| Правильно записаны три первых элемента ответа | 3 |
| Правильно записаны два первых элемента ответа | 2 |
| Правильно записан один элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 4 |







 2Cu + O2 = 2CuO
2Cu + O2 = 2CuO

















