Просмотр содержимого документа
«Константа растворимости»
Ерігіштік константасы
Күшті электролиттердің қанық ерітіндісіндегі тепе-теңдік оқып – білу, осы ерітіндіде тұнбаның түзілу немесе еру жағдайларын анықтауға мүмкіндік береді. Ионды кристаллды торлары бар электролиттердің кристаллдары ерігенде молекулалар емес иондар өтеді. Тұнбасы бар қандайда бір тұздың қаныққан ерітіндісінде (мысалы: СаСО3) мынандай тепе-теңдік орнайды.
Са2+ + СО32- ↔ Са2+ + СО32- қатты тұздың байланысқан иондары ерітіндідегі бос иондар.
Иондардың қатты фазадан сұйық фазаға өтуі тек бетінен ғана жүреді және заттың мөлшеріне байланысты емес. Ерітіндідегі бірлік уақытта беттен өткен грамм-иондар санын κ деп белгілейік. Бұл шама иондардың ерітіндіге өту жылдамдығын көрсетеді, яғни υ1 = κ1 шамасы заттың табиғатына және температураға ғана тәуелді.
Кері процесс – иондардың ерітіндіден тұнбаға өтуі – олардың ерітіндідегі концентрациясына пропорционал. Бұл процестің жылдамдығы былай өрнектеледі:
υ = κ2[Ca2+][CO32-]
мұндағы κ2 – пропорционалдық коэффициенті. Бұл шама Са2+ және СО32- концентрациялары бірге тең болғанда ерітіндідегі иондардың тұнбаның бірлік бетіне өту жылдамдығына тең.
Тепе-теңдік орнағанда:
υ1 = υ2 және κ1 = κ2[Ca2+][CO32-]
κ1 – мәнін теңдеудің сол жағына ауыстырып мынаны аламыз:
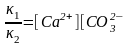 ]
]
Бұл теңдіктен қанық ерітіндідегі иондардың концентрацияларының көбейтіндісі тұрақты шама екені көрінеді. Бұл шама ерігіштік константасы деп аталып, Кs деп белгіленеді:
Кs(СаСО3) = [Ca2+] [CO32-]
Ерігіштік константасы қатты электролиттің белгілі бір температурадағы ерігіштігін сипаттайды. Екі біртипті тұздардың қайсысының ерігіштік константасы аз болса, соның ерігіштігі де аз болады.
Кs формуласы бойынша есептеулер жүргізе тек мынандай жағдайларда ғана дұрыс болады:
Тұздардың ерігіштігі өте аз болғанда;
Ерітіндіде бөгде тұздар болмаған жағдайда;
Қанық ерітіндідегі иондардың концентрацияларын өзгерте отырып тепе-теңдікті бұзуға және электролитті тұнбаға түсіруге немесе ерітуге болады.
Ерітіндіге аттас иондар енгізе отырып, иондардың концентрациясын арттыру арқылы тұнбаға түсіреді.
а) Кальций карбонатының қаныққан ерітіндісіне натрий карбонатының ерітіндісін қосса ерітіндіден карбонат иондарының концентрациясы артып, тепе-теңдік кальций карбонатының тұнба түзілу бағытына қарай ығысады..
Иондардың концентрациясын оларды аз диссоциацияланатын зат молекуласына байлау арқылы азайтып, тұнбаны ерітеді.
б) Тұнбасы бар кальций карбонатының қанық ерітіндісіне тұз қышқылыны қосса иондар арасында мынандай реакция жүреді:
СО32- + 2Н+ ↔ Н2СО3
Осылайша ерітіндідегі СО32- иондарының концентарциясы азаяды. Бұл тепе-теңдіктің тұнбаның еру есебінен жаңа СО32- иондарының түзілу бағытына ығысуын тудырады. Нашар еритін қосылыстар
ВаСО32-↓ + Na2SO4 ↔ BaSO4↓ + Na2CO3
Бұндай жүйеде тепе-теңдік ерігіштік константасы аз заттың түзілу бағытына қарай ығысады.






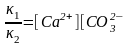 ]
]


















