Тема урока: Кислород. Физические свойства. Получение. Оксиды. Химические свойства кислорода.
Цель: Познакомить учащихся с элементом кислородом в свете ПСХЭ. Дать характеристику физическим и химическим свойствам кислорода. Рассмотреть основные способы получения и применение кислорода.
А) образовательная: обеспечить усвоение учащимися понятий: “кислород – химический элемент”, “кислород – простое вещество”, познакомить нахождением кислорода в природе, с физическими свойствами кислорода, методами получения кислорода в промышленности и в лаборатории и способами собирания его.
Б) воспитательная: стремление добиваться наилучших результатов, воспитание дисциплинированности.
В) развивающая: развитие умений учебного труда (умение работать в должном темпе – читать, писать); развитие умений наблюдения (умение наблюдать за демонстрационными опытами, делать выводы); развитие познавательных умений (формировать умение выделять главное, вести конспект, наблюдать, делать выводы, находить проблему и её решать); развитие мышления (развитие аналитического мышления – формирование умения выделять существенные признаки и свойства веществ), (развитие абстрактного мышления – выделять общие и существенные признаки, развитие умений применять знания на практике).
Оборудование: прибор для получения газов, лучинка, перманганат калия, спички, спиртовка, железные ложечки, химические стаканы, медная проволока, сера, фосфор,уголь.
Тип урока: Урок изучения нового материала.
Ход урока:
1. Организационный момент (его задача – подготовить учащихся к работе на уроке). Педагог и ученики приветствуют друг друга, в журнале отмечаются отсутствующие, затем учитель проверяет, готовы ли ребята к занятию.
2. Подготовка учащихся к активному и сознательному усвоению материала. Учитель демонстрирует на доске стихотворение:
Есть в природе нашей
Бесцветный, чудный газ.
Как он называется,
Узнаете сейчас.
Содержится он в воздухе,
В воде, камнях, везде,
Им дышат все на свете,
И рыбы в том числе.
Учащиеся зачитывают данное стихотворение и называют тему урока “кислород” и записывают её в рабочие тетради.
Далее на доске записывается план урока.
Кислород в природе.
Кислород – химический элемент.
Кислород – простое вещество.
Получение кислорода.
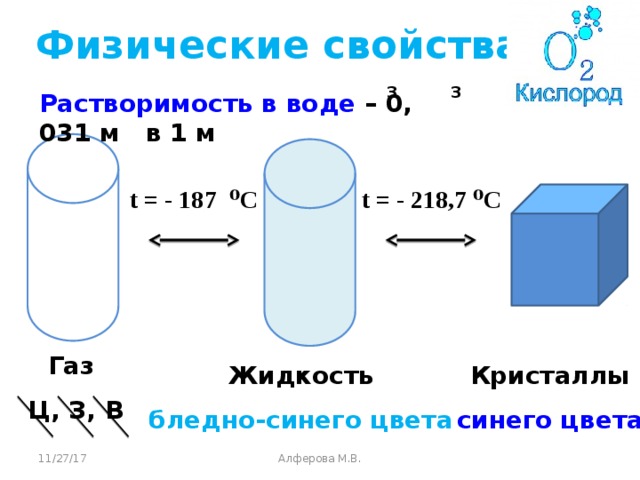
Физические свойства кислорода.
Химические свойства кислорода.
Применение кислорода.
Учитель предлагает записать план урока в рабочие тетради.
Целеполагание учащимися после записи плана урока.
3. Этап усвоения новых знаний.
Учитель: переходим к изучению первого вопроса плана
Это знают все на свете:
Кислород нужен планете.
Это знают даже дети:
Без него не жить на свете.
И животные, и люди –
Все вдыхают кислород.
Без него и у растений
Фотосинтез не идет.
(Объясните смысл стихотворения, изучив материал учебника нахождение кислорода в природе стр. 72)
Учащиеся работают с материалом учебника и рассказывают о нахождении кислорода в природе.
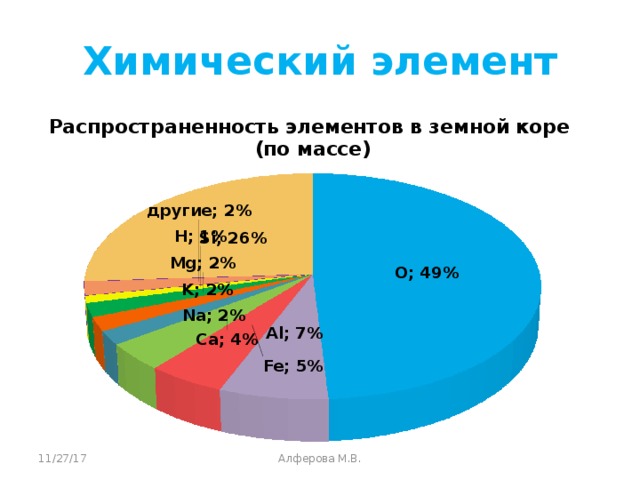
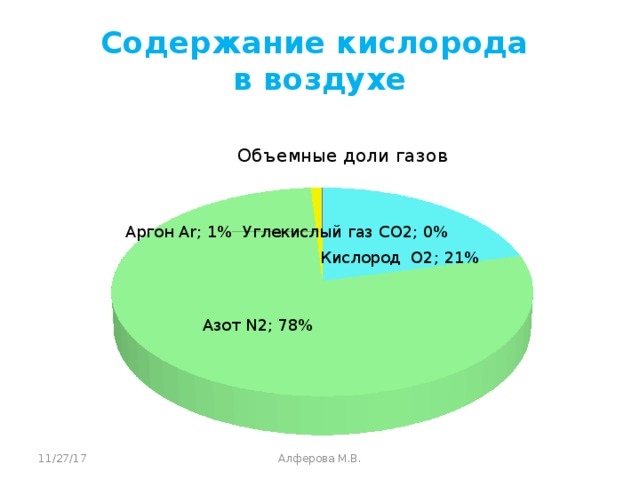
Учитель дополняет ответы учащихся. Кислород самый распространённый элемент в земной коре. Воздух содержит 1/5 кислорода по объему. Он входит в состав всех окружающих нас веществ. Кислород входит в состав основного компонента Земли – воды. Также он входит в состав органических веществ жиров, белков и углеводов.
Учитель: Обратимся к истории. В 1774 году известный английский учёный Дж.Пристли при накаливании оксида ртути (II) получил «воздух», который при поднесении свечи делал ее пламя ослепительно ярким.
Мы узнали, как был получен кислород, а сейчас обратимся к периодической системе, где кислород как химический элемент нашёл себе приют. Давайте дадим кислороду характеристику как химическому элементу. Учащиеся дают характеристику.
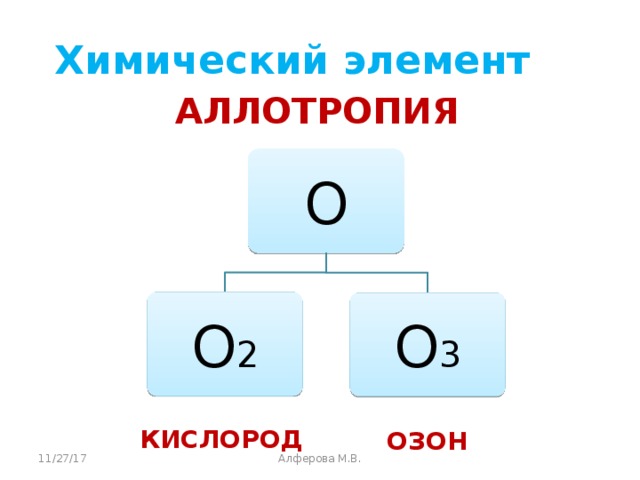
Учитель: Кислород образует соединения с большинством количеством химических элементов: Например: соединения кислорода с металлами и неметаллами называются оксидами: К2О (оксид калия), CaО (оксид кальция);с неметаллами он также образует соединения: SO2 (оксид серы (IV)), CO2 (оксид углерода (IV)). Во всех соединениях кислород проявляет валентность равную 2.
Учитель: Разберём кислород – как простое вещество. Охарактеризуете данную формулу.
Учащиеся: отмечают, что молекула кислорода двухатомная, Mr (О2) = 32 и одновременно заполняют таблицу сравнения химического элемента и простого вещества кислорода.
Водород как простое вещество и как химический элемент.
| Параметры сравнения | Кислород – химический элемент | Кислород – простое вещество |
| Химическая формула | | |
| Относительная атомная или молекулярная масса | | |
| Свойства | | |
(Работа осуществляется в статистических парах) а затем, самоконтроль.
Учитель: Внимательно выслушайте предложения и определите, в каком из них речь идёт о химическом элементе, а в каком о простом веществе.
1. Кислород входит в состав воды. 2. Кислород поддерживает горение. 3 . Кислород вступает в реакции с металлами. 4. В земной коре кислорода содержится 49 %. 5.Валентность кислорода равна 2.
Учащиеся работают устно, отвечают на вопрос и делают выводы, чем отличается простое вещество и химический элемент.
Учитель: А из чего получают кислород? Учащиеся отвечают на него.
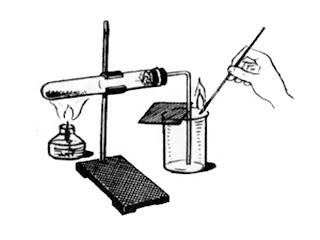
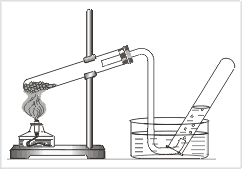
Учитель: Да, верно, воздух – самый доступный источник кислорода. В промышленности действительно кислород получают из воздуха. Давайте рассмотрим способы получения кислорода в лаборатории:
2KMnO4=K2MnO4+MnO2+O2
2KClO3=2KCl+ 3O2
2H2O2=2H2O+O2
2HgO=2Hg+O2
Как вы считаете, какой из способов более безопасный и простой?
Давайте получим кислород, используя наиболее удобный способ.
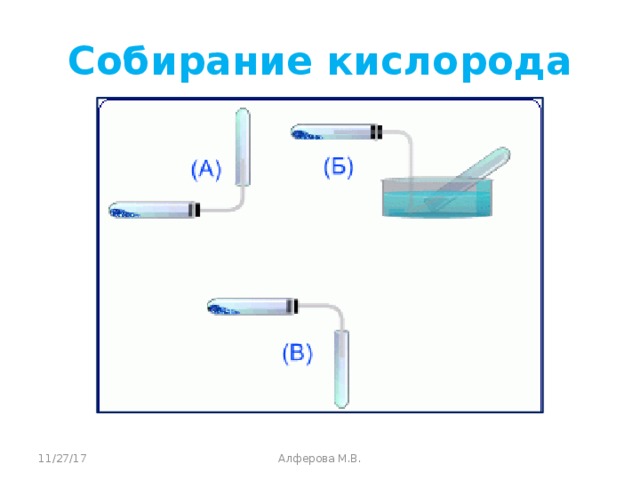
Демонстрация опыта, с поднесением затухающей лучинки и последующим ее вспыхиванием
А сейчас рассмотрим физические свойства кислорода. Какие физические свойства мы наблюдали в ходе демонстрации опыта. Учащиеся отвечают на вопрос и записывают физические свойства кислорода в тетрадь, учитель при необходимости дополняет ответ. (с.77 учебника)
Учитель: Рассмотрим химические свойства кислорода. (с.77-79)
Кислород при температуре реагирует со многими веществами, при этом выделяется теплота и свет. Такие реакции называют реакциями горения. Один из учеников записывает первую реакцию на доске, все остальные в тетрадь, следующую реакцию записывает на доске другой ученик, а остальные ученики в тетрадь и т.д.
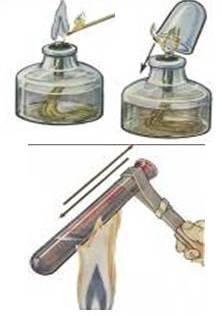
1) Горение серы в кислороде. Учитель проводит опыты в вытяжном шкафу.
2) Горение фосфора в кислороде.
3) Горение угля в кислороде.
4) Окисление меди. Окисление - это более общее понятие, чем понятие горение.
В большинстве случаев при взаимодействии веществ с кислородом образуются оксиды.
Дайте определение оксидам. Ученики дают определение, оксидам опираясь на записанные в тетрадях реакции.
Учитель: Познакомимся с применением кислорода. &24 с.81
Все области применения кислорода основаны в основном на физических свойствах кислорода. Главными потребителями кислорода, конечно, являются энергетика, металлургия и химическая промышленность.
Электрические и тепловые станции, работающие на угле, нефти или природном газе используют атмосферный кислород для сжигания топлива. Если даже небольшой автомобиль является настоящим "пожирателем" кислорода (как мы выяснили в предыдущей главе), то гигантские тепловые и электрические станции расходуют кислорода неизмеримо больше. До сих пор они вырабатывают около 80 % всего электричества в нашей стране и только остальные 20 % электроэнергии дают гидростанции и атомные станции, не расходующие атмосферного кислорода. Для металлургической и химической промышленности нужен уже не атмосферный, а чистый кислород. Ежегодно во всем мире получают свыше 80 млн. тонн кислорода. Для его производства требуется огромное количество электроэнергии, получение которой, как мы уже знаем, тоже связано с расходованием кислорода.
В медицине кислород используют для поддержания жизни больных с затрудненным дыханием и для лечения некоторых заболеваний. Однако чистым кислородом при нормальном давлении долго дышать нельзя – это опасно для здоровья.
Вне земной атмосферы человек вынужден брать с собой запас кислорода. Мы уже говорили о его применении на подводных лодках. Точно так же полученный искусственно кислород используют для дыхания в любой чуждой среде, где приходится работать людям: в авиации при полетах на больших высотах, в пилотируемых космических аппаратах, при восхождении на высокие горные вершины, в экипировке пожарных, которым часто приходится действовать в задымленной и ядовитой атмосфере и т.д.
4. Этап закрепления новых знаний.
Контрольный тест.
Задание. Необходимо выбрать правильные утверждения. В рабочей тетради в столбик проставьте цифры с 1 по 12. Если вы согласны с утверждением, ставьте напротив цифры плюс, если нет, то минус. Учитель зачитывает утверждения.
Кислород – самый распространённый элемент в земной коре.
Кислород – самый распространённый газ на Земле.
Кислород поглощается в результате фотосинтеза.
Кислород вступает в реакцию с водой.
Валентность кислорода равна 2.
Формула простого вещества кислорода равна О2.
Газ кислород обладает наименьшей среди всех веществ молекулярной массой.
Кислород хорошо растворим в воде.
Водород в смеси с кислородом взрывоопасен.
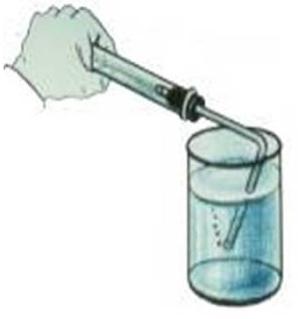
Чтобы собрать кислород, пробирку надо держать отверстием вверх.
Кислород поддерживает горение.
Соединения кислорода с металлами и неметаллами называются оксидами.
Учитель зачитывает ответы, учащиеся проверяют и оценивают: без единой ошибки – “5”, 1 ошибка – “4”, 2 ошибки – “3”, 3 и более ошибок – неудовлетворительно.
5.Этап подведения итогов. Оценивание работы учащихся на уроке
6. Этап информации учащимся о домашнем задании и инструкции по его выполнению
&22, упр.2-7, &26, упр.1-3
Самостоятельная работа на следующий урок.
Цель: Определение степени усвоения материала данного урока.
Вариант №1
1. Кислород реагирует с обоими веществами пары :
А)H2O и Са Б)Na и S В) NaCl и Сu
2. Допишите уравнения реакций, расставьте коэффициенты, назовите продукты реакций
А) O2+H2=
Б) Сu+O2=
3. Напишите реакцию взаимодействия кислорода с цинком, расставьте коэффициенты, назовите продукты реакции.
4. Рассчитайте объем кислорода, который необходим для взаимодействия с 2 моль кальция.
Вариант №2
1. Кислород реагирует с обоими веществами пары:
А) C и Zn Б) P и Н2О В) О2 и СО2
2. Допишите уравнения реакций, расставьте коэффициенты, назовите продукты реакций
А) Ca+ O2=
Б) Mg+O2=
3. Напишите реакцию взаимодействия лития с кислородом, расставьте коэффициенты, назовите продукты реакции.
4. Рассчитайте объем кислорода, который понадобиться для взаимодействия с 4 моль цинка.
Вариант №3
1. Кислород реагирует с обоими веществами пары:
А) Н2 и Fe Б) NaCl и Ba В) H2O и Al
2. Допишите уравнения реакций, расставьте коэффициенты, назовите продукты реакций
А) Na +O2=
Б) Fe+O2=
3. Напишите реакцию взаимодействия алюминия с кислородом, расставьте коэффициенты, назовите продукты реакции.
4. Рассчитайте объем кислорода, который понадобиться для взаимодействия с 6 моль магния.