Конспект урока в 9 классе по химии «Кремний и его соединения»
Подготовила и провела Шматко Ольга Николаевна,
учитель химии МБОУ «Дмитриевская СОШ»
Цели урока:
1) Создание условий для овладения обучающимися знаниями о кремнии, его соединениях, их свойствах, способах их получения, распространением в природе, их применении.
2) Продолжить формирование умений обращаться с лабораторным оборудованием при выполнении опытов, работать с учебником, ставить цели, выделять главное, планировать свою деятельность при работе в группе, осуществлять самоконтроль, подводить итоги;
3) Воспитывать эмоционально–ценностное отношение к миру, умение работать в коллективе.
Планируемые результаты:
Предметные умения:
- уметь давать характеристику химическому элементу кремнию по его положению в периодической системе химических элементов Д.И.Менделеева;
- уметь составлять схему строения атома кремния;
- знать физические и химические свойства кремния и его соединений;
- уметь составлять химические формулы соединений кремния;
- уметь записывать уравнения, подтверждающие химические свойства кремния и его соединений;
– уметь определять закономерность между составом, строением, свойствами и применением веществ.
Личностные УУД:
- устанавливать связь между целью учебной деятельности и ее мотивом;
- определять общие для всех правила поведения;
- определять правила работы в группах;
- оценивать усваиваемое содержание (исходя из личностных ценностей);
- устанавливать связь между целью деятельности и ее результатом.
Регулятивные УУД:
- определять и формулировать цель деятельности на уроке;
- проговаривать последовательность действий на уроке; работать по плану, алгоритму;
- высказывать свое предположение на основе учебного материала;
- отличать верно выполненное задание от неверного;
- осуществлять самоконтроль;
- совместно с учителем и одноклассниками давать оценку деятельности на уроке.
Познавательные УУД:
- ориентироваться в учебнике, тетради;
- ориентироваться в своей системе знаний (определять границы знания/незнания);
- находить ответы на вопросы в тексте, таблицах, слайдах;
- проводить химический опыт с веществами, наблюдать за их превращениями;
- проводить анализ учебного материала;
- проводить классификацию, указывая на основание классификации;
- проводить сравнение, объясняя критерии сравнения.
Коммуникативные УУД:
- слушать и понимать речь других;
- уметь с достаточной полнотой и точностью выражать свои мысли;
- владеть диалогической формой речи в соответствии с грамматическими и синтаксическими нормами родного языка.
УМК:
Габриелян О.С. Химия. 9 класс: учебник для общеобразовательных учреждений/ О.С. Габриелян. – М.: Дрофа, 2016.
Основные термины, понятия:
кремний, кремнезём, силикаты, оксид кремния, кремниевая кислота
Формы работы:
фронтальная, групповая, парная, индивидуальная
Средства обучения:
периодическая система химических элементов Д.И. Менделеева, таблица раствоимости, лист фронтальной работы, коллекция природных камней, «Природные силикаты», «Стекло и изделия из стекла», лабораторное оборудование, химические реактивы: HCl (р-р), Na2CO3 (р-р), раствор силикатного клея; штативы с пробирками; образцы природных соединений кремния (кварц и др.), образцы изделий из стекла, фаянса, фарфора, керамики.
Ход урока:
1.Организационный этап.
- Здравствуйте! Меня зовут Ольга Николаевна. Я надеюсь, что наш урок пройдет интересно и плодотворно.
2. Мотивационно-ориентационный этап.
Хочу вам предложить изучить последний элемент неорганической химии, значимость которого очень велика, т.к. по распространенности на Земле он второй после кислорода. Благодаря его соединениям стебли растений стоят, как штыки; листья осоки режут, как ножи; стерня на скошенном поле колет, как иголки; чешуя рыб, крылья бабочек, перья птиц, шерсть животных очень прочны; волосы и ногти гладкие и прочные.
Но сначала давайте выполним задание. На каждой парте лежат конверты. Возьмите конверт №1. Выполните задание и запишите на доске букву, соответствующую правильному ответу (парная работа)
| Буква №1 Вопрос: Максимально возможную степень окисления ХЛОР проявляет в соединении с формулой:
з) NaCl и) KClO3 к) Cl2O7 л) KClO
|
| Буква №2 Вопрос: Фосфат натрия взаимодействует с раствором: о) K2SO4 п) NaCl р) AgNO3 с) HCl
Решение : ___________________________________________________________________ ____________________________________________________________________________ ____________________________________________________________________________
|
| Буква №3 Вопрос: Необратимая химическая реакция произойдет при сливании растворов веществ, формулы которых:
в) ZnSO4 и HCl г) NaOH и KCl д) Na2SO4 и KOH е) CaCl2 и Na2CO3
Решение: ___________________________________________________________________ ____________________________________________________________________________ ____________________________________________________________________________
|
| Буква №4 Вопрос: Ряд чисел 2е,8е,7е соответствует строению электронной оболочки атома: м) хлора н) азота о) серы п) фтора    
|
| Буква №5 Вопрос: Степень окисления азота равна +5 в соединении с формулой:
л) NH3 м) Li3N н) Al(NO3)3 о) HNO2
|
| Буква №6 Вопрос: Ионы SO42- образуются при диссоциации (распаде на ионы) вещества:
ж) сульфида натрия з) сульфита натрия и) сульфата натрия к) гидросульфата натрия
Решение: ___________________________________________________________________ ____________________________________________________________________________ ____________________________________________________________________________
|
| Буква №7 Вопрос: Молекула озона образована за счет связи: з) ионной и) ковалентной полярной й) ковалентной неполярной к) металлической
|
Итак, тема урока «Кремний», а так как сам по себе этот элемент в природе на существует, он образует соединения: оксид кремния, кремниевую кислоту и соли силикаты, поэтому мы с вами познакомимся с его соединениями (записывают тему в тетрадях). Попробуйте определить цель урока (познакомиться с химическими и физическими свойствами кремния и его соединений, способами их получения, распространением в природе, их применением).
3. Организационно-деятельностный этап.
Работать будем в соответствии с Листами фронтальной работы
1) Характеристика химического элемента
Давайте попробуем охарактеризовать химический элемент по его положению в ПС: Кремний – элемент 4А группы, III периода, порядковый номер 14, А=28, 14 протонов и 14 нейтронов, 14 электронов (работа у доски и в тетрадях). А теперь изобразите схему строения атома: 2е,8е,4е (работа у доски и в тетрадях).
2) Нахождение в природе.
- Уже в глубокой древности люди широко использовали в своём быту соединения кремния. Вспомните древних людей. Из чего были изготовлены их орудия труда? Но сам кремний впервые был получен в 1824 г. Шведским химиком И.Я. Берцелиусом. Латинское название «силициум» берёт своё начало от латинского «силекс» - камень. С греческого языка «кремнос» - утёс, скала.
- Земная кора на одну четверть состоит из соединений кремния. Наиболее распространённым является оксид кремния (IV) – кремнезём. В природе он образует минерал кварц и многие другие разновидности: горный хрусталь, аметист, агат, опал, яшма, халцедон, сердолик (полудрагоценные камни), а также обычный кварцевый песок. Именно кремень положил начало каменному веку. Причин этому две: доступность и распространённость, а также способность образовывать на сколе острые режущие края. Второй тип природных соединений кремния – силикаты. Самые распространённые алюмосиликаты: гранит, различные виды глин, слюды. Не содержащий алюминия силикат – асбест (из него изготавливают огнестойкие ткани). Оксид кремния (IV) необходим и растениям, и животным. Он придаёт прочность стеблям растений и покровам животных (камыши твёрдо стоят, осока режет, как лезвие, чешуя рыб, панцири насекомых, крылья бабочек, перья птиц, шерсть животных содержат оксид кремния (IV). Кремний придаёт гладкость и прочность костям человека, входит в состав низших живых организмов – диатомовых водорослей и радиолярий (образует их скелеты).
3) Физические свойства
- Вы обратили внимание, что когда мы говорим о содержании в природных условиях элемента кремния, то упоминаем только его соединения, но не простое вещество.
Кремний в свободном виде в природе не встречается в отличие от углерода (алмаз, графит, аморфный С и т.д.)
кремний – неметалл, существует в кристаллическом и аморфном виде.
Кристаллический кремний – серовато-стального цвета с металлическим блеском, твёрдый (7 баллов по шкале Мооса), но хрупкий, малореакционноспособный; полупроводник, (с повышением температуры электропроводность повышается).
Такие свойства обусловлены строением кристаллов, аналогичным структуре алмаза.
Физические константы: g = 2,33 г/см3; t пл.= 1415 0С; t кип.= 3500 0С
Аморфный кремний представляет собой белый порошок.
4) Получение кремния
- Способы получения кремния основаны в основном на восстановлении оксида кремния (IV) сильными восстановителями – активными металлами (Mg, Al) и углеродом.
Лабораторный способ:
SiO2 + 2Mg = 2MgO + Si
Промышленный способ:
1900oC
SiO2 + 2C = 2CO + Si
SiCi4 + 2Zn = 2ZnCi2 + Si
5) Химические свойства
а) кремний - восстановитель
Все реакции протекают при нагревании!
Si + O2 = SiO2 (оксид кремния (IV))
Si + 2Cl2 = SiCl4 (хлорид кремния)
Si + 2S = SiS2 (сульфид кремния)
20000C
Si + C = Si+4C-4
(карбид кремния или карборунд, по твёрдости близок к алмазу)
Si + 2H2O(пар) = SiO2 + H2
Si + 2NaOH(конц.) + H2O = Na2SiO3 + 2H2
б) кремний – окислитель
Si + 2Ca = Ca2Si (силицид кальция)
Вывод: свойства кремния и углерода похожи. Оба неметалла взаимодействуют с кислородом, галогенами, серой, металлами. Но в отличие от углерода кремний напрямую не соединяется с водородом.
6) Соединения кремния
SiO2 в природе:
-кварц
- кварцевый песок
полудрагоценные камни:
- горный хрусталь,
- аметист,
- агат,
- опал,
- яшма,
- халцедон,
- сердолик
Свойства кремнезёма
1) + щелочь
2) + основной оксид
3) + соль
Кремниевая кислота и её соли (слайд 18)
-кремниевая кислота H2SiO3
-единственная нерастворимая неорганическая кислота
- двухосновная,
- слабая H2SiO3
При высыхании образует силикагель, используемый в качестве адсорбента.
Получить кремниевую кислоту можно только из её солей.
Проведение лабораторного опыта и составление уравнения реакции получения кремниевой кислоты (самостоятельно, на доске)
Na2SiO3 + 2HCl = 2NaCl + H2SiO3
SiO32- + 2Н+ = H2SiO3
Соли кремниевой кислоты называют силикатами
Их можно получить сплавлением оксида кремния с оксидами металлов или карбонатами:
SiO2 + CaO = CaSiO3
SiO2 + CaCO3 = CaSiO3 + CO2
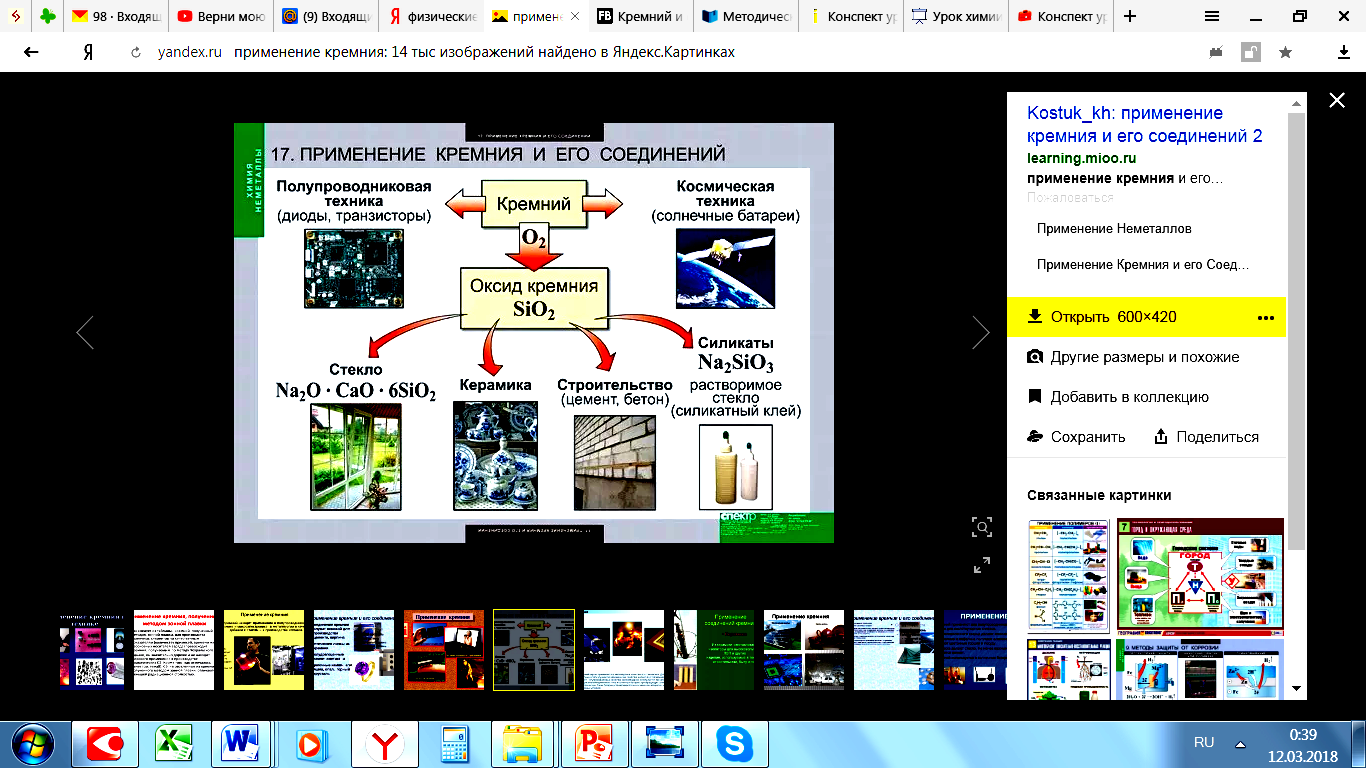
7) Применение соединений кремния в народном хозяйстве
Кремний широко используется в электронике как полупроводник. Добавки кремния к сплавам повышают их коррозионную стойкость. Силикаты, алюмосиликаты и кремнезем – основное сырье для производства стекла и керамики, а также для строительной промышленности.
(Для получения полупроводников. Кислотоупорных сплавов. Стекло, цемент, бетон, железобетон, кирпич, фарфор, фаянс.)
4. Оценочно – рефлексивный этап.
Работа с учебником.
Упр.2 с.258
Упр.4б с. 258
-Достигли ли мы цели? Вспомните, какие цели мы ставили в начале урока.
- Работа в парах. Составьте синквейн на тему «Кремний»
На первой строчке запишите одно слово – существительное
На второй – два прилагательных
На третьей – три глагола
На четвертой – целая фраза, предложение, состоящее из нескольких слов в контексте с темой
5. Итоги урока









 i
i