| Цели урока: На основе универсального понятия " гидролиз” показать единство мира органических и неорганических веществ. Используя интеграционный потенциал этого понятия раскрыть внутри – и межпредметные связи химии, дать яркое представление о практической значении процессов гидролиза в живой и неживой природе и в жизни общества. Ознакомить учащихся с сущностью гидролиза солей и научить составлять уравнения гидролиза различных солей. Оборудование и реактивы: Растворы HCI, HNO3, NaOH, Na2CO3, AICI3, KNO3, FeCI3; кусочек CaC2; пробирки, штативы, растворы индикаторов и наборы универсальной индикаторной бумаги. Форма урока. Лекция. Ход урока 1. Организационный момент. 2. Объяснение нового материла (в ходе объяснения материла, идет демонстрация опытов). Гидролиз – реакция обменного разложения веществ водой. Гидролизу подвергаются: органические и неорганические вещества. Реакции гидролиза могут быть: обратимые и необратимые. Гидролиз органических веществ: А) гидролиз галогеналканов: C2H5CI + H2O — C2H5OH + HCI
Б) гидролиз сложных эфиров: CH3COOC2H5 + H2O — CH3COOH + C2H5OH
В) гидролиз жиров: 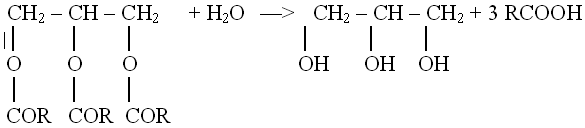
Г) гидролиз дисахаридов: C12H22O11 + H2O —C6H12O6 + C6H12O6
Д) гидролиз белков: H2N – CH2 – CO – NH – CH2 – CO – NH – CH2 – COOH + H2O— 3H2N – CH2COOH Е) гидролиз полисахаридов: (C6H10O5)n + H2O — n C6H12O6 Работа обучающихся по листу заданий 2. Гидролиз бинарных неорганических веществ: А) гидролиз карбидов: CaC2 + 2H2O — Ca(OH)2 + C2H2
Б) гидролиз галогенидов: SiCI4 + 3 H2O — H2SiO4 + 4 HCI
В) гидролиз гидридов: NaH + H2O —NaOH + H2
Г) гидролиз фосфидов: Mq3P2 + 6H2O —3 Mq(OH)2 + 2PH3
Д) гидролиз сульфидов: AI2S3 + 6H2O —2AI(OH)3 + 3 H2S. При растворении некоторых солей в воде самопроизвольно протекают не только диссоциация их на ионы и гидратация ионов, но и процесс гидролиза солей. Гидролиз солей – это протолитический процесс взаимодействия ионов солей с молекулами воды, в результате которого образуются малодиссоциирующие молекулы или ионы. С позиции протолитической теории гидролиз ионов солей заключается в переходе протона от молекулы воды к аниону соли или катиону соли (с учетом его гидратации) к молекуле воды. Таким образом, в зависимости от природы иона вода выступает либо как кислота, либо как основание, а ионы соли при этом являются соответственно сопряженным основанием или сопряженной кислотой.( в водном растворе соли появляется избыток свободных H+ илиOH– и раствор соли становится кислотным или щелочным. Возможны три варианта гидролиза ионов солей: гидролиз по аниону – соли, содержащий катион сильного основания и анион слабой кислоты; гидролиз по катиону – соли, содержащие катион слабого основания и анион сильной кислоты; гидролиз и по катиону, и по аниону – соли, содержащие катион слабого основания и анион слабой кислоты. Рассмотрим случаи гидролиза Гидролиз по аниону. Соли, содержащие анионы слабых кислот, например ацетаты, цианиды, карбонаты, сульфиды, взаимодействуют с водой, так как эти анионы являются сопряженными основаниями, способными конкурировать с водой за протон, связывая его в слабую кислоту: | A-+ H2O — AH + OH– pH 7 |
| | CH3COO– + H2O —CH3COOH + OH– | CN– + H2O — HCN + OH- | | CO32– + H2O — HCO3– + OH– | HCO3– + H2O —H2 CO3 + OH- | | I ступень | II ступень | При этом взаимодействии возрастает концентрация ионов OH-, и поэтому pH водных растворов солей, гидролизующихся по аниону, всегда находится в щелочной области pH 7. Гидролиз многозарядных анионов слабых кислот в основном протекает по I ступени. Работа обучающихся по листу заданий Для характеристики состояния равновесия при гидролизе солей используют константу гидролиза Кг, которая при гидролизе по аниону равна:  где К H2O – ионное произведение воды; Ка – константа диссоциации слабой кислоты НА. В соответствии с принципом Ле – Шателье смещения химического равновесия для подавления гидролиза, протекающего по аниону, к раствору соли следует добавить щелочь как поставщика иона ОН-, образующегося при гидролизе соли по аниону (ион, одноименный продукту гидролиза). Гидролиз по катиону. Соли, содержащие катионы слабых оснований, например катионы аммония, алюминия, железа, цинка, взаимодействуют с водой, так как являются сопряженными кислотами, способными отдавать протон молекулам воды или связывать ионы ОН– молекул воды с образованием слабого основания: Kt+ + H2O — KtOH + H+ pH NH4+ + H2O — NH3 + H3O+ Fe3+ + H2O — FeOH2+ + H+ ; I – ступень FeOH2+ + H2O — Fe(OH)+2 + H+ ; II – ступень Fe(OH)+2 + H2O —Fe(OH)3 + H+ III – ступень При этом взаимодействии возрастает концентрация ионов H+, и поэтому pH водных растворов солей, гидролизующихся по катиону, всегда находится в кислой области pH Для подавления гидролиза, протекающего по катиону, к раствору соли следует добавить кислоту как поставщика иона Н+, образующегося при гидролизе соли по катиону (ион, одноименный продукту гидролиза. Работа обучающихся по листу заданий Гидролиз по катиону и по аниону. В этом случае в реакции гидролитического взаимодействия с водой участвуют одновременно и катионы, и анионы, а реакция среды определяется природой сильного электролита. Если гидролиз по катиону и по аниону протекает в равной степени (кислота и основание – одинаково слабые электролиты), то раствор соли имеет нейтральную реакцию; например, водный раствор ацетата аммония NH4CH3COO имеет pH = 7,т.к.pKa (CH3COOH) = 4,76 и pKb(NH3*H2O) = 4,76. Если в растворе преобладает гидролиз по катиону (основание слабее кислоты), раствор такой соли имеет слабокислую реакцию (pH 4NO2 (pKa (HNO2) = 3,29) . Если в растворе преобладает гидролиз по аниону (кислота слабее основания), раствор такой соли имеет слабощелочную реакцию (pH 7) , например цианид аммония NH4СN (pKa (HСN) = 9,31) . Работа обучающихся по листу заданий Некоторые соли, гидролизующиеся по катиону и по аниону, например сульфиды или карбонаты алюминия, хрома, железа (III), гидролизуются полностью и необратимо, так как при взаимодействии их ионов с водой образуются малорастворимые основания и летучие кислоты, что способствует протеканию реакции до конца: AI2(CO3)3 + 3 H2O —2 AI(OH)3 + 3 CO2; Cr2S3 + 6 H2O —2 Cr(OH)3 + 3 H2S Механизм необратимого гидролиза В растворах двух солей, например сульфида натрия (Na2S) и хлорида алюминия (AICI3), взятых порознь, устанавливается равновесие: S2– + H2O — HS– + OH- AI3+ + H2O — AIOH2+ + H+ гидролиз ограничивается I стадией. При смешивании этих растворов, ионы Н+ и ОН– взаимно нейтрализуют друг друга, уход этих ионов из сферы реакции в виде малодиссоциированной воды смещает оба равновесия вправо и активизирует последующие ступени гидролиза: HS– + H2O — H2S + ОН– AIOH2+ + H2O — AI(OH)+2 + Н+ AI(OH)+2 + H2O — AI(OH)3 + Н+ , что в конечном счете приводит к образованию слабого основания и слабой кислоты. 2AICI3 + 3 Na2S + 6 H2O — 2 AI(OH)3 + 3 H2S + 6 NaCI Эту особенность гидролиза подобных солей следует обязательно учитывать при сливании сточных вод, чтобы избежать их вспенивания за счет образования CO2 или отравления окружающей среды сероводородом. Степень гидролиза (h) – количественная характеристика гидролиза. h = n / N * 100% , Степень гидролиза равна отношению числа гидролизованных молекул соли к общему числу растворенных молекул. зависит: А) температуры, Б) концентрации раствора, В) тип соли (природы основания, природы кислоты). Факторы, влияющие на степень гидролиза: Глубина протекания гидролиза солей в значительной степени зависит и от внешних факторов, в частности от температуры и концентрации раствора. При кипячении растворов гидролиз солей протекает значительно глубже, а охлаждение растворов, наоборот, уменьшает способность соли подвергаться гидролизу. Увеличение концентрации большинства солей в растворах также уменьшает гидролиз, а разбавление растворов заметно усиливает гидролиз солей. Гидролиз – процесс эндотермический, в большинстве обратимый. В соответствии с принципом смещения химического равновесия для подавления гидролиза– следует понизить температуру, увеличить концентрацию исходной соли, ввести в раствор один из продуктов гидролиза( кислоты – Н+ , щелочи – ОН-); для усиления гидролиза – следует повысить температуру, разбавить раствор, связывание какого – либо продукта гидролиза ( Н+ или ОН-) в молекулы слабого электролита H2O Значение гидролиза Гидролитические процессы вместе с процессами растворения играют важную роль в обмене веществ. С ними связано поддержание на определенном уровне кислотности крови и других физиологических жидкостей. Действие многих химиотерапевтических средств связано с их кислотно – основными свойствами и склонностью к гидролизу. Геохимические процессы. Химическая промышленность 3. Закрепление материала Работа обучающихся по листу заданий 4. Домашнее задание | 
























