9 класс химия дата проведения______________
Тема: АЛКЕНЫ
Цели урока:
формировать первоначальные представления о составе и строении ненасыщенных углеводородов на примере этилена
рассмотреть химические свойства этилена как представителя ненасыщенных углеводородов – алкенов
дать представление о качественной реакции на присуствие двойной связи в молекуле этилена
формировать умения составлять уравнения химических реакций и проводть математические расчеты на их основе при решении типичных задач
развивать интерес к предмету
Тип урока: комбинированный
Методы: словесно- наглядный
ХОД УРОКА:
1. Орг момент.
2. Проверка д/з
3. Актуализация опорных знаний.
а) Актуализация. Познакомились с алканами, т.е. соединениями только с 1 связями, насыщенными. Разобрали понятие гомологов, изомерии, хим. и физ. Свойства этих соединений.
б) Мотивация. Сегодня мы познакомимся с новым классом ненасыщенных ув. Разберем их состав и строении, выведем общую формулу, посмотрим какие из утверждений ля алканов характерны и для ненасыщ
4. Изучение нового материала.
Сообщение темы и целей урока:
строение молекулы этилена
физические и химические свойства
получение в промышленности
применение
Алкенами или олефинами, или этиленовыми углеводородами называются углеводороды, содержащие в молекуле одну двойную связь и имеющие общую формулу CnH2n.
Физические свойства
По физическим свойствам этиленовые углеводороды близки к алканам. При нормальных условиях углеводороды C2–C4 – газы, C5–C17 – жидкости, высшие представители – твердые вещества. Температура их плавления и кипения, а также плотность увеличиваются с ростом молекулярной массы. Все олефины легче воды, плохо растворимы в ней, однако растворимы в органических растворителях. Физические свойства некоторых алкенов представлены в таблице.
Химические свойства
Углеродные атомы в молекуле этилена находятся в состоянии sp2- гибридизации, т.е. в гибридизации участвуют одна s- и две p -орбитали.
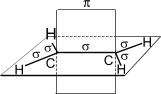
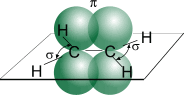
Схематическое изображение строения молекулы этилена
Галогенирование. Алкены при обычных условиях присоединяют галогены, приводя к дигалогенопроизводным алканов, содержащим атомы галогена у соседних углеродных атомов.
H2C=CH2 + Br2 BrCH2–CH2Br(1,2-дибромэтан)
Приведенная реакция - обесцвечивание алкеном бромной воды является качественной реакцией на двойную связь.
Гидрирование. Алкены легко присоединяют водород в присутствии катализаторов (Pt, Pd, Ni), образуя предельные углеводороды.
CH3–CH=CH2 + H2 ––Ni CH3–CH2–CH3(пропан)
Гидрогалогенирование. Этилен и его гомологи присоединяют галогеноводороды, приводя к галогенопроизводным углеводородов.
H2C=CH2 + HBr CH3–CH2Br(бромистый этил)
Присоединение галогеноводородов к пропилену и другим алкенам происходит в соответствии с правилом В.В.Марковникова (водород присоединяется к наиболее гидрогенизированному атому углерода при двойной связи).
| CH3−CH=CH2 + HCl CH3− | CH−CH3(2-хлорпропан)
I
Cl |
Гидратация. В присутствии минеральных кислот олефины присоединяют воду, образуя спирты.
|
|
| OH
I |
| CH3− | C=CH2(2-метилпропен-1) + H2O ––H+ CH3− | C−CH3(2-метилпропанол-2) |
|
| I
CH3 | I
CH3 |
Сульфатация (O- сульфирование). Взаимодействие алкенов с серной кислотой приводит к кислым эфирам серной кислоты.
| CH2=CH−CH3 + HO−SO2−OH CH3− | CH−O−SO2−OH(изопропилсерная кислота)
I
CH3 |
Как видно, направление реакций гидратации и сульфирования также определяется правилом Марковникова.
Окисление. Алкены легко окисляются. В зависимости от условий проведения реакции образуются различные продукты.
При сжигании на воздухе олефины дают углекислый газ и воду.
H2C=CH2 + 3O2 2CO2 + 2H2O
При окислении алкенов разбавленным раствором перманганата калия образуются двухатомные спирты – гликоли (реакция Е.Е.Вагнера). Реакция протекает на холоде.
| 3H2C=CH2 + 2KMnO4 + 4H2O 3 | CH2−CH2(этиленгликоль) + 2MnO2 + 2KOH
I I
OH OH |
В результате реакции наблюдается обесцвечивание раствора перманганата калия. Реакция Вагнера служит качественной пробой на двойную связь.
Полимеризация. Реакция полимеризации
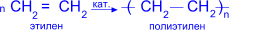
Получение
Основным промышленным источником получения первых четырех членов ряда алкенов (этилена, пропилена, бутиленов и пентиленов ) являются газы крекинга и пиролиза нефтепродуктов, а также газы коксования угля (этилен, пропилен).
Все более значительные количества алкенов получают дегидрогенизацией алканов при повышенной температуре с катализатором.
| CH3–CH2–CH2–CH3 ––300C,Cr2O3– | |
| | CH2=CH–CH2–CH3(бутен-1) + H2
CH3–CH=CH–CH3(бутен-2) + H2 |
В лабораторной практике наиболее распространенным способом получения алкенов является дегидратация (отщепление воды) спиртов при нагревании с водоотнимающими средствами (концентрированная серная или фосфорная кислоты) или при пропускании паров спирта над катализатором (окись алюминия).
CH3–CH2–OH(этанол) ––t,Al2O3 CH2=CH2 + H2O
Порядок дегидратации вторичных и третичных спиртов определяется правилом А.М.Зайцева: при образовании воды атом водорода отщепляется от наименее гидрогенизированного соседнего атома углерода, т.е. с наименьшим количеством водородных атомов.
| CH3– | CH–C
I I | H–CH3(бутанол-2) ® CH3–CH=CH–CH3(бутен-2) + H2O |
|
| OH H |
|
Часто алкены получают реакцией дегидрогалогенирования (отщепление галогеноводорода) из галогенопроизводных при действии спиртового раствора щелочи. Направление данной реакции также соответствует правилу Зайцева.
| CH3–CH–CH2–CH3(2-бромбутан) + NaOH(спирт p-p) ® CH3–CH=CH–CH3 + NaBr + H2O
I
Br |
Реакция дегалогенирования (отщепление двух атомов галогена от соседних атомов углерода) при нагревании дигалогенидов с активными металлами также приводит к алкенам.
| CH2–CH –CH3(1,2-дибромпропан) + Mg ® CH2=CH–CH3(пропен) + MgBr2
I I
Br Br |
Применение Алкены широко используются в промышленности в качестве исходных веществ для получения растворителей (спирты, дихлорэтан, эфиры гликолей и пр.), полимеров (полиэтилен, поливинилхлорид, полиизобутилен и др.), а также многих других важнейших продуктов.
5. Закрепление
6. Подведение итогов урока:
7. Домашнее задание. §








 Схематическое изображение строения молекулы этилена
Галогенирование. Алкены при обычных условиях присоединяют галогены, приводя к дигалогенопроизводным алканов, содержащим атомы галогена у соседних углеродных атомов.
Схематическое изображение строения молекулы этилена
Галогенирование. Алкены при обычных условиях присоединяют галогены, приводя к дигалогенопроизводным алканов, содержащим атомы галогена у соседних углеродных атомов.


















