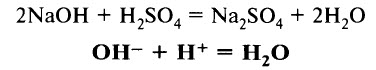ТЕМА: КИСЛОТЫ
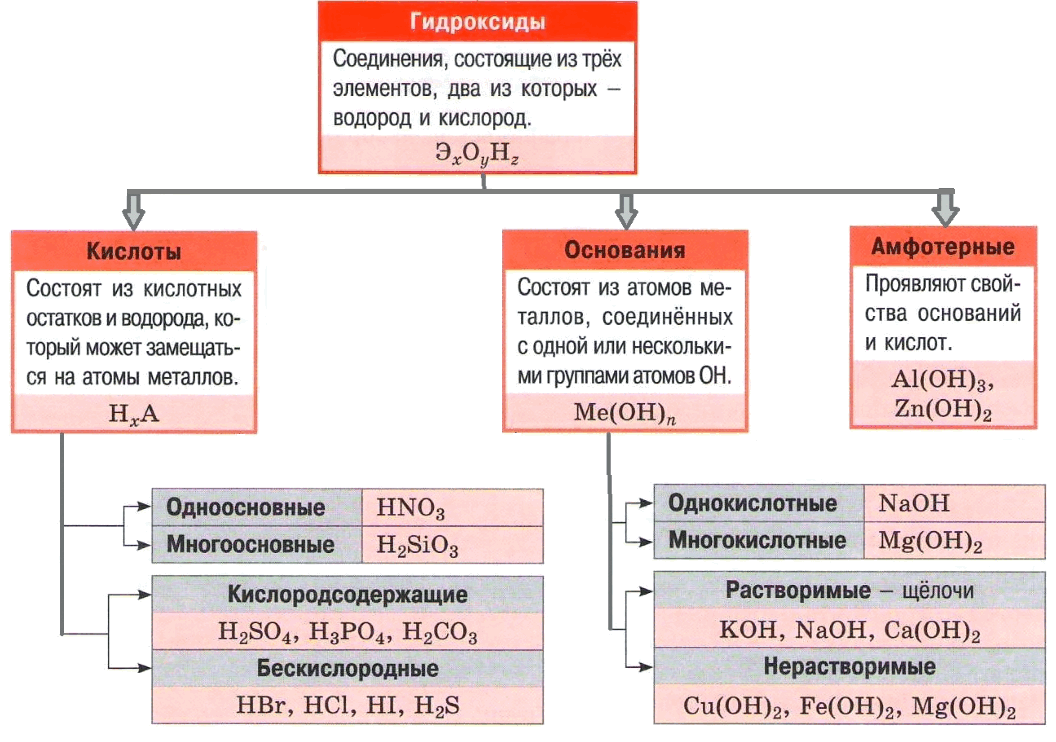
Кислоты – это электролиты, в результате диссоциации которых в водных растворах образуется только один вид катионов – катионы водорода Н+ (точнее – катионы гидроксония H3O+).
НCl = Н+ + Cl– (НCl + H2O = H3O+ + Cl–)
HNO3 = Н+ + NO3– (HNO3 + H2O = H3O+ + NO3–)
Кислоты – вещества молекулярного строения. Атомы в молекулах кислот связаны ковалентными полярными химическими связями. Чем более поляризована связь между атомом водорода, способным отщепляться в виде катиона водорода, и атомом какого–либо другого элемента, тем легче происходит её распад с образованием ионов, тем сильнее кислота.
Классифицировать кислоты можно по разным признакам.
По содержанию кислорода кислоты могут быть бескислородными (например, НCl, НВг, HI, H2S, HCN) и кислородсодержащими (например, H2SO4, HNO3, H3PO4).
По числу атомов водорода в молекуле кислоты, способных замещаться атомами металлов (по основности), кислоты могут быть одноосновными (НCl, НВг, HI, HNO3), двухосновными (H2SO4, H2SO3, H2СО3, H2S), трёхосновными (H3PO4, H3AsO4) и т. д. Существуют и кислоты большей основности, например пирофосфорная Н4Р2O7 – четырёхосновная.
По степени диссоциации кислоты могут быть сильными (НCl, НВг, HI, HNO3, H2SO4) и слабыми (H2S, H2SiO3, H2CO3, СH3СООН).
По растворимости кислоты могут быть растворимыми в воде (H2SO4, HNO3, НCl, СH3СООН) и нерастворимыми в воде (H2SiO3, C17H35СООН).
По стабильности кислоты могут быть стабильными (H2SO4, НCl, H3РO4) и нестабильными (H2CO3, H2SO3, HNO2). Нестабильные кислоты, как правило, невозможно выделить в свободном состоянии, они существуют только в растворах.
По летучести кислоты могут быть летучими (НCl, HNO3, СH3СООН) и нелетучими (H2SO4, H3PO4, H2SiO3).
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
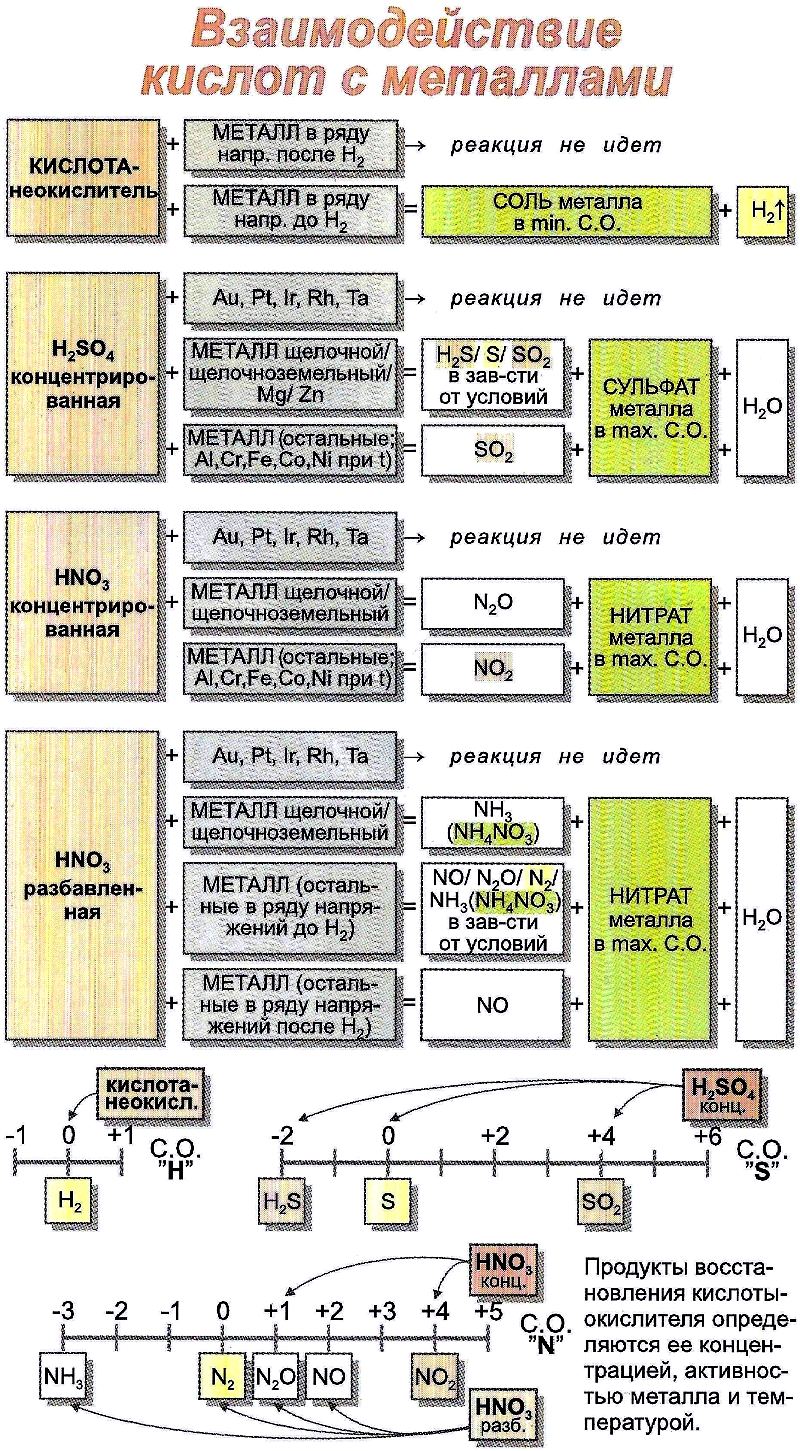
Кислоты реагируют с металлами. Металлы, расположенные в электрохимическом ряду напряжений металлов до водорода H2, вытесняют водород из растворов кислот. Происходит реакция замещения, образуется соль и водород:
Zn + 2НCl = ZnCl2 + H2↑
2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
Металлы, расположенные в ряду напряжений после водорода, с кислотами не реагируют.
Важное примечание: с серной концентрированной кислотой и с азотной кислотой любой концентрации реакции идут за счёт аниона кислотного остатка, водород в этих случаях не выделяется:
Cu+ 4HNO3 (конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
Киcлоты реагируют с основными и амфотерными оксидами с образованием соли и воды:

Кислoты реагируют с основаниями и с амфотерными гидроксидами с образованием соли и воды:
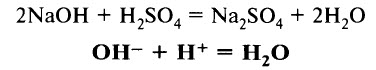
(Взаимодействие сильных кислот с сильными основаниями – реакция нейтрализации.)
Al(ОН)3 + 3НCl = AlCl3 + 3H2O
Al(ОН)3 + 3Н+ = Al3+ + 3H2O
(Реакция амфотерного гидроксида с сильной кислотой.)
Сильные кислоты реагируют с солями слабых кислот. Слабые кислоты при этом могут быть вытеснены из солей. Например, сильная соляная кислота НCl вытесняет слабую сероводородную кислоту H2S:
FeS + 2НCl = FeCl2 + H2S↑
FeS + 2Н+ = H2S↑ + Fe2+
Нелетучие кислоты могут вытеснить летучую из её соли. Например, нелетучая серная кислота H2SO4 вытесняет более летучую азотную HNO3. Обе кислоты – сильные. В растворе такая реакция не происходит. Она осуществима, если соль находится в кристаллическом виде (не в растворе), а серная кислота концентрированная:
Аналогично можно получить газообразный хлороводород, раствор которого – соляная кислота.
Кислoты можно обнаружить индикаторами. Индикаторы реагируют на наличие в растворе ионов Н+ (H3O+). Лакмус в кислой среде приобретает красный цвет, метиловый оранжевый – красный, фенолфталеин – бесцветный. Для обнаружения кислот удобно использовать лакмус.
ПОЛУЧЕНИЕ КИСЛОТ
Бескислородные кислоты, состоящие из двух элементов, могут быть получены синтезом простых веществ:
Кислородсодержащие кислоты могут быть получены в результате взаимодействия с водой соответствующих кислотных оксидов:
Нативная реклама
Р2O5 + 3H2O = 2H3РO4
SO3 + H2O = H2SO4
Слабые или летучие киcлoты могут быть вытеснены из солей более сильными или менее летучими кислотами. Например, сильная соляная кислота НCl вытесняет слабую уксусную кислоту СH3СООН:
CH3COONa + НCl = СH3СООН + NaCl
СH3СОО– + Н+ = СH3СООН
Летучие киcлoты могут быть вытеснены из солей менее летучими кислотами. Например, нелетучая серная кислота H2SO4 может вытеснить более летучую соляную НCl. Но в растворе такая реакция не пойдёт (обе киcлoты сильные). Она осуществима, если соль в кристаллическом состоянии (не в растворе) обработать серной концентрированной кислотой: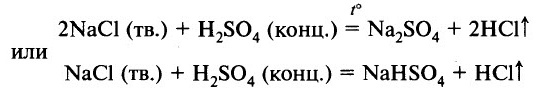
В результате этой реакции образуется газообразный хлороводород, при растворении которого в воде образуется соляная кислота.
Для получения слабых нелетучих кислот (например, ортофосфорной киcлоты или сернистой кислoты) лучше воспользоваться концентрированной серной кислотой, причём образующаяся сернистая кислота H2SO3 разлагается на сернистый газ SO2 и воду:
Са3(РO4)2 (тв.) + 3H2SO4 (конц.) = 3CaSO4 + 2H3РO4
Na2SO3 (тв.) + H2SO4 (конц.) = Na2SO4 + SO2↑ + H2O
Дополнительные материалы (схемы, таблицы)


Серная кислота - представляет собой маслянистую, тяжелую и бесцветную жидкость с необыкновенно сильными гигроскопическими свойствами. В своей концентрированной форме обладает также сильными окислительными свойствами. Серная кислота очень хорошо растворяется в воде во всех соотношениях, выделяя большое количество тепла. Что разъедает серная кислота?
Как сильная кислота, серная кислота разъедает металлы, камни, кожу, глаза, плоть или другие материалы. Он может обуглить дерево (но не вызовет возгорания). Эти эффекты в основном объясняются его сильной кислотностью, а в случае концентрирования - сильными обезвоживающими и окислительными свойствами.
Как получить серную кислоту реакция?
В настоящее время серную кислоту получают каталитическим окислением (на V2O5) оксида серы (IV) в оксид серы (VI), и последующим растворением оксида серы (VI) в 70 % серной кислоте с образованием олеума. ак растворить серную кислоту в воде?
Во всех учебниках и практикумах настоятельно рекомендуют лить серную кислоту в воду (тонкой струйкой и при хорошем перемешивании) - а не наоборот: нельзя лить воду в концентрированную серную кислоту! Почему? Серная кислота более тяжелая, чем вода. Если лить кислоту тонкой струйкой в воду, то кислота опустится на дно.
Разбавление кислоты ‑ приготовление раствора меньшей концентрации. Раствор меньшей концентрации содержит большее количество воды. Однако ни в коем случае при разбавлении нельзя добавлять воду в кислоту. Существует строгое правило: лить кислоту в воду!
Как приготовить 5% раствор серной кислоты?
5%-ный раствор серной кислоты
Покупаем чистую - нч серную кислоту 80-90%
Покупаем дистиллированную воду
Берем стеклянную емкость
Надеваем защитные очки и перчатки
Выливаем кислоту в банку
Затем осторожно вливаем в кислоту воду
Что будет если выпить серную кислоту?
Смертельная доза — 5 мл. Немедленно после приема кислоты появляются резкие боли в области рта и всего пищеварительного тракта, сильная рвота с примесью сначала алой крови, а затем бурыми массами (вследствие того, что кровь под действием кислоты принимает бурый цвет).
Как разлагается серная кислота?
Серная кислота называется моногидратом – в ней на 1 моль SO3 приходится 1 моль Н2О (воды). Из-за ее внушительных гигроскопических свойств ее используют для извлечения влаги из газов. Температура кипения – 330 °С. При этом происходит разложение кислоты на SO3 и воду.
Чем опасна серная кислота?
Серная кислота и олеум — очень едкие вещества, поражающие все ткани организма. При вдыхании паров этих веществ они вызывают затруднение дыхания, кашель, нередко — ларингит, трахеит, бронхит и т. д. Попадание кислоты на глаза в высокой концентрации может привести как к конъюнктивиту, так и к полной потере зрения.
Тест по теме «Кислоты» 8 класс
1). Кислоты – это
а). Сложные вещества, образованные атомами металлов и кислотными остатками.
б). Сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металлов и кислотных остатков.
в). Сложные вещества, в состав которых входят атомы металлов, соединённые с одной или несколькими гидроксогруппами.
2). Формула соляной кислоты:
а). H2SO4 б). Н2S в). НСI
3). Назовите эту кислоту: H2SO4
а). сернистая б). серная в). сероводородная
4). Формула борной кислоты:
а). НBr б). Н3ВО3 в). Н3РО4
5). Назовите эту кислоту: Н2SiO3
а). угольная б). сернистая в). кремниевая
6). Выберите ряд только бескислородных кислот:
а). HCI, HBr, HNO3 б). HBr, H2S, HI в). H2SO3, H2CO3, H3PO4
7). Выберите ряд двухосновных кислот:
а). H2SO4, H2CO3, H2SiO3 б). H2CO3, HBr, H3PO4 в). H2CO3, H3BO3, HCI
8). Укажите цвет лакмуса в кислотах:
а). розовый б). красный в). малиновый
9). Какая кислота является нерастворимой:
а). Н3ВО3 б). H2SiO3 в). Н2S
10). Выберите ряд металлов, которые с кислотами не реагируют:
а). Au, Pt, Pb, Ca б). Al, Ca, Zn, Mg в). Ag, Pt, Au, Cu
11). Какое уравнение написано неверно:
а). Zn + 2HCl → ZnCl2 + H2 ↑
б). 2HCl + Cu → CuCl2 + H2 ↑
в). Мg + H2SO4 → MgSO4 + H2 ↑
12). Укажите цвет фенолфталеина в кислотах:
а). бесцветный б). малиновый в). красный
13). Взаимодействие кислоты с основанием называется реакцией …..
а). соединения б). нейтрализации в). разложения
14). Какая кислота разлагается на углекислый газ и воду:
а). H2SO4 б). H2CO3 в). H2SiO3
15). Вещество, изменяющее цвет в растворах кислот, называется:
а). катализатор б). ингибитор в). индикатор
Ответы:
| 1 | б |
| 2 | в |
| 3 | б |
| 4 | б |
| 5 | в |
| 6 | б |
| 7 | а |
| 8 | б |
| 9 | б |
| 10 | в |
| 11 | б |
| 12 | а |
| 13 | б |
| 14 | б |
| 15 | в |