Конспект объясняющего модуля
Основания: классификация, номенклатура, получение, свойства
Ссылки на видеоуроки:
https://resh.edu.ru/subject/lesson/2442/main/
Основания, их классификация | Химия 8 класс #45 | Инфоурок
https://www.youtube.com/watch?v=80Wx5FWfT6w&t=85s
https://www.youtube.com/watch?v=dPp83Pwqr-M&list=PLvtJKssE5Nrhr0ibD7Zo5TFW0602KDTq4&index=17&t=57s
Каждый из вас в своей жидкости сталкивался с основаниями. Они есть в батарейках, в лекарственных препаратах, в строительном растворе. Они бывают окрашенными в разные цвета. Бывают едкими настолько, что о некоторых из них говорят: это едкий натр или едкое кали. И все же, все они основания.
Посмотрите на химические формулы: NaOH, Ba(OH)2, KOH. У всех веществ есть общая группа – гидроксогруппа или гидроксильная группа. Гидроксильная группа связана с атомом металла. Теперь мы можем сказать, какие вещества называют основаниями. Основания – это сложные вещества, в состав которых входят атомы металлов, соединённые с одной или несколькими гидроксогруппами (гидроксильными группами).
Названия оснований образуются так. Указываем наличие гидроксильной группы (гидроксид), добавляем название металла в родительном падеже: Zn(OH)2 – гидроксид цинка, Fe(OH)3 – гидроксид железа. Если металл имеет переменную валентность, указываем это в названии: Fe(OH)3 – гидроксид железа (III).
По растворимости в воде основания можно разделить на две группы: растворимые в воде (щелочи) и нерастворимые в воде.
Справочные материалы

Тривиальные названия некоторых оснований
| Баритовая вода | насыщенный водный раствор Ba(OH)2 |
| Известковая вода | насыщенный водный раствор Ca(OH)2 |
| Гашеная известь | Ca(OH)2 |
| Сода каустическая, едкий натр, каустик | NaOH |
| Едкое кали | KOH |
Химические свойства оснований
Термин «oснования» был введен в химию в XVIII веке. Считалось, что эти вещества служат основаниями для образования солей в твёрдой форме. Нерастворимые в воде основания встречаются в природе в составе минералов. Растворимые в воде основания – щёлочи – едкие вещества, способные вызвать сильный ожог.
Какими же свойствами характеризуются основания?
Сначала о свойствах нерастворимых оснований:
Разложение при нагревании
Cu(OH)2 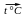 CuO + H2O
CuO + H2O
Нерастворимое основание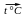 оксид + вода
оксид + вода
Взаимодействие с кислотами
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Нерастворимое основание + кислота = соль + вода
Свойства растворимых оснований (щелочей)
Взаимодействие с кислотами
Посмотрим, что будет при сливании растворов веществ.
NaOH + HCl = H2O + NaCl
Щелочь + кислота = вода + соль
Реакция нейтрализации – реакция между кислотой с основанием, в результате которой образуются соль и вода. Эта реакция лежит в основе действия лекарственных препаратов – антацидов.
Изменение окраски индикаторов
Щёлочи изменяют окраску индикаторов: лакмус становится синим, метилоранж – жёлтым, фенолфталеин – малиновым. Эту реакцию используют для качественного определения щелочной среды в растворах.
Взаимодействие с кислотными оксидами.
Посмотрим, что произойдёт, если в бутылку с углекислым газом поместить щёлочь:
2NaOH + CO2 = Na2CO3 + H2O
Щёлочь + кислотный оксид = соль + вода
Такая же реакция протекает при белении потолков гашеной известью – гидроксидом кальция.
Щёлочи могут взаимодействовать с растворами солей, с образованием другой соли и другого основания. Подробнее это свойство рассмотрим на других уроках.
С
правочный материал






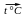 CuO + H2O
CuO + H2O

















