

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Комплексные соединения никеля
Категория:
Химия
13.07.2018 13:25







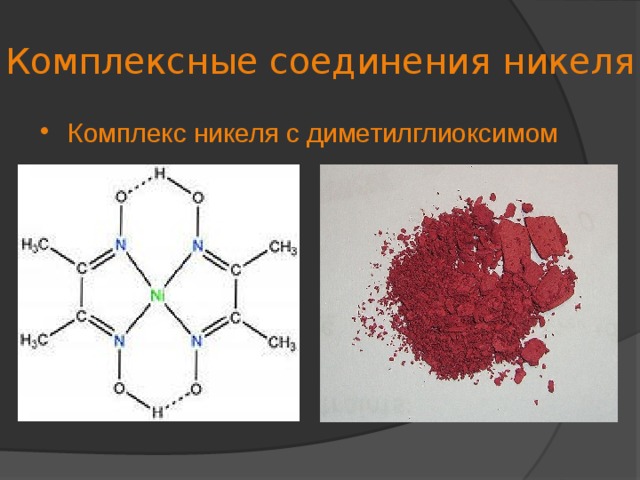

![Цианидные комплексы никеля Для никеля наиболее характерны цианидные комплексы. Их основными представителями являются K 4 [Ni 2 (CN) 6 ] и K 4 [Ni(CN) 4 ] . Лучше изучен цианид состава K 4 [Ni 2 (CN) 6 ], который в водной щелочной среде довольно устойчив, но в кислой среде из раствора осаждается оранжевый NiCN ↓ . В водном растворе K 4 [Ni 2 (CN 6 ] способен присоединять оксид углерода (II), при этом образуется неоднородное комплексное соединение K 4 [Ni 2 (CN) 6 (CO) 2 ], имеющее желтый цвет. В щелочных растворах оно, также как и K 4 [Ni 2 (CN) 6 ], довольно устойчиво, но в кислых распадается на K 2 [Ni(CN) 4 ] и Ni(CO) 4 .](https://fsd.multiurok.ru/html/2018/07/13/s_5b487da5b01e4/img6.jpg)
![Никель - амины Наиболее характерны гексааммины и акватетраммины с катионами соотв. [Ni(NH 3 ) 6 ] 2+ и [Ni(NH 3 ) 4 (H 2 O) 2 ] 2+ . Это голубые или фиолетовые кристаллические вещества, обычно растворимы в воде, в растворах ярко-синего цвета; при кипячении растворов и при действии кислот разлагаются; образуются в растворах при аммиачной переработке никелевых и кобальтовых руд.](https://fsd.multiurok.ru/html/2018/07/13/s_5b487da5b01e4/img7.jpg)



















