На уроках химии в школе учат решать различные задачи, популярными среди которых являются задачи на вычисление количества вещества. Однако понять этот материал бывает ребятам непросто, поэтому если необходимо узнать, как найти количество вещества, поможет в этом разобраться данная презентация. Итак, рассмотрим все по порядку.
Просмотр содержимого документа
«Количество вещества. Моль»

Тема:
Количество вещества. Моль

Расскажу сегодня, что ли, о зловредной роли моли.
Моль съедает шерсть и мех – просто паника у всех.
Ну а в химии - изволь! Есть другое слово «моль».
Прост, как небо и трава, моль любого вещества.
Но трудна его дорога: в моле так молекул много!

Сколько молекул содержится в одном моль любого вещества?
Как называется это число?

n =
N
N A
n – количество вещества, число молей;
N - число молекул, содержащихся в определенном количестве вещества;
N A - постоянная Авагадро N A = 6 *10 молекул/моль
23

Что такое моль?
Моль – это такое количество вещества, в котором содержится
23
6 *10 молекул этого вещества.

m
n =
M
n – количество вещества, число молей;
m - масса, г;
M - молярная масса, г/моль.

Только для газов при н.у. n =
V
V m
n – количество вещества, число молей;
V – объем газа;
V m – молярный объем газа
( V m = 22,4 л/моль)

Для газов можно производить вычисление: 1) плотности (г/л): þ =
М
V m
2) относительной плотности
Д Г2 (Г 1 ) =
М (Г1)
М (Г2)

М (воздуха) = 29 г/моль
Формула
M
С 4 Н 10
NO 2
n
?
m
?
5 моль
V
?
?
N
?
?
þ
?
1,12 л
Д Н2
?
?
?
воздух
?
?
?
?
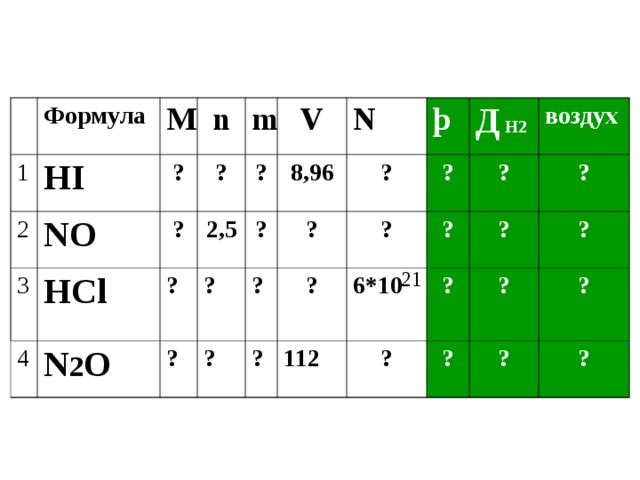
Формула
1
M
2
HI
?
n
3
NO
4
?
HCl
?
m
N 2 O
?
?
V
2,5
8 , 96
?
?
N
?
?
?
þ
?
?
?
?
?
Д Н2
?
112
6*10
воздух
?
?
?
?
?
?
?
?
?
?
?
?
21

Сам. работа
Заполнить пустые клетки в своем варианте с указанием единиц измерения и расчетами под таблицей
(7 действий)
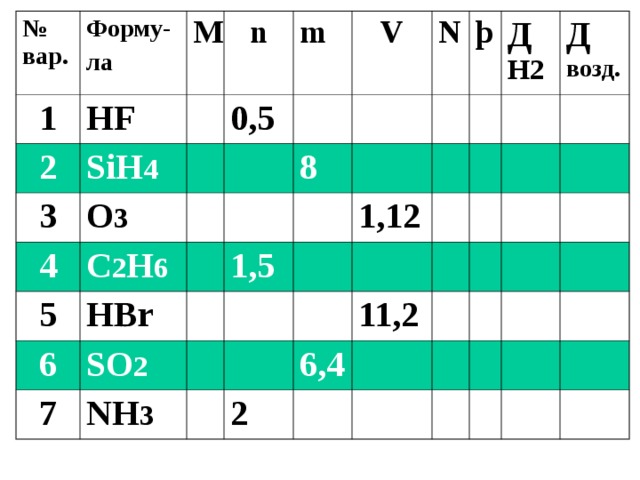
№ вар.
Форму-
ла
1
M
2
HF
n
3
SiH 4
m
4
O 3
0 , 5
5
V
C 2 H 6
HBr
6
8
N
þ
7
1,5
SO 2
1,12
Д Н2
NH 3
Д возд.
11,2
6,4
2
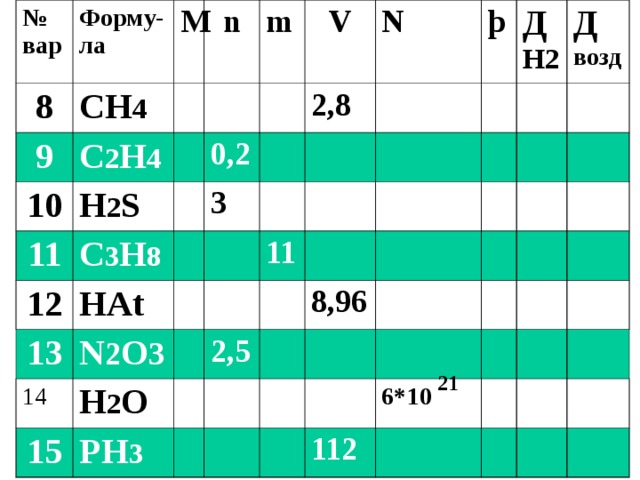
№ вар
8
Форму-ла
9
M
CH 4
10
C 2 H 4
n
11
H 2 S
m
12
C 3 H 8
0,2
V
H А t
13
3
N
2,8
14
N 2 O 3
þ
15
H 2 O
11
Д Н2
PH 3
2,5
Д возд
8,96
6* 10
112
?
?
?
21






































