Урок №9 8 класс _______
Тема. Кислород, его общая характеристика, нахождение в природе и получение.
Цель урока. Конкретизировать знания о химическом элементе и простом веществе.
Задачи урока: сформировать знания об Кислороде как химическом элементе и кислороде как простое вещество; познакомить учащихся с физическими свойствами, нахождением в природе и получением кислорода; развивать умение составлять план характеристики химических элементов, строить диаграммы по данным таблицы; развивать умение анализировать данные, познавательную активность; способствовать экологическому воспитанию учащихся.
Планируемые результаты обучения
Предметные. Уметь различать понятия «химический элемент» и «простое вещество» на примере кислорода. Уметь характеризовать физические свойства и способы собирания кислорода.
Метапредметные. Развивать умения работать по плану, организовывать учебное сотрудничество и совместную деятельность с учителем и сверстниками, формулировать, аргументировать и отстаивать своё мнение.
Личностные. Формировать ответственное отношение к учению, готовность к самообразованию.
Оборудование: Периодическая система химических элементов Д. И. Менделеева; на доске опорная таблица «Распространение Кислорода в природе»; на столах учащихся — карточки с упражнением «Гронирование» и с планом характеристики химического элемента и простого вещества.
Тип урока: усвоение новых знаний.
Ход урока
I. Организационный этап (2 мин.)
Подготовка учащихся к работе на уроке.
II. Актуализация опорных знаний (3 мин.)
Фронтальная беседа с классом.
Учитель. У нас есть большое количество разнообразных химических веществ, которые имеют свои свойства.
1. Какие свойства веществ мы знаем? (Физические и химические)
2. Чем вещества отличаются по свойствам? (Разным составом)
3. По составу молекул на какие две группы делятся вещества? (Простые и сложные)
4. Простые вещества по свойствам также делятся на две группы это? (Металлы и неметаллы)
III. Мотивация опорных знаний и умений учащихся (2 мин.)
Учитель. Сегодня мы будем изучать наиболее распространенный химический элемент, простое вещество которого имеет большое значение для жизни.
Этот элемент известен всем - и взрослым и малым,
Если названия кто-то не знает, по подсказке угадает…
В состоянии свободном
Газом он бывает,
С водородом и азотом
Воздух составляет.
Дышат птицы им и звери,
Люди и растения.
Его много в атмосфере,
В этом нет сомнения.
• Что это за химический элемент? (Оксиген)
IV. Изучение нового материала (30 мин.)
Сообщение темы урока, а учащиеся формулируют цели
Учитель. Пользуясь Периодической системой химических элементов Д. И. Менделеева дадим полную характеристику Кислорода по карте с планом. (Два ученика работают у доски, а класс – в тетрадях, после окончания работы учитель предлагает проверить правильность ответов)
1. ПЛАН ХАРАКТЕРИСТИКИ «Элемента и простого вещества»
1. Химический символ элемента — O.
2. Относительная атомная масса Ar(О) = 16
3. Валентность элемента в соединениях — равняется есть двум.
4. Распространение в природе
5. Химическая формула простой — O2.
6. Относительная молекулярная масса — Mr(O2) = 32.
7. Молярная масса — M(O2) = 32 г/моль.
2. Распространение в природе
Учитель. Используя опорную таблицу «Распространение Кислорода в природе» постройте круговую диаграмму «Содержание Кислорода в воздухе, земной коре, организме человека, Биосфере, Гидросфере в %». (По завершению работы учитель предлагает прокомментировать диаграмму)
Таблица 1. «Распространение Кислорода в природе»
| Организм человека | Гидросфера | Воздуха | Биосфера
| Земная кора |
| хим. элемент | массовая % | хим. элемент | массовая % | хим. элемент | массовая % | хим. элемент | массовая % | хим. элемент
| массовая % |
| O | 62 | O | 85,89 | N | 75,50 | O | 70 | O | 47,4 |
| C | 21 | H | 10,80 | O | 23,10 | C | 18 | Si | 27,6 |
| H | 10 | Cl | 1,90 | Ar | 1,286 | H | 10,5 | Al | 8,2 |
| N | 30,5 | Na | 1,05 | C | 0, 0151 | Ca | 0,5 | Fe | 4,1 |
| Ca | 2 | Mg | 0,12 | Ne | 0,0013 | K | 0,3 | Ca | 4,1 |
| P | 1,1 | S | 0,09 | Kr | 0,00029 | N | 0,3 | Na | 2,3 |
| K | 0,35 | Ca | 0,04 | гідроген | 0,000076 | Si | 0,2 | Mg | 2,3 |
| S | 0,25 | K | 0,04 | He | 0,000072 | Fe | 0,01 | K | 2,1 |
|
|
|
|
| озон | 0,000003 |
|
|
|
|
Желаемый результат: диаграмма «Содержание Кислорода в воздухе, земной коре, организме человека, Биосфере, Гидросфере в %».

3. История открытия кислорода. Получение
Учитель. Простое вещество кислород — одно из важнейших веществ для жизни на нашей планете, но в повседневной жизни мы его не замечаем и потому не задумываемся о его существовании. В этом причина, что кислород был открыт сравнительно недавно.
Китайский ученый VIII века. Мао–Хоа установил наличие в составе воздуха двух газов, один из которых имел свойство поддерживать дыхание и горение.
В Европе кислород одновременно открыли два выдающихся химика второй половины XVIII века. – швед Карл Шееле (1771) и англичанин Джозеф Д Пристли (1774) . Однако К. Шееле опубликовал свое открытие позже, чем Дж. Пристли.
Антуан Лавуазье (1775 г) установил, что кислород – составная часть воздуха, а Кислород входит в состав многих кислот и других веществ. Ученый исследовал кислород и создал кислородную теорию горения, которая пришла на смену теории флогистона.
ПОЛУЧЕНИЕ КИСЛОРОДА В ЛАБОРАТОРИИ
В лаборатории кислород получают в небольших количествах. Для этого используют легкоразлагающиеся с выделением кислорода вещества независимо от того, встречаются ли они в природе или получены искусственно. Для получения кислорода в лаборатории используют термически неустойчивые оксиды, соли и другие вещества.
A) РАЗЛОЖЕНИЕ ПЕРМАНГАНАТА КАЛИЯ. Рассказ учителя.
Разложение перманганата калия происходит при нагревании:
2КМnО4 ——К2МnО4 + МnО2 + О2.
Б) РАЗЛОЖЕНИЕ ОКСИДОВ ТЯЖЕЛЫХ МЕТАЛЛОВ. Рассказ учителя.
Оксиды тяжелых металлов разлагаются при нагревании с образованием металлов и кислорода: 2HgO —2Hg + O2 .
B) РАЗЛОЖЕНИЕ ПЕРЕКИСИ ВОДОРОДА Рассказ учителя.
Перекись водорода разлагается при обычных условиях на воду и кислород. При нагревании этот процесс идет быстрее, но ощутимо быстрее разложение перекиси водорода происходит в присутствии оксида марганца (IV): 2Н2O2 —Мп02=2Н2O + O2 .
Демонстрация.
В пробирку наливается небольшое количество (2—3 мл) 3—5 %-го раствора перекиси водорода. При комнатных условиях из раствора пероксида водорода медленно выделяется кислород. Затем при тех же условиях демонстрируется действие катализатора: в пробирку помещается небольшое количество оксида марганца (IV). При этом наблюдается обильное выделение кислорода, что можно определить с помощью тлеющей лучинки.
С помощью дополнительного эксперимента (повторное использование той же порции оксида марганца для разложения перекиси) можно доказать, что катализатор в процессе реакции не расходуется.
Рассказ учителя.
Вещества, которые изменяют скорость реакции (увеличивают или уменьшают ее), но сами при этом не расходуются, называются катализаторами .
Г) РАЗЛОЖЕНИЕ ИНДИЙСКОЙ (ИЛИ ЧИЛИЙСКОЙ) СЕЛИТРЫ. Рассказ учителя.
Кислород выделяется при разложении селитры: 2КNO3 = 2KNO2 + O2
ПОЛУЧЕНИЕ КИСЛОРОДА В ПРОМЫШЛЕННОСТИ
Д) РАЗЛОЖЕНИЕ ВОДЫ ЭЛЕКТРИЧЕСКИМ ТОКОМ (ЭЛЕКТРОЛИЗ).
Рассказ учителя.
Вода является устойчивым веществом, однако под действием такого сильного фактора, как электрический ток, она разлагается на простые вещества: 2Н2O —эл-ток 2Н2 + O2.
4. Физические свойства кислорода
Учитель. Давайте определим физические свойства кислорода с помощью учебника -
выполняем упражнение «Гронирование» (дети используют карточки)

О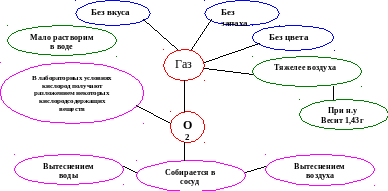 твет к упражнению «Гронирование»
твет к упражнению «Гронирование»

V. Обобщение и систематизация знаний . (3 мин.)
Учитель. Выполните упражнение "Сенкан" это краткое» стихотворение", состоящее:
1-я строка —существительное, например; Газ
2-я строка — два прилагательных (описание темы); Бесцветный, жидкий
3-я строка — три глагола (действие, относительно темы); Строит, разрушает, окисляет
4-я строка — фраза, раскрывающая тему и состоит из 4-х слов;
Жизненно важное простое вещество
5-я строка — новое существительное, собственное отношение к теме, или вывод. Кислород
(Учащиеся выполняют упражнение «Сенкан» и зачитывают свои ответы)
VI. Подведение итогов урока (3 мин.).
1. Оценивание учителем работы класса и отдельных учащихся
2. Аргументация выставленных оценок
VIІ. Домашнее задание (3 мин.) Проработать соответствующий параграф, написать сказку по данной теме.
VIІІ. Рефлексия
Использованная литература
1. Бабак Т. П., Водород и водород// Химия. Школьный мир. – 2004.-№26 (74), 09. -С.12-13.
2. Котолок Л. Использование интерактивных методов при изучении химии// Химия. Школьный мир. – 2005. - № 7 (403), февраль -С. 8-10.
3. Пометун О., Пироженко л. Современный урок. Интерактивные технологии обучения. — К.: АСК, 2005. – 207 с.
4. Северин Л. Интерактивные технологии обучения.// Химия. Школьный мир. – 2006. - № 13 (481), май -С. 9-12.
5. Химия. Программы для общеобразовательных учебных заведений. 5-12кл. – К.: Перун Ирпень, 2005
Приложение 1
ПЛАН ХАРАКТЕРИСТИКИ
1. Химический символ элемента —
2. Относительная атомная масса
3. Валентность элемента в соединениях —
4. Распространение в природе
5. Химическая формула простого —
6. Относительная молекулярная масса —
7. Молярная масса —










 твет к упражнению «Гронирование»
твет к упражнению «Гронирование»
















