
Аминокислоты Пептиды Белки
Лекция

Белки
Общая характеристика белков
Белки - это органическое соединение, состоящее из аминокислот, соединенных пептидной связью .
Протеины – (от греческого
protos – первый, важный)
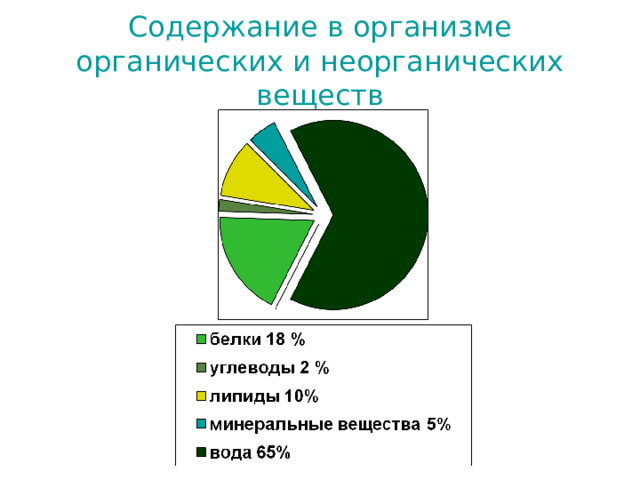
Содержание в организме органических и неорганических веществ

- Сухое вещество большинства органов и тканей человека и животных, а также большая часть микроорганизмов состоят главным образом из белков (40-50%).
- В мышцах и печени -22%
- В мозге -11%
- В жировой ткани-6%
- Белки осуществляют обмен веществ и энергетические превращения, неразрывно связанные с активными биологическими функциями.

Аминокислоты
- Аминокислоты – карбоновые кислоты альфа-углеродный атом водорода которых замещен на аминогруппу.
- Мономерами пептидов и белков являются - аминокислоты.
содержат карбоксильную ( COOH )
и аминогруппу ( NH 2 )
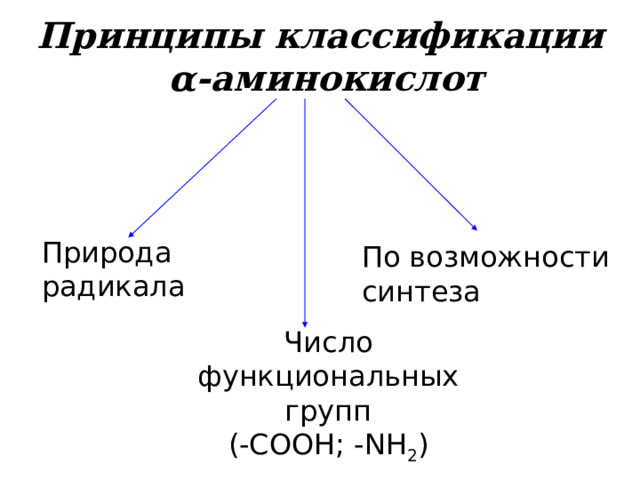
Принципы классификации α -аминокислот
Природа радикала
По возможности синтеза
Число функциональных групп
(-СООН; - NH 2 )
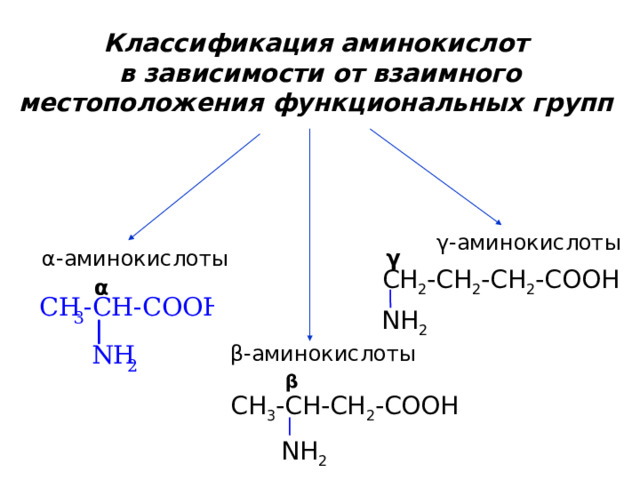
Классификация аминокислот
в зависимости от взаимного местоположения функциональных групп
γ -аминокислоты
γ
α - аминокислоты
CH 2 -CH 2 -CH 2 -COOH
α
NH 2
β -аминокислоты
β
CH 3 -CH-CH 2 -COOH
NH 2

Классификация аминокислот По образованию в организме:
Заменимые
Цистеин
Глицин
Пролин
Аланин
Аспарагин
Аспарагиновая кислота
Глутамин
Глутаминовая кислота
Серин
Тиразин
- Цистеин Глицин Пролин Аланин Аспарагин Аспарагиновая кислота Глутамин Глутаминовая кислота Серин Тиразин
Аргинин
Гистидин (последние незаменимы для детей)
Незаменимые
Валин
Лейцин
Изолейцин
Лизин
Треонин
Триптофан
Метионин
Фенилаланин
- Треонин Триптофан Метионин Фенилаланин
синтезируются в организме
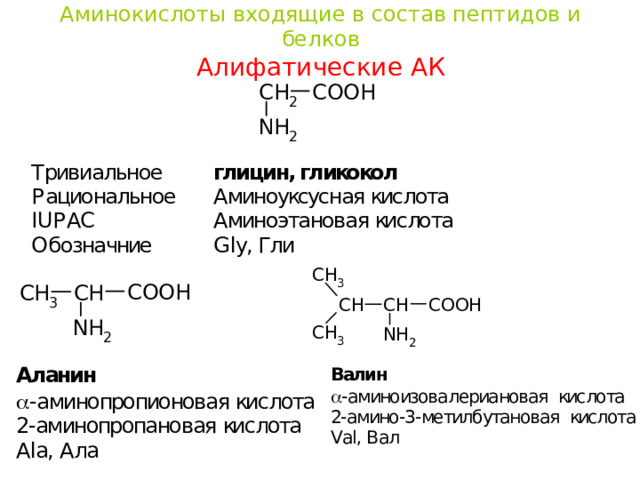
Аминокислоты входящие в состав пептидов и белков Алифатические АК
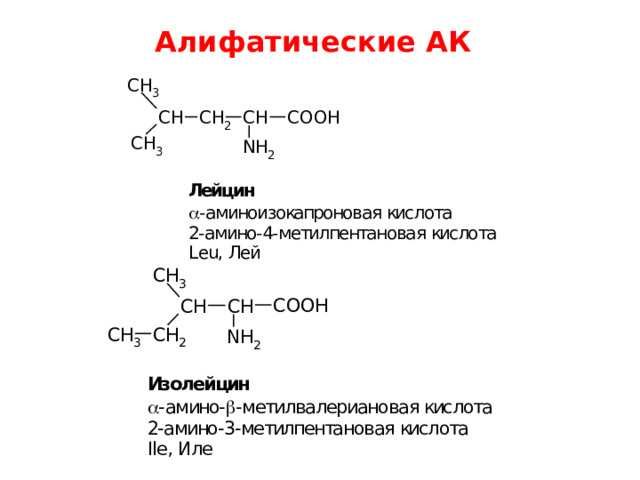
Алифатические АК
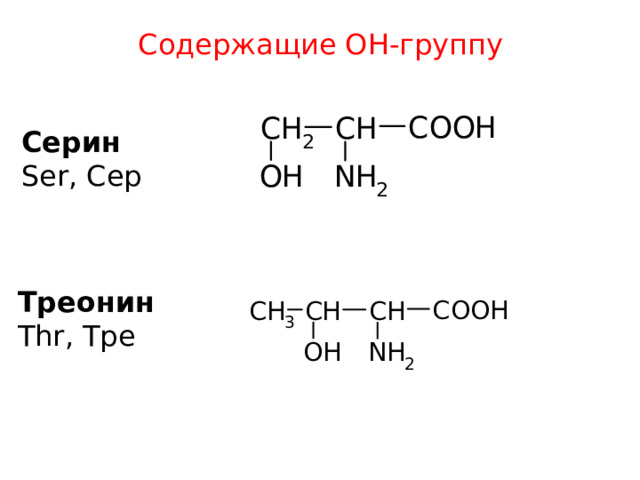
Содержащие ОН-группу
Ceрин
Ser, Сeр
Трeонин
Thr, Трe
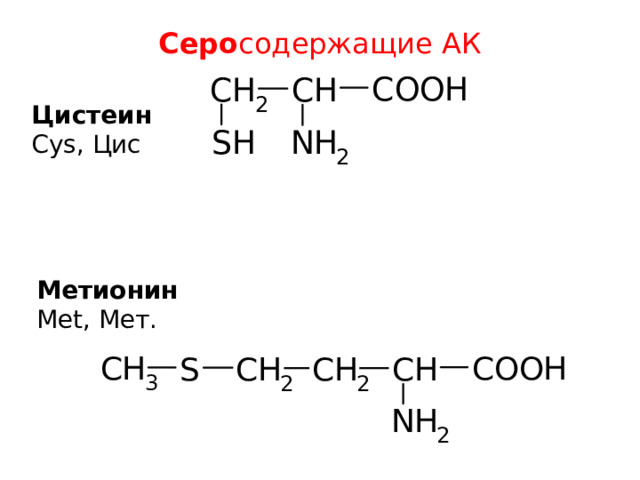
Серо содержащие АК
Цистeин
Cys, Цис
М e тионин
Met, Мет.
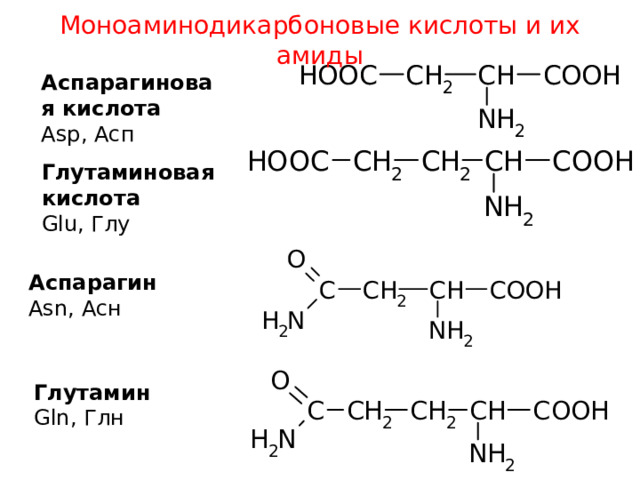
Моноаминодикарбоновые кислоты и их амиды
Аспарагиновая кислота
Asp , Асп
Глутаминовая кислота
Glu , Глу
Аспарагин
Asn, Асн
Глутамин
Gln, Глн
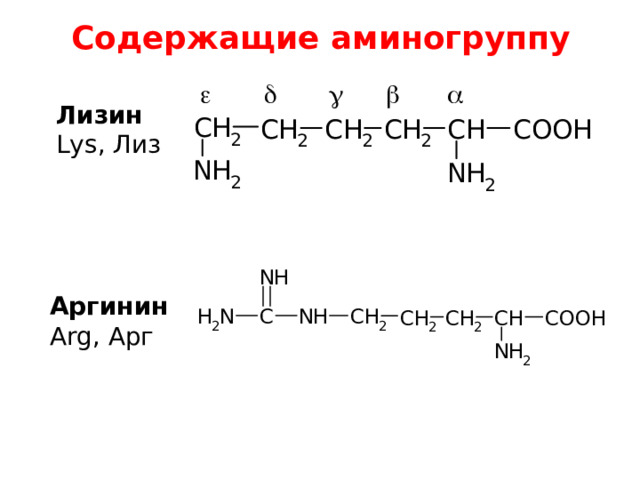
Содержащие аминогруппу
Лизин
Lys, Лиз
Аргинин
Arg, Арг
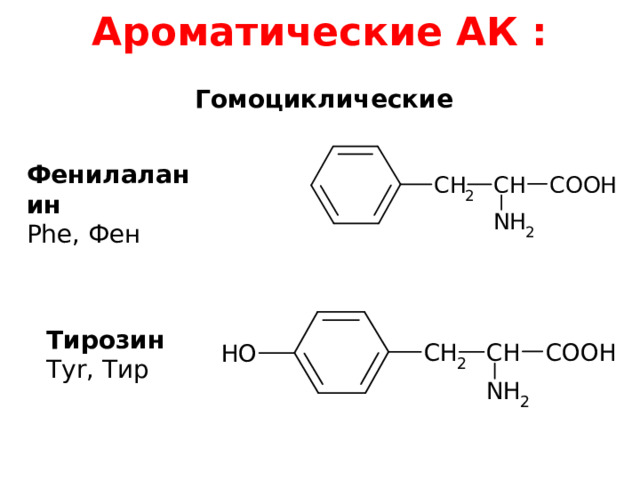
Ароматические АК : Гомоциклические
Фенилаланин
Phe, Фен
Тирозин
Tyr, Тир
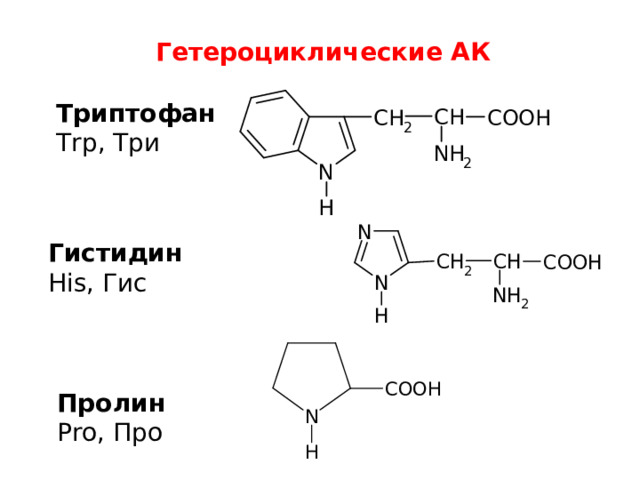
Гетероциклические АК
Триптофан
Trp, Три
Гистидин
His, Гис
Пролин
Pro, Про

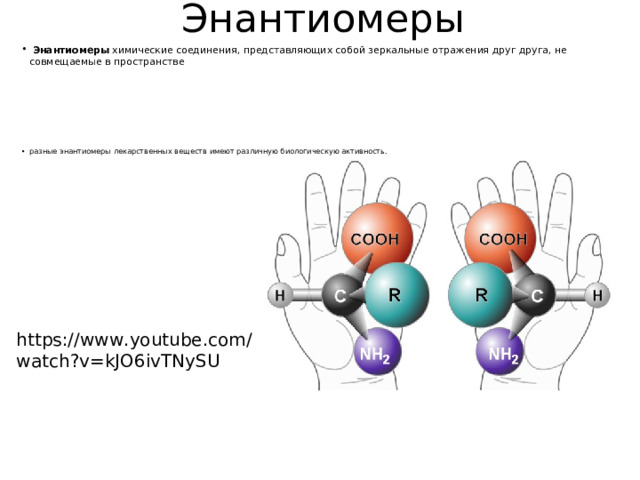
Энантиомеры
- Энантиомеры химические соединения, представляющих собой зеркальные отражения друг друга, не совмещаемые в пространстве
- разные энантиомеры лекарственных веществ имеют различную биологическую активность.
https://www.youtube.com/watch?v=kJO6ivTNySU
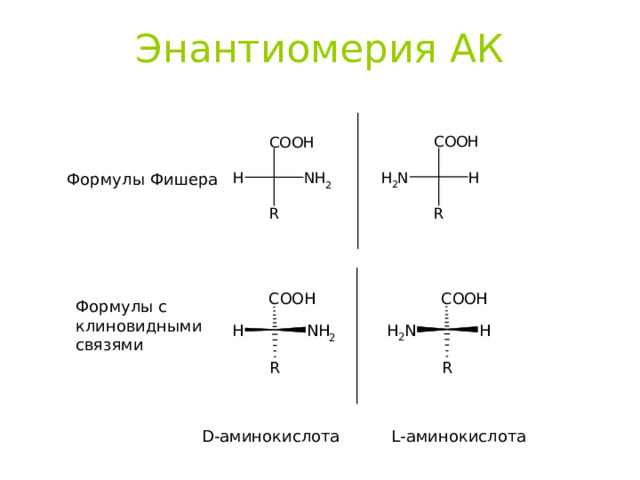
Энантиомерия АК
Формулы Фишера
Формулы с
клиновидными
связями
D- аминокислота L- аминокислота

Энантиомерия АК
В природных белках присутствуют остатки только L- аминокислот.
В пептидах бактериального происхождения есть остатки D- аминокислот.
Глицин не имеет энантиомеров, т.к. нет хирального атома углерода.

Физические свойства
Аминокислоты:
- бесцветные кристаллические вещества
- сладкие на вкус
- хорошо растворяются в воде
- имеют температуру плавления 220 0 - 315 0 С.
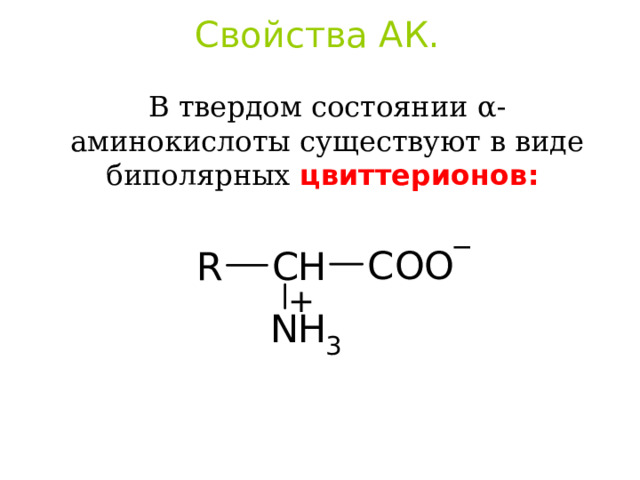
Свойства АК.
В твердом состоянии α -аминокислоты существуют в виде биполярных цвиттерионов :
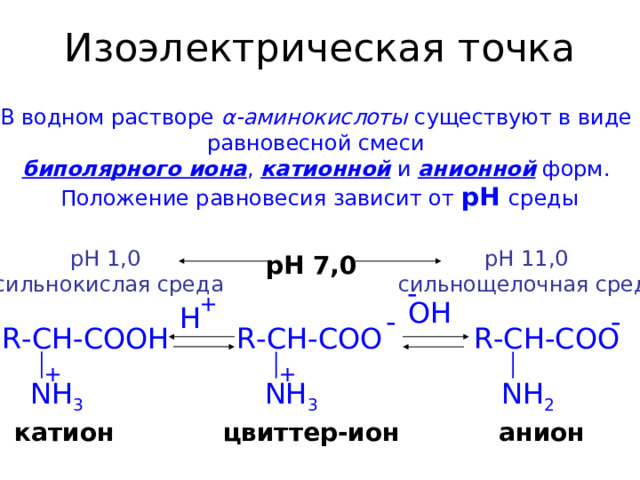
Изоэлектрическая точка
В водном растворе α -аминокислоты существуют в виде
равновесной смеси
биполярного иона , катионной и анионной форм.
Положение равновесия зависит от pH среды
pH 11 ,0
сильнощелочная среда
pH 1,0
сильнокислая среда
pH 7,0
-
+
OH
H
-
-
R-CH-COOH
R-CH-COO
R-CH-COO
+
+
NH 3
NH 2
NH 3
анион
катион
цвиттер-ион

Изоэлектрическая точка
Изоэлектрическая точка α -аминокислоты – это то значение pH раствора, при котором большинство молекул существуют в виде биполярных ионов, а концентрации катионной и анионной форм минимальны и равны.

Пептиды
Пептиды- органические молекулы, в состав которых входит несколько остатков аминокислот, связанных пептидной связью.
Пептидная связь образуется между карбоксильной группой одной аминокислоты и аминной группой другой аминокислоты:
NH 3 −CH− CO−NH − CH−COOH
l l
R R
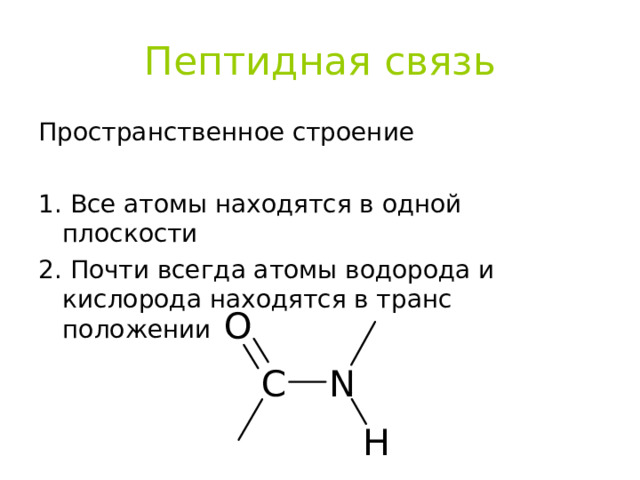
Пептидная связь
Пространственное строение
1. Все атомы находятся в одной плоскости
2. Почти всегда атомы водорода и кислорода находятся в транс положении
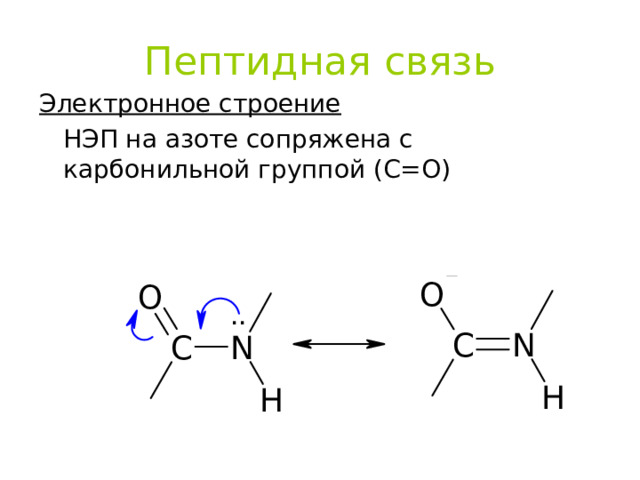
Пептидная связь
Электронное строение
НЭП на азоте сопряжена с карбонильной группой (С=О)
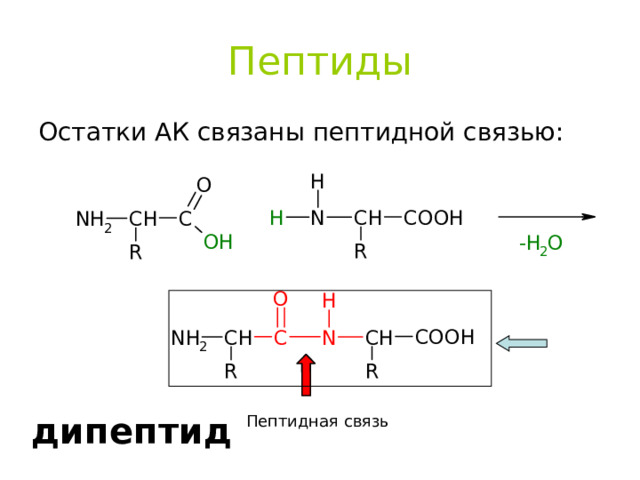
Пептиды
Остатки АК связаны пептидной связью :
дипептид
Пептидная связь
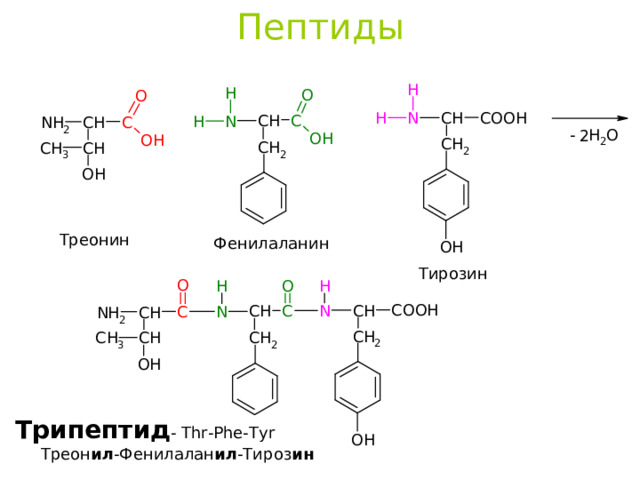
Пептиды
Треонин
Фенилаланин
Тирозин
Трипептид - Thr-Phe-Tyr
Треон ил -Фенилалан ил -Тироз ин

Классификация пептидов
- Низкомолекулярные пептиды - содержат от 2 до 10 аминокислот.
- Олигопептиды - так называемые «средние молекулы», они содержат от 10 до 50 аминокислотных остатков.
- Полипептиды - высокомолекулярные пептиды, содержащие от 50 до 100 аминокислот

Пептиды и белки
Пептиды и белки - продукты поликонденсации аминокислот.
М r пептидов меньше 10 000, у белков больше 10 000 .
- Инсулин (субъединица) – 6500
- белок вируса гриппа – 320 000 000.
Пептиды проходят через полупроницаемую мембрану, белки не проходят.
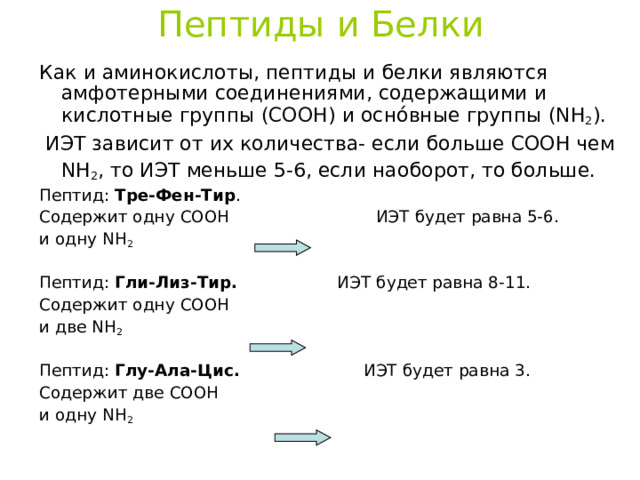
Пептиды и Белки
Как и аминокислоты, пептиды и белки являются амфотерными соединениями, содержащими и кислотные группы (COOH) и осн ó вные группы ( NH 2 ) .
ИЭТ зависит от их количества- если больше COOH чем NH 2 , то ИЭТ меньше 5-6, если наоборот, то больше.
Пептид : Тре-Фен-Тир .
Содержит одну COOH ИЭТ будет равна 5-6.
и одну NH 2
Пептид : Гли-Лиз-Тир. ИЭТ будет равна 8-11.
Содержит одну COOH
и две NH 2
Пептид : Глу-Ала-Цис. ИЭТ будет равна 3.
Содержит две COOH
и одну NH 2

Анализ первичной структуры пептидов Метод Эдмана
Используя фенилизотиоцианат ( Ph-NCS ) последовательно отщепляют АК с N- конца и определяют образующиеся фенилтиогидантоиновые производные.
Прибор для автоматического определения первичной структуры – секвенатор (лат. Sequentia – последовательность).

секвенаторы
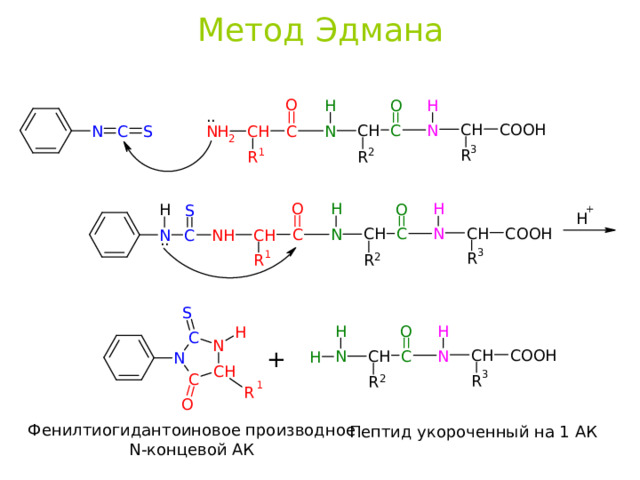
Метод Эдмана
Фенилтиогидантоиновое производное
N- концевой АК
Пептид укороченный на 1 АК


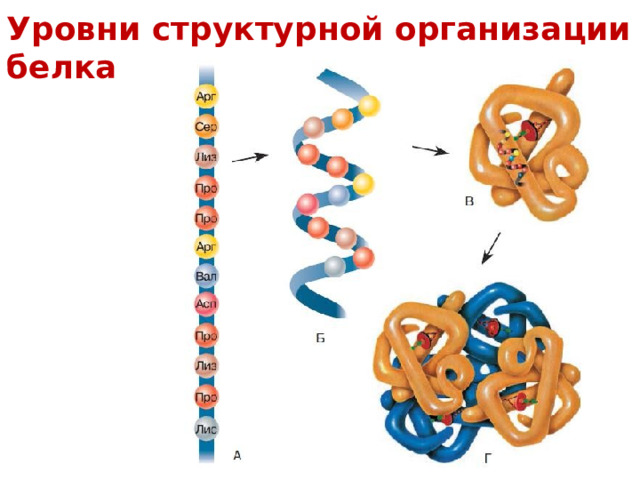
Уровни структурной организации белка
аминокислотная последовательность
- вторичная структура – локальные высокоупорядоченные конформации белковой цепи ( -спираль, -структура)
- третичная структура – форма белковой молекулы ; трёхмерная нативная структура белка
- четвертичная структура – агрегат из нескольких молекул белка

первичная структура
- первичная структура – определенная последовательность аминокислотных остатков в молекуле белка или пептида .
NH 2 -Tyr-Pro-Lys-Gly-Phe-Tyr-Lys-COOH
Первичная структура определяет все остальные уровни структурной организации белка

Замена Глу в шестом положении - цепи гемоглобина на Вал в следствии мутации приводит к серповидно-клеточной анемии.
Гемоглобин становится неустойчивым

- Количество возможных первичных структур ОГРОМНО!
- 20 аминокислот могут дать примерно 100000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000 белков, состоящих из 150 остатков аминокислот ( а возможны и другие варианты! )

Вторичная структура
Вторичная структура- определенное пространственное расположение полипептидной цепи.
α -спираль
β -складчатая структура
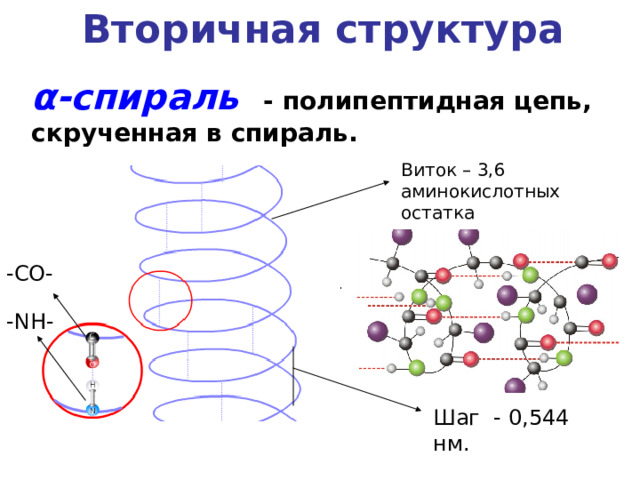
Вторичная структура
α -спираль - полипептидная цепь, скрученная в спираль.
Виток – 3,6 аминокислотных остатка
-CO-
-NH-
Шаг - 0,544 нм.
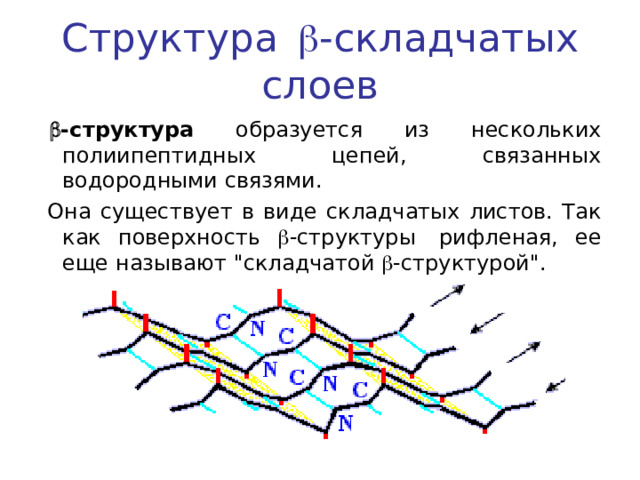
Структура - складчатых слоев
-структура образуется из нескольких полиипептидных цепей, связанных водородными связями.
Она существует в виде складчатых листов. Так как поверхность -структуры рифленая, ее еще называют "складчатой -структурой".
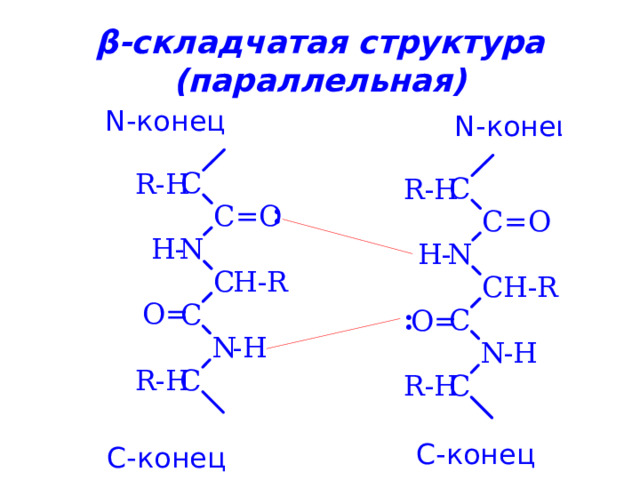
β -складчатая структура (параллельная)
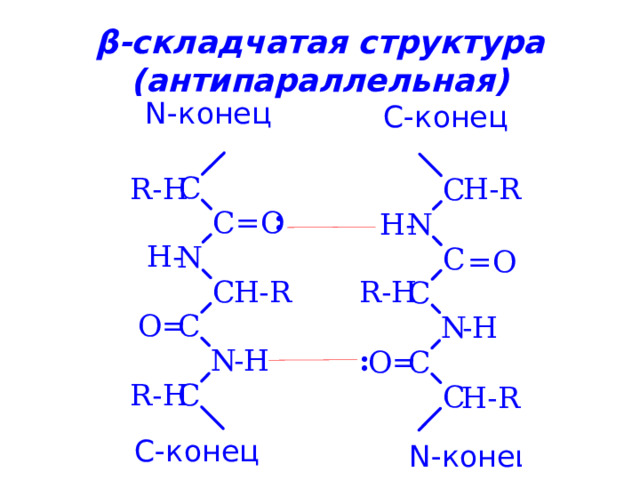
β -складчатая структура (антипараллельная)
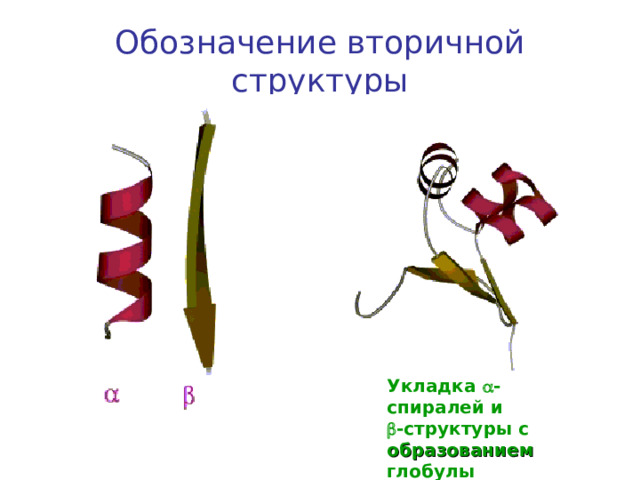
Обозначение вторичной структуры
Укладка -спиралей и
- структуры с образованием глобулы

Третичная структура
Родопсин (зрительный пигмент), светочувствительный белок палочек сетчатки глаза

Третичная структура
- третичная структура – форма белковой молекулы ; трёхмерная структура белка.
- Укладка нерегулярных областей и и -структур в глобулу определяет третичную структуру белка

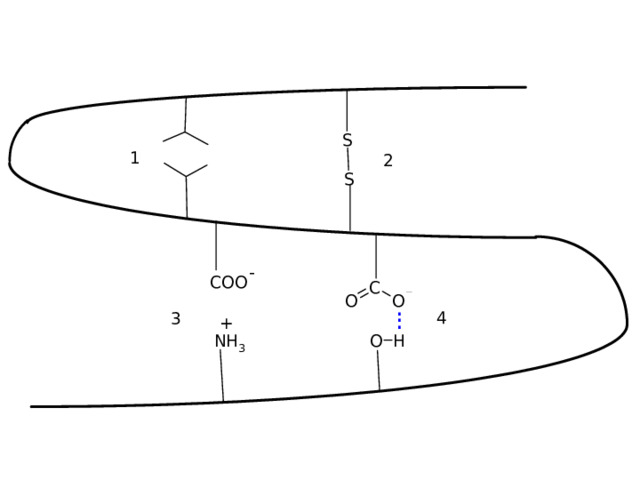
Взаимодействия остатков АК в третичной структуре
Остатки АК в белковой глобуле взаимодействуют за счёт :
- Гидрофобных взаимодействий
(они взаимодействиями не являются, но так называются)
(Вал, Лей, Иле, Фен)
2. Ковалентных связей
(дисульфидные –S–S– связи в цистине)
3. Ионных связей
(Глу- COO - H 3 N + - Лиз)
4. Водородных связей
(Глу- COO - …HO- Тир)
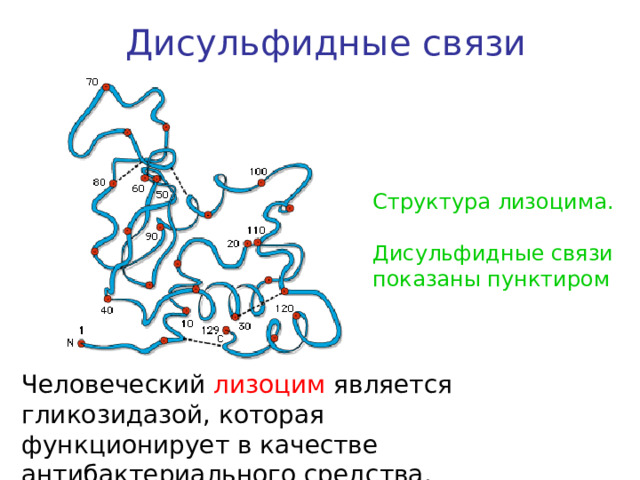
Дисульфидные связи
Структура лизоцима.
Дисульфидные связи
показаны пунктиром
Человеческий лизоцим является гликозидазой, которая функционирует в качестве антибактериального средства.
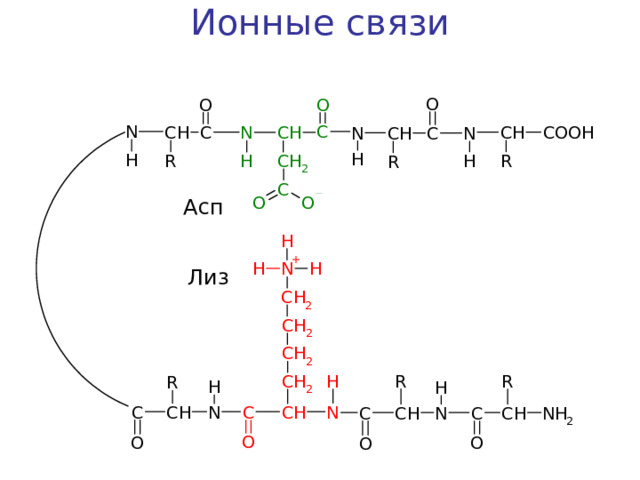
Ионные связи
Асп
Лиз
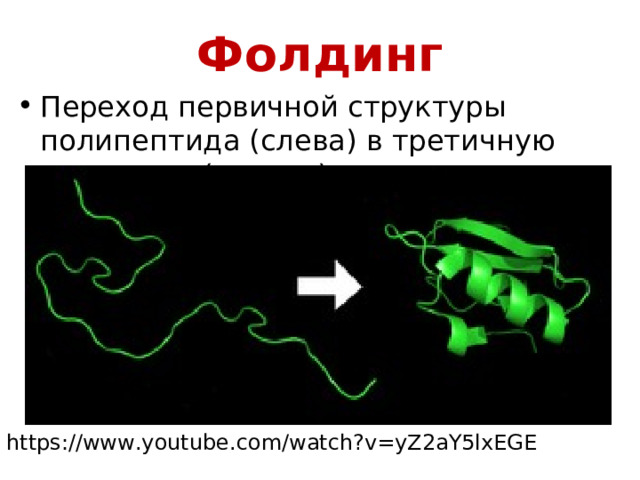
Фолдинг
- Переход первичной структуры полипептида (слева) в третичную структуру (справа).
https://www.youtube.com/watch?v=yZ2aY5lxEGE
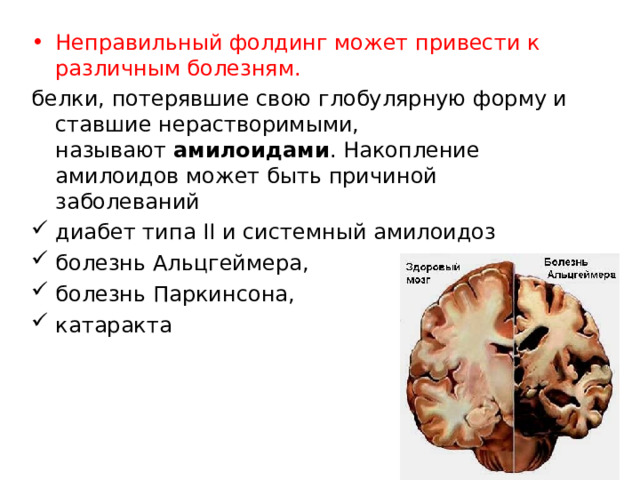
- Неправильный фолдинг может привести к различным болезням.
белки, потерявшие свою глобулярную форму и ставшие нерастворимыми, называют амилоидами . Накопление амилоидов может быть причиной заболеваний
- диабет типа II и системный амилоидоз
- болезнь Альцгеймера,
- болезнь Паркинсона,
- катаракта
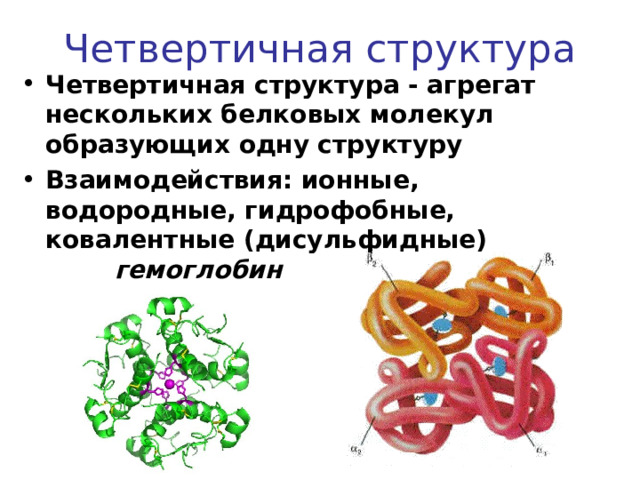
Четвертичная структура
- Четвертичная структура - агрегат нескольких белковых молекул образующих одну структуру
- Взаимодействия : ионные, водородные, гидрофобные, ковалентные (дисульфидные) гемоглобин
инсулин
Уровни структурной организации белка
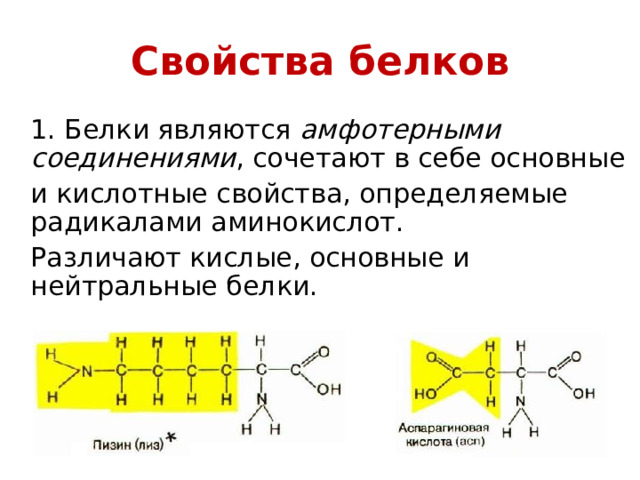
Свойства белков
1. Белки являются амфотерными соединениями , сочетают в себе основные
и кислотные свойства, определяемые радикалами аминокислот.
Различают кислые, основные и нейтральные белки.
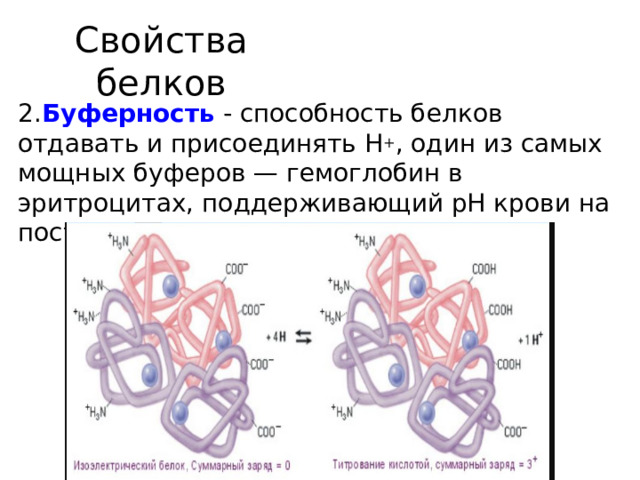
Свойства белков
2. Буферность - способность белков отдавать и присоединять Н + , один из самых мощных буферов — гемоглобин в эритроцитах, поддерживающий рН крови на постоянном уровне.
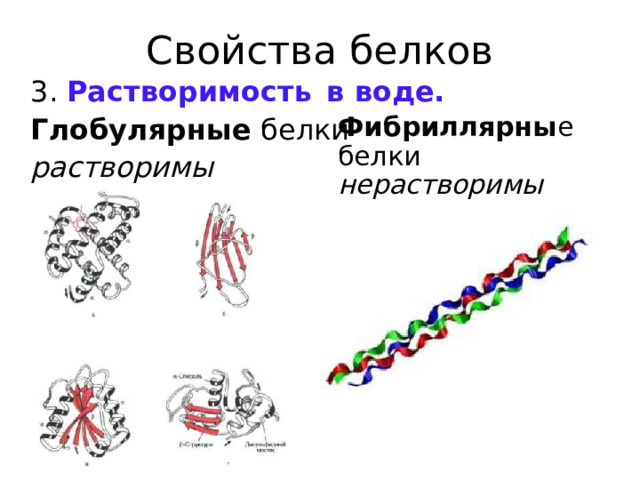
Свойства белков
3. Растворимость в воде.
Глобулярные белки
растворимы
Фибриллярны е белки нерастворимы

Свойства белков
4. Активность .
Есть белки необычайно химически активные ( ферменты ), есть химически неактивные.
5. Устойчивость.
Есть устойчивые к воздействию различных условий внешней среды и крайне неустойчивые .
Внешние факторы (изменение температуры, солевого состава среды, рН, радиация) могут вызывать нарушение структурной организации молекулы белка.

Свойства белков
6. Денатурация -
процесс утраты трехмерной конформации, присущей данной молекуле белка.
Изменение
пространственной
конфигурации
делает невозможным
выполнение белком
свойственных ему
биологических
функций.
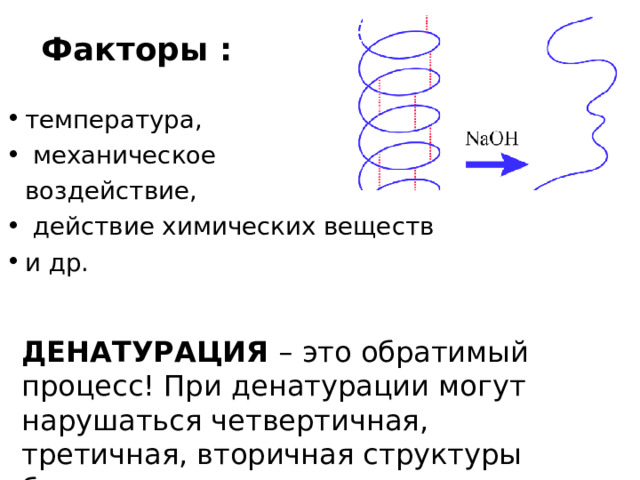
Факторы :
- температура,
- механическое
воздействие,
- действие химических веществ
- и др.
ДЕНАТУРАЦИЯ – это обратимый процесс! При денатурации могут нарушаться четвертичная, третичная, вторичная структуры белка.

Свойства белков
7. Процесс восстановления структуры белка после денатурации называется ренатурацией.
8. Разрушение первичной структуры
белковой молекулы называется деградацией.

Функции белков
Функция
Белки
Каталитическая
Ферменты
Сократительная
Актин, миозин
Геннорегуляторная
Гистоны, негистоновые ядерные белки
Гормональная
Инсулин
Защитная
Фибрин, иммуноглобулины, интерферон
Регуляторная
Кальмодулин
Структурная (опорная)
Коллаген, эластин, кератины
Транспортная
Альбумины (переносят билирубин, жирные кислоты и т.д.), гемоглобин (кислород), липопротеины (различные липиды), трансферрин (железо)

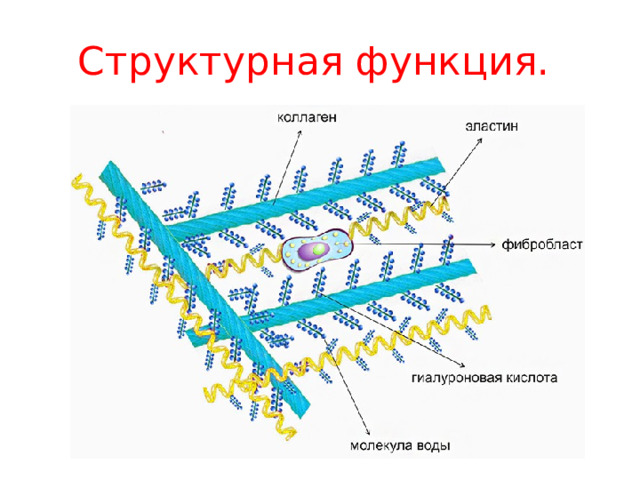
Структурная функция.
- Белки участвуют в образовании клеточных и внеклеточных структур: входят в состав клеточных мембран ( липопротеины , гликопротеины ), волос ( кератин ), сухожилий ( коллаген ) и т.д .
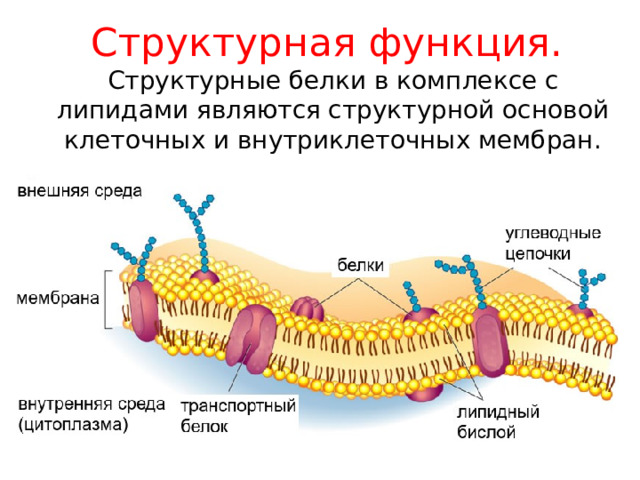
Структурная функция. Структурные белки в комплексе с липидами являются структурной основой клеточных и внутриклеточных мембран.
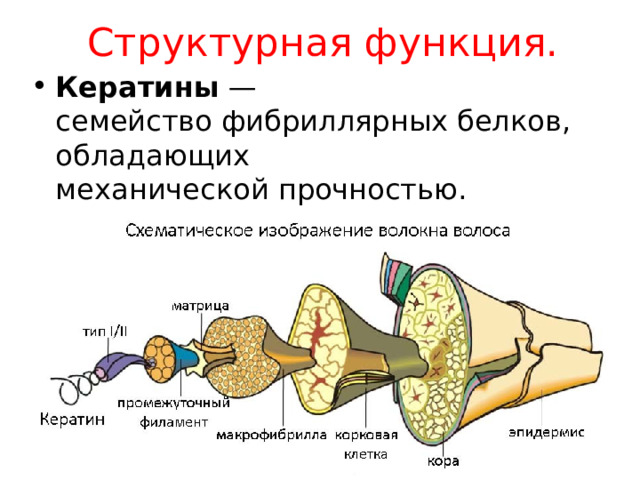
Структурная функция.
- Кератины — семейство фибриллярных белков, обладающих механической прочностью. (волосы, ногти, рога).
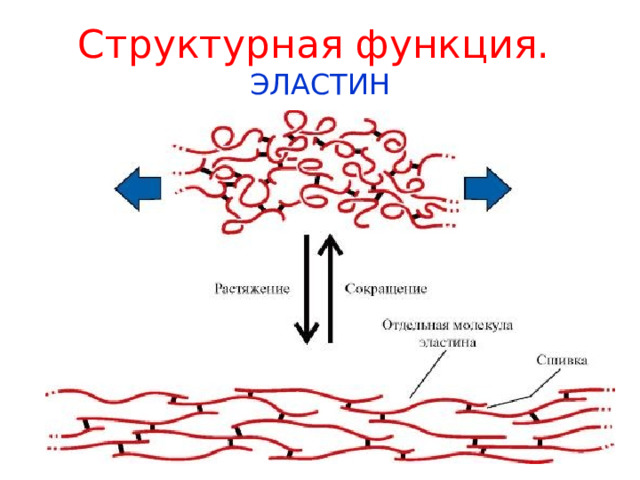
Структурная функция. ЭЛАСТИН
Структурная функция.
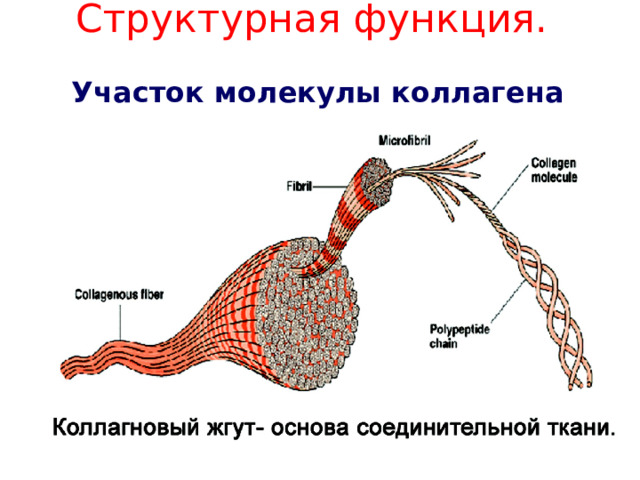
Структурная функция. Участок молекулы коллагена
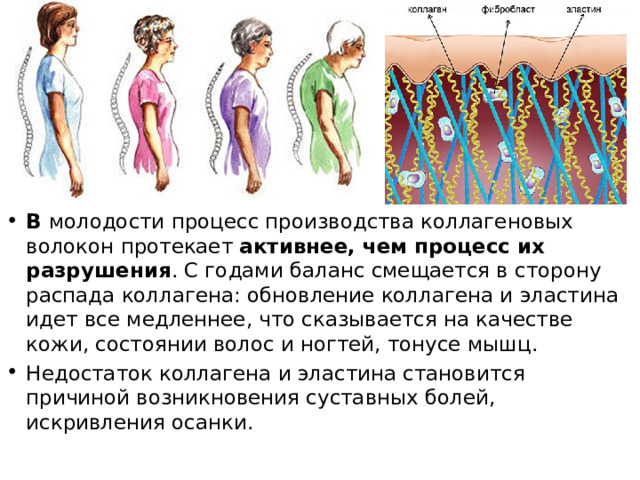
- В молодости процесс производства коллагеновых волокон протекает активнее, чем процесс их разрушения . С годами баланс смещается в сторону распада коллагена: обновление коллагена и эластина идет все медленнее, что сказывается на качестве кожи, состоянии волос и ногтей, тонусе мышц.
- Недостаток коллагена и эластина становится причиной возникновения суставных болей, искривления осанки.

транспортная функция
- В состав клеточных мембран входят белки, обеспечивающие активный избирательный перенос некоторых веществ и ионов из клетки во внешнюю среду и обратно.
https://www.youtube.com/watch?v=eEVlPQLIs0U
9.15
13.00
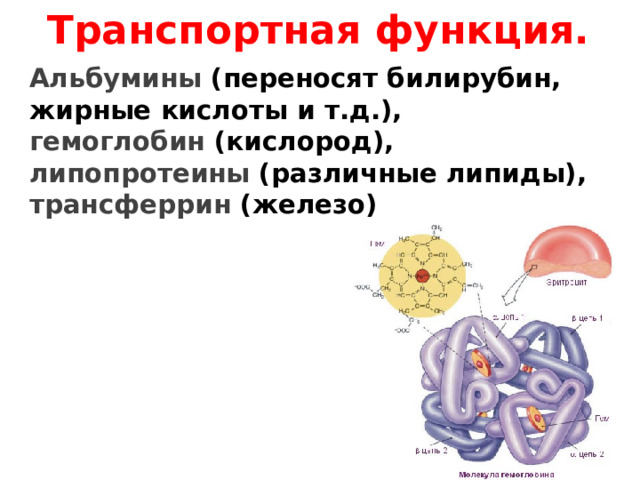
Транспортная функция.
Альбумины (переносят билирубин,
жирные кислоты и т.д.),
гемоглобин (кислород),
липопротеины (различные липиды),
трансферрин (железо)
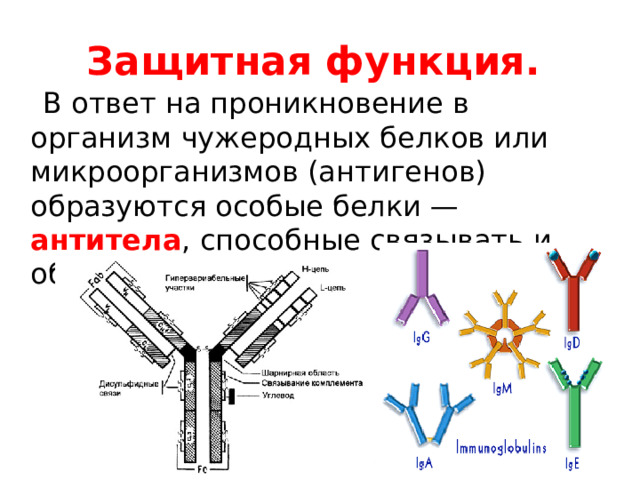
Защитная функция.
В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки — антитела , способные связывать и обезвреживать их.
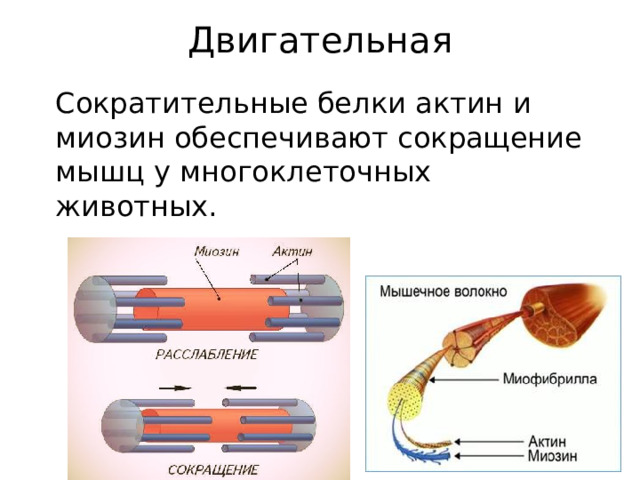
Двигательная
Сократительные белки актин и миозин обеспечивают сокращение мышц у многоклеточных животных.
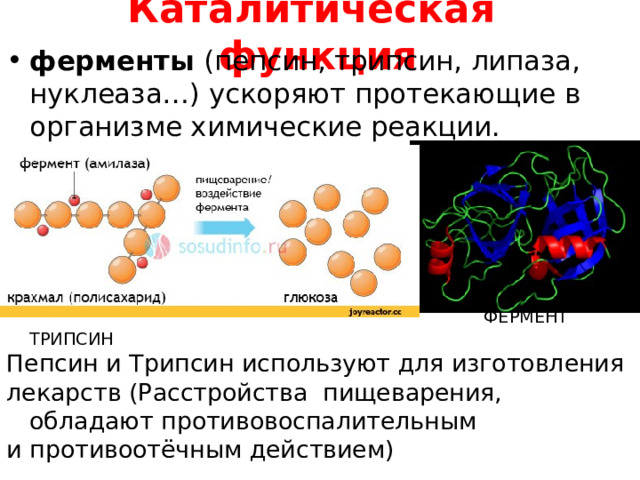
Каталитическая функция
- ферменты (пепсин, трипсин, липаза, нуклеаза…) ускоряют протекающие в организме химические реакции.
ФЕРМЕНТ ТРИПСИН
Пепсин и Трипсин используют для изготовления
лекарств (Расстройства пищеварения, обладают противовоспалительным
и противоотёчным действием)

Энергетическая
При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж.
Сначала белки распадаются до аминокислот, а затем до конечных продуктов — воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются только тогда, когда другие источники (углеводы и жиры) израсходованы.

Запасающая
В организме животных белки, как правило, не запасаются, исключение: альбумин яиц, казеин молока . Но благодаря белкам в организме могут откладываться про запас некоторые вещества, например, при распаде гемоглобина железо не выводится из организма, а сохраняется, образуя комплекс с белком ферритином .
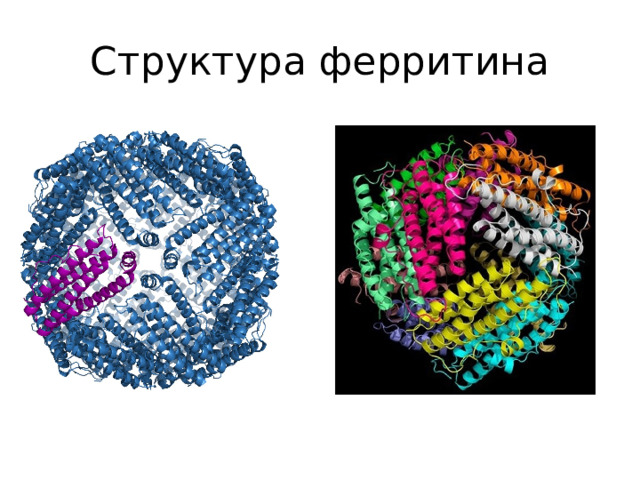
Структура ферритина

Регуляторная
Гормоны белковой природы принимают участие в регуляции процессов обмена веществ.
Например, гормон инсулин регулирует уровень глюкозы в крови, способствует синтезу гликогена, увеличивает образование жиров из углеводов.

БЕЛКИ ЗАМЕНИТЕЛИ САХАРА
Белок монеллин из тропического растения Dioscoreophyllum cumminsii в 3000 раз слаще сахарозы.

БЕЛКИ ЗАМЕНИТЕЛИ САХАРА
Белок тауматин ( E957 ) из тропического растения Thaumacoccus daniellii слаще сахарозы в 750-1000 раз, а его комплекс с ионами алюминия – талин – уже в 35000 раз.
Thaumacoccus daniellii

БЕЛКИ ЗАМЕНИТЕЛИ САХАРА
Белок миракулин из Synsepalum dulcificum имеет уникальное свойство воздействовать на вкусовые рецепторы, отключая на время восприятие кислого и горького вкусов, при этом все остальные вкусовые ощущения остаются.
Synsepalum dulcificum

Спасибо за внимание!











































































































